WEE1在胃癌、癌前病变、正常胃组织中的差异性表达及其临床意义
孟 海,赵成礼,潘伟伟,卢 芩
1.江苏省盐城市滨海县人民医院消化科,江苏盐城224500;2.东南大学附属中大医院消化科,江苏南京 210009
WEE1是丝氨酸/苏氨酸蛋白激酶基因家族的成员。在哺乳动物中,WEE1编码一个相对分子质量为94×103的蛋白,含647个氨基酸残基,并与髓鞘转录因子组成一个小的基因家族[1-2]。有研究表明,WEE1在各种类型的人类恶性肿瘤中的表达增加,包括黑色素瘤、卵巢癌、肝细胞癌、胶质母细胞瘤和乳腺癌,抑制WEE1的表达可抑制肿瘤细胞增殖,促进肿瘤细胞凋亡[3-4]。此外,WEE1蛋白的选择性抑制剂AZD1775通过促进DNA修复而增强T淋巴细胞急性淋巴细胞白血病对阿糖胞苷的敏感性[5]。因此,本研究选取74例胃癌患者、32例癌前病变患者、34例胃部良性疾病患者为研究对象,探讨WEE1在胃部不同病变组织中的差异性表达及临床意义,以期为胃癌的机制研究提供更多依据。
1 资料与方法
1.1一般资料 选取2011年1月至2013年9月滨海县人民医院收治的胃癌患者为研究对象。纳入标准:(1)首次确诊胃癌。(2)术前未行放化疗等抗肿瘤治疗。(3)无胃部手术史及其他病史。(4)临床资料及随访资料完整。排除标准:(1)围术期死亡病例。(2)合并有其他器官或系统的恶性肿瘤或有恶性肿瘤史。(3)因肿瘤相关肠梗阻等行急诊手术。最终,74例患者被纳入研究。其中男44例,女30例;年龄32~83岁,中位年龄54岁。选取同期因胃部癌前病变或胃部良性疾病而行切除手术的患者66例,其中肠型化生患者20例、异型增生患者8例、慢性萎缩性胃炎患者4例、胃部良性疾病患者34例,收集其标本及预后数据(无瘤生存期和5年生存率)。
1.2方法 采用免疫组化法检测胃部病变组织及正常组织中WEE1的表达。将2 μm厚度的组织切片在60 ℃下切烤1 h,二甲苯中脱蜡,乙醇洗涤(100%乙醇3 min,2次;95%乙醇3 min,2次;蒸馏水3 min);随后,切片在枸橼酸缓冲液(0.01 mmol/L,pH值为6.0,购自北京中山金桥生物技术有限公司)中进行微波热诱导抗原3 min,并冷却至室温,再逐渐加蒸馏水冲洗至少20 min;蒸馏水冲洗后,采用3%过氧化氢在室温下阻断内源性过氧化物酶;切片用磷酸盐缓冲液(PBS)冲洗5次(每次2 min);在4 ℃下与多克隆兔抗人WEE1抗体过夜孵育(稀释度1∶75);再次用PBS冲洗5次(每次2 min)后,切片用抗兔过氧化物免疫球蛋白G(稀释度1∶300)在37 ℃下孵育30 min;苏木精染色。通过计数区域的200个细胞检测WEE1染色,这些细胞集中在肿瘤细胞上。根据以往研究评分[6]:0为无阳性细胞;1+为<10%阳性细胞;2+为10%~50%阳性细胞;3+为>50%阳性细胞。如果评分为0,则WEE1蛋白的表达被定义为WEE1阴性;如果评分为1+、2+或3+,则被归类为WEE1阳性。

2 结 果
2.1WEE1在不同胃部病变组织中的表达 WEE1在胃癌细胞的细胞质、细胞核内均有表达,总体阳性率为43.2%(32/74)。在正常胃组织中阳性率为8.8%(3/34)。在癌前病变组织中的总体阳性率为21.9%(7/32),其中肠型化生、异型增生、慢性萎缩性胃炎的阳性率分别为25.0%(5/20)、12.5%(1/8)、25.0%(1/4)。WEE1在胃癌组织中的阳性率高于正常胃组织及癌前病变组织(χ2=12.600、5.895,均P<0.05)。见表1、图1。
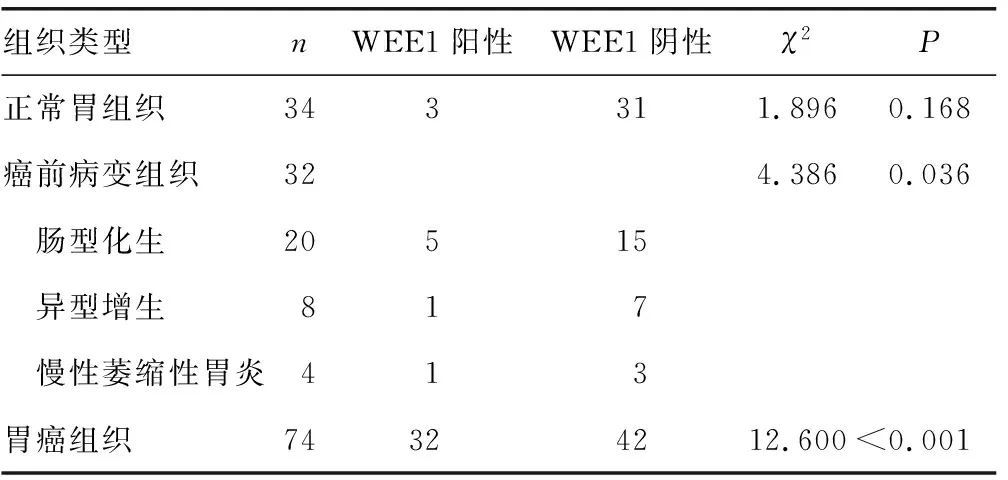
表1 WEE1在不同胃部病变组织中的表达(n)
2.2WEE1表达与胃癌病理参数的关系 肿瘤最大径、T分期、N分期、脉管浸润对WEE1表达有影响(P<0.05),但肿瘤部位、WHO分型、Lauren分型、M分期对WEE1表达无明显影响(P>0.05)。见表2。
2.3WEE1表达对患者预后的影响 对74例胃癌患者进行随访,6例患者失访,均为WEE1阴性患者;5年内胃癌患者死亡41例,其中,WEE1阴性组13例、WEE1阳性组28例,2组患者的5年生存率比较,差异有统计学意义(χ2=32.690,P<0.05)。见表3。
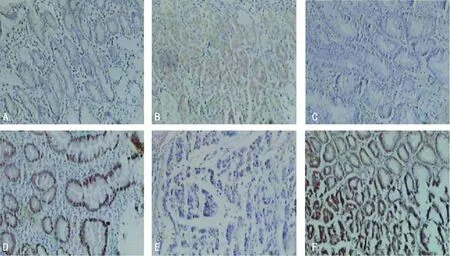
注:A为WEE1在正常胃组织中的阴性表达;B为WEE1在正常胃组织中的阳性表达;C为WEE1在肠型化生胃组织中的阴性表达;D为WEE1在肠型化生胃组织中的阳性表达;E为WEE1在胃癌组织中的阴性表达;F为WEE1在胃癌组织中的阳性表达。
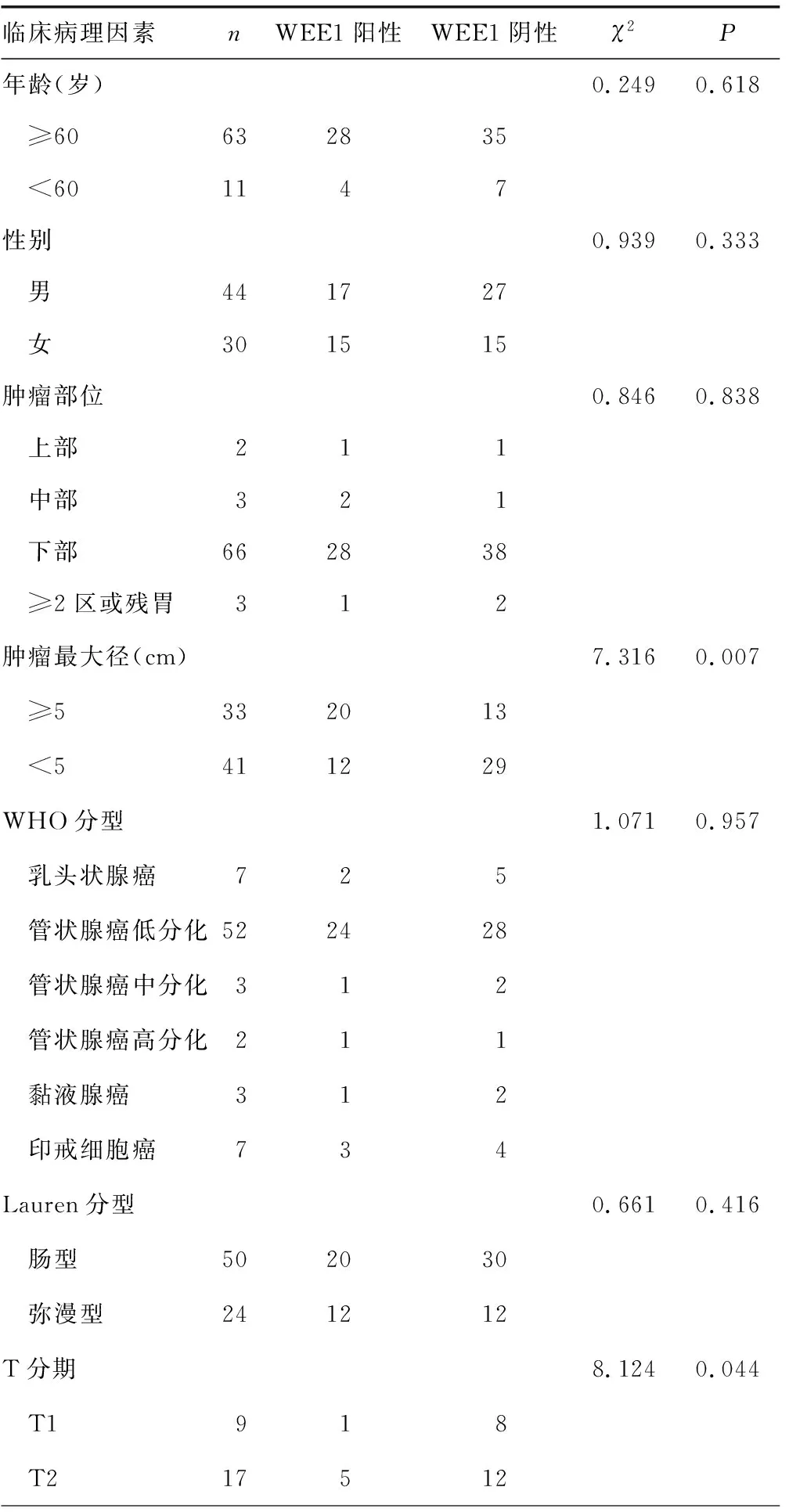
表2 WEE1表达与胃癌病理参数的关系(n)

续表2 WEE1表达与胃癌病理参数的关系(n)

表3 WEE1表达对患者预后的影响
3 讨 论
胃癌是我国最常见的消化道恶性肿瘤之一,随着我国社会经济的发展,人们的生活习惯、饮食习惯发生巨大改变,胃癌的发病率明显升高,寻找治疗胃癌的分子靶点有重要意义[7-8]。WEE1激酶是一种在细胞有丝分裂前G2~M期检查点阻滞中发挥关键作用的酶类[9-10]。正常细胞在G1期修复DNA,但肿瘤细胞伴有G1~S期检查点缺陷,通常依赖G2~M期检查点完成DNA修复,这为靶向WEE1激酶抑制的应用提供了理论基础[11-12]。临床研究证实,WEE1抑制剂AZD1775对一线治疗抵抗或耐药的TP53突变卵巢癌患者有效[13],但在胃癌中,WEE1的相关研究尚处于起步阶段。
本研究选取了74例胃癌患者、32例癌前病变患者、34例胃部良性疾病患者为研究对象,采用免疫组化法检测胃部病变组织及正常组织中WEE1的表达,结果发现,WEE1在胃癌、癌前病变、正常胃组织的阳性率分别为43.2%(32/74)、21.9%(7/32)、8.8%(3/34),胃癌组织中的阳性率高于正常胃组织及癌前病变组织(P<0.05)。与其他研究不同,本研究遵循胃癌的自然发生模式,即“正常组织-癌前病变-胃癌”模式进行WEE1检测,结果发现检出率呈明显升高趋势。这表明,随着WEE1表达强度的升高,机体对正常胃黏膜转变为恶性细胞的抑制能力减弱,细胞发生恶性增殖的能力变强,促进了胃癌的发生。本研究进一步分析了WEE1表达与胃癌临床病理参数的关系,结果发现,肿瘤最大径、T分期、N分期、脉管浸润对WEE1表达有影响。这提示临床,WEE1的表达上调可能参与了胃癌细胞的浸润和淋巴结转移的调节。这可能是由于:(1)WEE1阳性意味着胃癌细胞有更强大的分化增殖能力,致使肿瘤细胞更易生长、侵入淋巴管或血管,造成淋巴结转移甚至远隔转移。(2)脉管癌栓与胃癌分期有密切关系,WEE1可能通过促进脉管癌栓从而促进肿瘤转移。本研究随访发现,WEE1阳性患者死亡28例,WEE1阴性患者死亡13例。与WEE1阴性患者比较,WEE1阳性患者5年生存率较差,差异有统计学意义(P<0.05)。WEE1阳性患者无瘤生存期低于WEE1阴性患者(P<0.05)。这与WEE1对临床病理参数影响的结论相吻合。WEE1的阳性表达意味着更高的T分期与N分期,同时也可能导致脉管浸润的发生率升高。这些不良因素共同作用,致使WEE1阳性患者预后明显较差、无瘤生存期较短。相应地,WEE1阴性患者预后较好。
综上所述,WEE1在胃癌中有较高的阳性率,且与胃癌分期密切相关,其阳性表达是患者预后不良的强烈信号。但本研究为单中心研究,样本量较小,未来在多中心联合的基础上,实施更大样本量的研究,或能得出更具说服力的证据。

