海巴戟果提取物对凡纳滨对虾副溶血性弧菌的抑制效应
常逢彤,冯谦洁,黎 娜,周海龙
(海南大学 热带生物资源教育部重点实验室/生命科学与药学院 海口 570228)
海巴戟(Morinda citrifoliaLinn)为茜草科(Rubiaceae)巴戟天属(Morinda)植物,国外称之为诺丽(Noni)[1],广泛种植于太平洋地区,作为保健及药用植物已有上千年的历史[2],其果实、叶子、枝干、根部均可入药[3],在我国海南岛、西沙群岛和台湾岛也有分布。海巴戟各部位提取物均具有一定的抗菌、抑瘤等作用[4−5],其果实提取物是安全的天然抗氧化剂,具有抗氧化活性[6]、保护心肌细胞[7]和抑制肿瘤生长的作用,叶子提取物可用于治疗溃疡和轻微感染[8]。海巴戟的根、叶、果均含有抗氧化活性成分,且根的抗氧化活性最强[9]。海巴戟果汁对四氯化碳(CCl4)引起的肝损伤小鼠具有肝保护功能[10]。有研究表明,关节病患者摄入海巴戟果汁可以控制炎症,缓解关节不适,调节免疫系统[11]。由于海巴戟富含多种活性成分,国际市场已将它定位为药品和保健食品[12]。副溶血性弧菌(Vibrio parahaemolyticus,VP)是一种革兰氏阴性菌,属于弧菌科(Vibrionaceae)、弧菌属(Vibrio),无芽胞,有鞭毛,形态呈杆状、弧状、卵圆状等。该菌在含2%~4%氯化钠的培养基中生长旺盛,在氯化钠质量分数小于2%时基本不生长。副溶血性弧菌的致病性是溶血素、脲酶、黏附因子和分泌系统等多种致病因子相互作用的结果,机理较复杂。其主要致病因子是多种溶血毒素,主要有不耐热溶血毒素(Thermolabile hemolysin,TLH),耐热直接溶血毒素(Thermostable direct hemolysin,TDH)和相对耐热直接溶血毒素(TDH-related hemolysin,TRH)[13]。副溶血性弧菌常存在于海洋和河口生态系统及鱼、虾、贝类等水产品中[14]。凡纳滨对虾(Litopenaeus vannamei)又称南美白对虾,由于凡纳滨对虾具有较强的环境适应能力、生长快和抗病力强、经济效益显著等特点,是目前世界上养殖单产最高的对虾品种[15],也是世界三大高产量对虾养殖品种之一[16]。随着对虾养殖规模的不断扩大,对虾养殖病害发生频率亦相应增加,由副溶血性弧菌引起的疾病最常见,如红体病、红腿病、白斑病、肠炎病、烂鳃病等,导致对虾养殖业蒙受了巨大损失。近年来,急性肝胰腺坏死病(Acute Hepatopancreatic Necrosis Disease, AHPND)在凡纳滨对虾养殖中广为流行,患病对虾表现为红体、壳软,肠胃排空,肝胰腺变色、肿大后呈纤维化萎缩,最终坏死。该病3~5 d 致死率高达90%[17]。我国于2010 年在海南省首次发现该疾病,随后全国大部分对虾养殖区遭受感染,损失惨重。2012 年,LIGHTNER 等[18]首先报了AHPND 的致病原是副溶血弧菌,随后,又有多篇报道证明AHPND 是由副溶血弧菌引起[19−23],通过控制副溶血性弧菌可以大大减少AHPND 暴发的风险[24]。目前,水产养殖业对副溶血性弧菌的防治主要依赖抗生素,但抗生素的长期使用使得耐药菌株不断出现,多种副溶血性弧菌菌株已产生光谱耐药性。相关研究表明,副溶血性弧菌已对磺胺类、头孢类、氨基糖苷类和青霉素类药物出现不同程度的耐药性,对阿莫西林的平均耐药率已高达50%[25−27]。因此,寻找一种有效的天然抗菌物质已成为大家关注的焦点。据报道,植物提取物中的生物碱、萜类、单宁、皂苷、糖苷、黄酮类、酚类、甾体和精油等具有促进生长、改善免疫系统、抗菌能力、刺激食欲和抗应激特性等特性[28−30]。使用植物提取物作为水产养殖中抗生素可持续有效的替代品,具有治疗成本低、生物降解性好、耐药性低等优点[31−34]。本研究针对副溶血性弧菌对对虾产业的严重危害性,以海巴戟为材料,探究其提取物对凡纳滨对虾副溶血性弧菌的抑制效果,旨在为海巴戟在水产养殖领域的应用提供依据。
1 材料与方法
1.1 试验材料海巴戟果购于海口某农贸市场;副溶血性弧菌(Vibrio parahaemolyticus)为中国科学院海洋研究所分离株。
1.2 海巴戟热水提取物的制备采用传统煎煮法[35]对海巴戟果有效成分进行提取。取30 g 晒干的成熟海巴戟果,粉碎机粉碎后,加300 mL 水,浸泡30 min 后加热煮沸5 min(先文火后武火,期间边煮边搅拌),4 层纱布过滤,滤渣再加100 mL 水,直接加热煮沸5 min,4 层纱布过滤,合并2 次所得滤液。将合并后的滤液浓缩至30 mL,此时海巴戟果热水提取液终质量浓度为1 g·mL−1。将得到的提取物经高压灭菌(121 ℃,15 min)后分装于EP 管中,保存备用。
1.3 副溶血性弧菌菌液的制备用灭菌接种环将副溶血性弧菌划线接种与TCBS 琼脂平板上,于30 ℃恒温生化培养箱中培养12~16 h;挑取单个菌落接种于5 mL TCBS 液体培养基中,于30 ℃,180 r·min−1摇床培养12 h 后,用无菌生理盐水稀释,至菌液终密度为1.0×107cfu·mL−1,保存备用。
1.4 滤纸片法测定紫外线对海巴戟果提取物抑菌能力的影响取海巴戟果提取物原液15 mL 至于灭菌培养皿中进行紫外灯照射,照射时长分别为0、5、10、15、20、25 min,将副溶血性弧菌作为指示菌,取10 μL海巴戟果提取物原液吸附与灭菌滤纸片上,用无菌镊子置于含菌平板表面。平板置于30 ℃生化培养箱中恒温培养12~16 h,观察并采用十字测量法记录抑菌圈直径。每个试验组设置3 个重复,每个平板放置3 片滤纸,抑菌圈直径取平均值。
1.5 最小抑菌浓度(MIC)和最小杀菌浓度(MBC)的测定采用中药抗菌实验试管二倍稀释法[36]测定海巴戟果提取物的MIC 和MBC。取13 支无菌试管依次编号,1 号试管加9 mL TCBS 液体培养基,其余12 支试管,每管加5 mL。移液枪吸取浓度为1 g·mL−1的海巴戟果提取物2 mL,加入1 号试管中混匀;从1 号试管中取5 mL 加入2 号试管摇匀,如此依次倍比稀释直至11 号试管,最后从11 号试管中吸取5 mL 弃去。至此,1~12 号试管中海巴戟果提取物的质量浓度分别为100.00、50.00、25.00、12.50、6.25、3.13、1.56、0.78、0.39、0.20、0.10、0 g·L−1,12 号试管为对照。在1~12 号试管中分别加入密度为1.0×107cfu·mL−1的菌液0.2 mL 并混匀,13 号试管不加菌液,为空白对照。将13 支试管放入30 ℃,180 r·min−1摇床培养12~16 h,根据试管内液体的混浊程度判定海巴戟果提取物的MIC 值(无菌液生长,液体澄清)。继续培养48 h,试管内依旧澄清的最小浓度为其MBC 值。
分别取上述培养12~16 h 和培养48 h 的试管内液体,采用涂布平板的方法[37]对海巴戟果提取物的MIC 和MBC 值进行进一步验证。
1.6 煮沸时长对海巴戟果提取物抑菌作用的影响取海巴戟果,分别煮沸0、5、10、15、20、25 min,4 层纱布过滤,将得到的滤液经高压灭菌(121 ℃,15 min)后分别装与EP 管中,4 ℃保存,备用。
取7 支试管,对照组编号为0,其余6 支依次编号为1~6,0~6 号试管中分别加入10 mL TCBS 培养基,1~6 号试管分别加煮沸0、5、10、15、20、25 min 的海巴戟果提取物3 mL,7 支试管分别接种5 μL 副溶血性弧菌,摇床培养(30 ℃,180 r·min−1)12~16 h。另准备7 支试管,分别取0~6 号试管中的菌液1 mL,加9 mL PBS 缓冲液,得到稀释液A0~A6,接着分别取A0~A6 试管中的菌液1 mL,加9 mL PBS 缓冲液,得到稀释液B0~B6。
制板,分别取B0~B6 试管中的菌液5 μL,在培养皿上涂布均匀,每支试管设置3 个重复,30 ℃生化培养箱中培养12~16 h,观察菌落生长情况,对各个培养皿分别计数并通过以下公式计算抑菌率(%)。
抑菌率=(对照皿菌落数−试验皿菌落数)/对照皿菌落数×100%。
2 结果与分析
2.1 紫外线对海巴戟果提取物抑菌能力的影响通过控制紫外灯照射时长,对分别照射0、5、10、15、20、25 min 的海巴戟果提取物进行涂布平板抑菌试验,对应的抑菌圈平均直径分别为11.2、8.4、8.0、6.7、0、0 mm。
根据平均值绘制折线图(图1)。从图1 可知,紫外线会影响海巴戟果提取物的抑菌能力,紫外照射时间越长,抑菌能力越弱;当紫外线作用时间≥20 min 时,培养皿中滤纸片周围无抑菌圈产生。
实验结果表明,紫外线照射会影响海巴戟果提取物的抑菌效果,紫外照射时间越长,抑菌能力越弱甚至消失。推测紫外线照射可能会分解海巴戟果提取物中的活性物质,从而对其抑菌能力造成影响。
2.2 煮沸时长对海巴戟果提取物抑菌作用的影响从图2 可知,浸泡30 min(0 组)和对照组之间差异不显著,煮沸5 min 和浸泡30 min 相比差异显著,但是和煮沸10 min 差异不显著。分别煮沸15、20、25 min和煮沸5、10 min 相比差异极显著,但是三者之间差异不显著。煮沸0、5、10、15、20、25 min 的海巴戟果提取物对副溶血性弧菌的抑菌率分别为12.64%、45.76%、48.64%、71.68%、71.36%、70.88%(表1)。煮沸能够显著提高海巴戟果提取物对副溶血性弧菌的抑制作用。根据实验结果,分别煮沸0、5、10、15 min 时,海巴戟果提取物的抑菌率依次增大,15 min 后,煮沸时长对其抑菌作用的几乎没有影响。煮沸15 min 的海巴戟果提取物抑菌效率最大。

图1 紫外线照射时长处理的海巴戟果提取液对副溶血性弧菌抑菌效果的影响Fig.1 Effect of the hot-water noni fruit extract under different ultraviolet exposure durations on bacteriostasis of V.parahaemolyticus
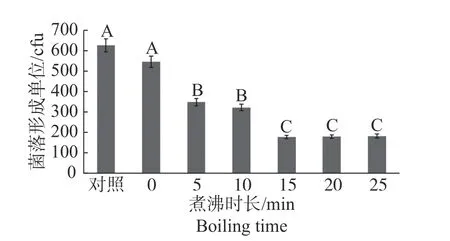
图2 不同煮沸时长海巴戟果提取物对副溶血性弧菌菌落数的影响数据柱(点)标注相同字母表示差异不显著(P > 0.01),不同字母表示差异显著(P < 0.01)。Fig.2 Inhibition of number of colonies of V.parahaemolyticus by the hot-water noni fruit extract at different boiling durations Value columns (points) with the same letters mean significant difference at P > 0.01, while those with different letters mean significant difference at P < 0.01.
2.3 海巴戟果提取物MIC 值和MBC 值添加不同质量浓度的海巴戟果提取物,培养12 h 后,1~13 支试管中,4~12 号试管内液体混浊,1~3 号试管内液体澄清,继续培养48 h 后,3 号试管出现轻微混浊,1~2 号试管内液体依旧澄清,该结果初步表明,副溶血性弧菌的生长在海巴戟果提取物的质量浓度达到25.00 g·L−1时明显受到抑制,当海巴戟果提取物的质量浓度达到50 g·L−1时,副溶血性弧菌不生长。准备副溶血性弧菌培养皿,分别对培养12 h 和48 h 的试管内菌液进行涂布培养,如表2、表3 所示,培养12 h后,海巴戟果提取物的质量浓度≥25.00 g·L−1时,培养皿中没有副溶血性弧菌,据此判断,海巴戟果提取物的最小抑菌质量浓度(MIC)值为25.00 g·L−1。继续培养36 h 后,海巴戟果提取物质量浓度为25.00 g·L−1的培养皿中出现副溶血性弧菌,而海巴戟果提取物质量浓度为50.00 g·L−1和100 g·L−1的培养皿中仍没有副溶血性弧菌生长,据此得出其MBC 值为50.00 g·L−1。

表1 不同煮沸时间对海巴戟果提取物抑菌率的影响Tab.1 Effect of hot-water noni fruit extract on bacteriostatic rate at different boiling time

表2 添加不同质量浓度海巴戟果提取物培养12 h 后副溶血性弧菌生长情况Tab.2 The growth of V.parahaemolyticus after 12 h culture with different concentrations of the hot-water noni fruit extract

表3 添加不同质量浓度海巴戟果提取物培养48 h 后副溶血性弧菌生长情况Tab.3 The growth of V.parahaemolyticus after 48 h culture with different concentrations of the hot-water noni fruit extract
3 讨 论
紫外线照射会影响海巴戟果提取物的抑菌能力,当紫外线照射时间≥15 min 时,其提取物失去抑菌作用。凡纳滨对虾的人工养殖大都采用露天养殖场,向养殖池中添加海巴戟果提取物时,应避开紫外线较强的时候,因此,最好早晚补给,尤其是在紫外线较强的海南省,以免影响其抑菌作用的发挥。中药材多为植物或动物的干燥组织,或者是矿物类,动、植物其细胞干枯萎缩,药物有效成份结晶或定形沉淀存在于细胞内,组织外表也变的紧密,使水分不易渗入和溶出。海巴戟果质地较重,其细胞干枯萎缩,药物有效成分结晶或定形沉淀存在于细胞内,组织外表也变得紧密,简单的浸泡无法获得其有效成分,煮沸时间也要≥15 min,才能使其更好地发挥药效。海巴戟果提取物抑制副溶血性弧菌的MIC 为25 g·L−1,MBC 为50 g·L−1。
据研究,采用有机溶剂无水乙醇获得的花椒籽和大蒜提取物对副溶血性弧菌也具有抑制作用,MIC 分别为12.50 g·L−1和18.25 g·L−1[38−39]。与之相比,海巴戟果热水提取液对副溶血性弧菌的MIC 为25.00 g·L−1,高于花椒籽和大蒜提取物。但从制备方法上考虑,本研究采用的热水煮沸方法简单易行,与有机溶剂相比,成本较低,能够降低凡纳滨对虾养殖中对副溶血性弧菌的防治成本,提高养殖利润。
温度升高均不利于花椒籽提取物和大蒜提取物抑菌效果的发挥,花椒籽提取物适宜温度范围为20~40 ℃;大蒜提取物在温度高于50 ℃时易被氧化[38−39]。相比之下,海巴戟果热水提取液因其制备条件,避免了高温对其抑菌效果的影响。紫外线照射也会使花椒籽和大蒜提取物抑菌能力减弱[38−39],这一结果与本研究相同。
随着我国水产养殖业迅速发展,养殖水域环境趋于恶化,各类细菌病和病毒病频繁发生,给养殖者带来了严重的经济损失。在大力倡导健康养殖、保证畜禽产品安全、保障人类健康的今天,海巴戟果提取液被证明对副溶血性弧菌有抑制作用,该结果为其在水产养殖领域防治副溶血性弧菌病提供了依据。

