基于DNA条形码ITS2的高分辨率熔解曲线鉴定市售核桃乳真伪
姜广泽 陈成统 赵海莹 黄丽红 丁艳菲 朱 诚
(中国计量大学生命科学学院/浙江省海洋食品品质及危害物控制技术重点实验室,浙江杭州 310018)
核桃(Juglans regiaL.)作为世界“四大干果”之一,因其具有较高的营养和药用价值而被称为“养生之宝”[1]。近年来多种类的核桃源性食品被研发销售,以核桃乳为代表的坚果饮品大量涌入市场。核桃乳不仅具有纯天然的植物蛋白原材料、不失核桃原有营养成份和浓香口感的特点,还是蛋白质、维生素B以及多种微量元素的良好来源[2-4]。然而,随着乳饮料行业的发展,核桃乳的掺杂使假现象层出不穷,手段和方式更是不断翻新,导致检测和鉴定困难重重,给产业持续稳定发展带来忧患。近年来我国食物过敏的发病率逐年递增,核桃是造成食物过敏的主要食源之一。过敏性食源标签制度已在多个国家开展,核桃、花生等多种过敏性食材被强制或建议要求明确标出。成分不明、标签不符的掺杂造假产品给消费者带来潜在的食品安全风险[5]。为了维护消费者的权益与健康,急需建立一种针对核桃乳等坚果饮料的实用、快捷、准确的真伪鉴定方法。
目前,食品真伪性的鉴定主要依赖于蛋白质和DNA 序列分析[6-8]。对于深加工食品核桃乳,以DNA为基础的序列分析方法更有效。DNA 条形码技术利用一段或几段标准DNA 序列,通过序列内碱基的多样性对己知或未知成分进行识别,实现物种快速鉴定[9]。目前DNA 条形码技术已广泛应用于植物、动物、微生物及食品鉴定等多个领域[10-13]。高分辨率熔解曲线(high resolution melting,HRM)是一种非测序的基于DNA 熔解分析的新兴技术,多用于中药鉴定和微生物分型[14-17]。相对于DNA 条形码技术,HRM 分析技术更加快速经济,适用于多种食品材料组合的检测。目前DNA 条形码与HRM 结合越来越多应用于食品的真实性检测,如豆类掺假[18]、果汁原料溯源[19]、橄榄油掺杂[20]和金银花掺假[21]等。本试验选取核基因组间隔区ITS2、叶绿体基因组编码区rbcL以及非编码区psbA-trnH3 种常见植物DNA 条形码,筛选可以区分核桃、花生等坚果的最适DNA 条形码。并利用HRM 技术对市售核桃乳、山核桃乳中目的种源成分(核桃、山核桃)及非目的种源(花生、大豆等)进行鉴定,旨在为植物蛋白饮料真实成分检测提供科学依据。
1 材料与方法
1.1 材料与试剂
核桃、美国山核桃、山核桃、腰果、榛子、巴旦木、夏威夷果、花生、杏仁、松子共10 种坚果和1 种非坚果——大豆,市售9 种不同品牌核桃乳和1 款山核桃乳,均购自国内市场。
AxyGen AxyPrep Multisource Genomic DNA Miniprep kit,爱思进康宁生命科学有限公司;2×Evagreen HRM 预混液,天根生化科技(北京)有限公司;Primix ExTaq,TaKaRa 生物医学科技(北京)有限公司。
1.2 仪器与设备
SpeedCycler 2 快速 PCR 仪,德国耶拿AnalytikJenaAG 公司;Rotor-Gene Q 荧光定量PCR 仪,德国QIAGEN 公司;Microfuge20R 冷冻离心机,美国BeckmanCoulter 有限公司;EPS300 5200Multi 电泳仪及凝胶成像系统,上海天能科技有限公司;LABCONCO FreeZone2.5Plus 真空冷冻干燥仪,新芝生物科技股份有限公司;Nanodrop-100 微量核酸蛋白测定仪,杭州奥盛仪器有限公司。
1.3 试验方法
1.3.1 DNA 提取 称取100 mg 坚果及大豆样品经液氮研磨,采用十六烷基三甲基溴化铵(hexadecyl trimethyl ammonium bromide,CTAB)裂解液[3%(w:v)CTAB;0.1 mol·L-1Tris-HCl,pH 值 8.0;0.02 mol·L-1EDTA;1.4 mol·L-1NaCl;0.2%(v:v)β-巯基乙醇;2%(w:v)聚乙烯吡咯烷酮]、20 μL Proteinase K和1 μL RnaseA(10 mg·mL-1)进行裂解,充分裂解后采用酚∶氯仿∶异戊醇(v∶v∶v,25∶24∶1) 抽提,经预冷的异丙醇沉淀,70%乙醇洗涤,用Tris-EDTA 溶液溶解DNA。核桃乳及山核桃乳经真空冻干预处理后,采用CTAB 与AxyGen 试剂盒结合的方法提取DNA。采用Nanodrop 核酸蛋白测定仪分析DNA 浓度及OD260/OD280纯度,凝胶电泳判定DNA 质量,采用CP-03 基因对DNA 进行PCR 扩增。
1.3.2 PCR 扩增及产物测序 查阅文献筛选出ITS2、rbcL、psbA-trnH3 对植物通用条形码基因引物(表1),对10 种坚果及核桃乳进行PCR 扩增。采用25 μL PCR 扩增体系,包括12.5 μL Premix Taq、上下游引物各0.5 μL、1 μL DNA 模板、10.5 μL 蒸馏水。反应程序:95℃预变性5 min;95℃变性30 s,退火30 s,72℃延伸30 s,共35 个循环;最后72℃总延伸10 min。PCR 扩增产物用琼脂糖凝胶进行电泳检测后送至上海生工公司进行双向测序。

表1 基因引物序列Table 1 Gene primer sequence
1.3.3 测序产物生物信息学分析 对于测序所得序列,采用 NCBI (National Center for Biotechnology Information)平台的BLAST 工具与数据库进行比对,并结合BOLD 数据库对样品DNA 序列进行鉴别。利用MEGA 7.0软件进行序列比对,采用ClustalW 算法,手动进行序列删减。种内种间遗传距离的计算和系统发育邻接树(neighbor joining)的构建利用K2P(Kimura 2-parameter)模型完成,Bootstrap 次数设为1 000 次,并自动删除小于50%的数值。
1.3.4 Real-time PCR 和HRM 分析 选取核桃、美国山核桃、山核桃、花生和大豆为标准样品,并对9 种不同品牌核桃乳及1 款山核桃乳进行试验分析。基于坚果条形码分析结果,在扩增的500 bpITS2 基因片段的基础上,设计具有同样遗传区分能力且符合Realtime PCR 大小的160 bp HRM 通用引物对ITS2-HRM。采用20 μL Real-time PCR 反应体系,包括1 μL(120 ng) DNA 模板,10 μL 2×Evagreen HRM 预混物,引物各0.4 μL 以及无RNase 灭菌水8.2 μL。反应程序:95℃预变性10 min;95℃变性10 s,60℃延伸15 s,共40 个循环;每个循环结束时收集荧光信号。HRM 通过对双链DNA 降解为单链DNA 过程中DNA 特征进行分析,区分熔解温度极为相近的不同物种,从而匹配得到被检测目标准确成分。HRM 程序温度设为78~90℃,温度增量为每2 s 变化0.1℃。数据通过Rotor-Gene Q 软件进一步分析。
1.3.5 混合标准品的HRM 分析 将核桃样品与花生样品分别按10%、30%、50%、80%和90%的比例制作掺假混合样品,按1.2.1 方法提取混合样品DNA,以混合样品DNA 及不同品牌核桃乳DNA 样本作为Real-time PCR HRM 分析模板,按1.2.4 的体系和程序运行试验。
2 结果与分析
2.1 坚果及核桃乳DNA 提取结果
采用CTAB 裂解沉淀方法提取10 种坚果及大豆DNA,所提DNA 浓度范围在129~484 ng·μL-1之间,OD260/OD280范围为1.7~2.0,且电泳显示在大于10 000 bp 处有清晰明亮的DNA 条带,证明所提坚果DNA 浓度高且片段完整(表2)。核桃乳属于深加工食品,DNA 破坏严重,采用CTAB 和AxyGen 试剂盒结合方法提取的核桃乳DNA,浓度范围在64~135 ng·μL-1之间,OD260/OD280范围为1.7~1.9(表3)。坚果及核桃乳DNA 经CP-03 基因PCR 扩增,均可在123 bp 处得到单一明亮条带,证明所提坚果及核桃乳DNA 纯度好,具备PCR 扩增条件。
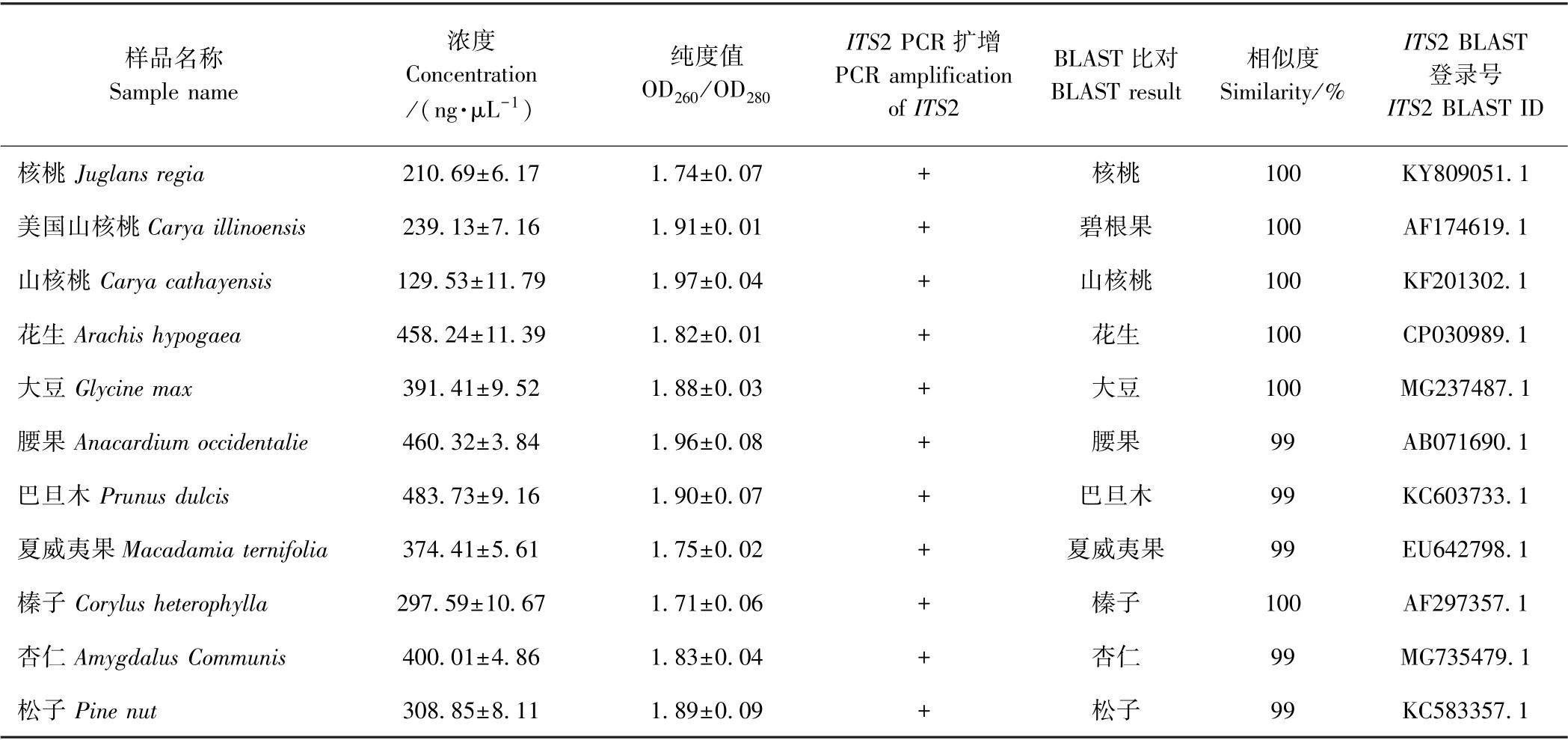
表2 10 种坚果及大豆DNA 提取及BLAST 比对结果(n=3)Table 2 DNA extraction from ten kinds of nuts and soybean and BLAST results (n=3)
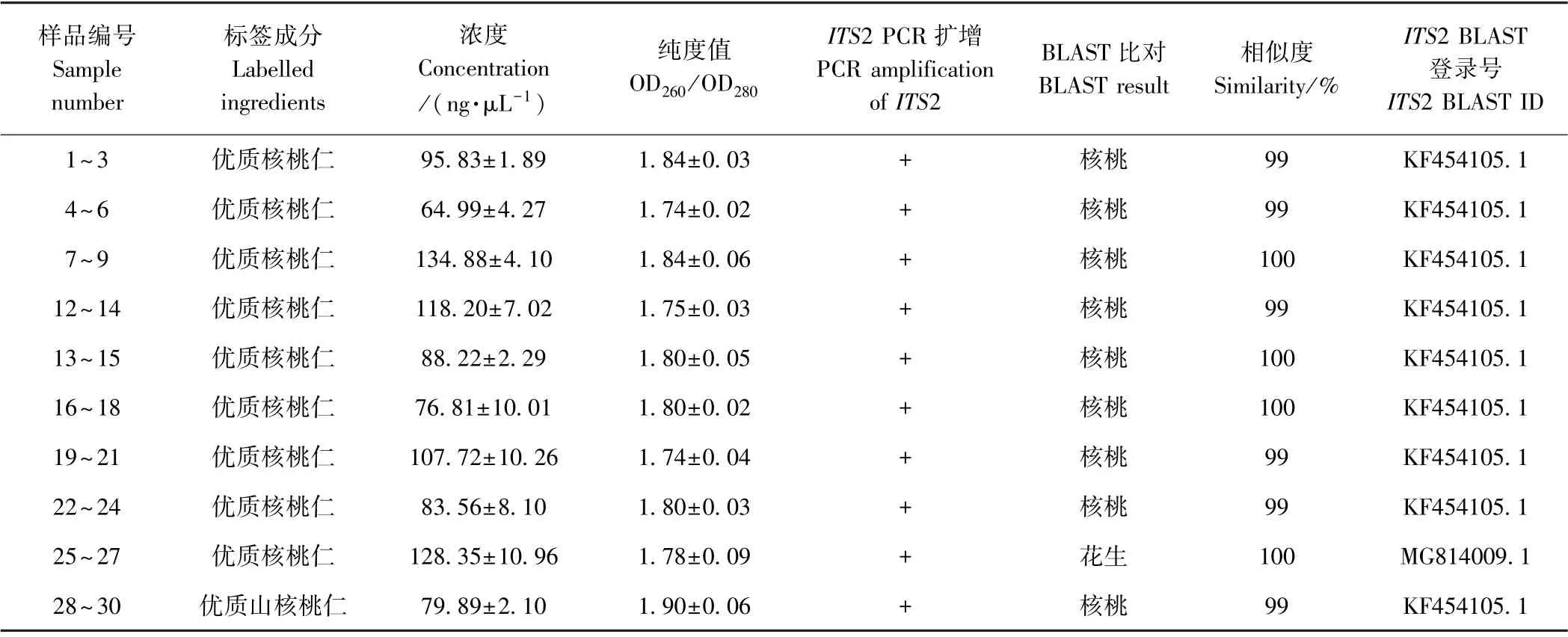
表3 核桃乳和山核桃乳DNA 提取及BLAST 比对结果(n=3)Table 3 DNA extraction and BLAST alignment results for walnut milk beverage and pecan milk beverage (n=3)
2.2 PCR 扩增及生物信息学分析结果
利用ITS2、psbA-trnH、rbcL3 种DNA 条形码基因对10 种坚果进行PCR 扩增,比较PCR 扩增效率、测序成功率以及比对成功率。由图1-A、2-A、3-A 可知,PCR产物的电泳目的条带明显,PCR 扩增效率均为100%,测序成功率除ITS2 稍低外,其余2 个基因的测序成功率均接近94%;3 个基因的比对成功率差距较大,psbAtrnH、ITS2 和rbcL比对成功率依次为96.56%、93.33%及71.43%。
经MEGA 7.0 软件计算得到464 组坚果种内种间遗传距离,分析得到10 种坚果遗传距离直方图(图1-B、2-B、3-B)。结果表明,ITS2 基因种内遗传距离集中在0.05 附近,与种间距离无交叉,最大种内遗传距离小于最小种间遗传距离,满足理想条形码要求。psbAtrnH基因最大种内遗传距离为0.085,而最小种间遗传距离为0.065,种间遗传距离与种内遗传距离存在交叉,不符合条形码最大种内遗传距离小于最小种间遗传距离的要求。rbcL基因的最大种内遗传距离为0.076,而最小种间遗传距离为0.025,种间遗传距离与种内遗传距离存在多处交叉,同样不满足理想条形码要求。序列比对、加工后构建系统发育树如图1-C、2-C 和3-C 所示。ITS2 和psbA-trnH的系统发育树显示同一个物种的所有个体均被分配到同一分支,未出现物种交叉,说明候选条形码ITS2 进化速率确实与物种的分类等级相关,符合条形码要求,而rbcL基因的核桃与美国山核桃未出现分支,巴旦木和杏仁间存在物种交叉,松子物种种内分支严重。
2.3 核桃乳扩增测序结果
通过比较ITS2、psbA-trnH和rbcL3 个候选DNA 条形码基因的种内种间遗传距离及系统发育树结果,并结合PCR 扩增效率、测序成功率、比对成功率结果,认为ITS2 基因为区分核桃、花生等坚果的最适DNA 条形码。基于ITS2 序列对9 种核桃乳及1 种山核桃乳样品进行扩增测序分析(表3)。测序比对结果显示,25~27 号核桃乳测序比对结果为花生,与标签不符;而28~30 号标签为优质山核桃仁的山核桃乳产品测序比对结果为核桃。说明检测的核桃乳、山核桃乳样品中存在标签不符、以次充好的掺假产品。
2.4 HRM 分析结果
选择与核桃种源关系相近的美国山核桃、山核桃以及核桃乳常见掺假物种花生和大豆进行Real-time PCR 和HRM 分析,对比核桃乳、山核桃乳样品与5 种坚果样品高分辨率熔解曲线形状和位置差异。结果显示,所有样品均扩增成功,循环阈值在8.86~23.19 之间(表4、图4)。5 种坚果样品的熔解温度差异微小,平均值在84.001~86.183℃之间,普通熔解曲线不易区分(表4)。在截取的83~87℃之间,归一化熔解曲线中5 种标准样品存在差异,为更好地观察物种差异,进一步分析得到差异化熔解曲线(图4)。可以看出ITS2 序列的HRM 分析对5 种坚果样品有良好的区分效果。
9 种不同品牌核桃乳及1 款山核桃乳的HRM 分析检测结果如表5、图5所示,可以看出25~27 号产品HRM 曲线与花生重叠,其余样品均与核桃高度相似或重叠,其中包括28~30 号山核桃乳产品。熔解温度显示,25~27 号产品的熔解温度平均值为84.026℃,与花生熔解温度(84.024℃)最接近;其余产品的熔解温度范围为83.983~84.016℃,与核桃的84.001℃相近,综合熔解温度以及熔解曲线的形状位置,系统匹配置信度结果均高于90%(表5)。HRM 分析结果与扩增测序结果吻合,所检测的核桃乳、山核桃乳样品中存在标签不符、以次充好的掺杂造假产品。
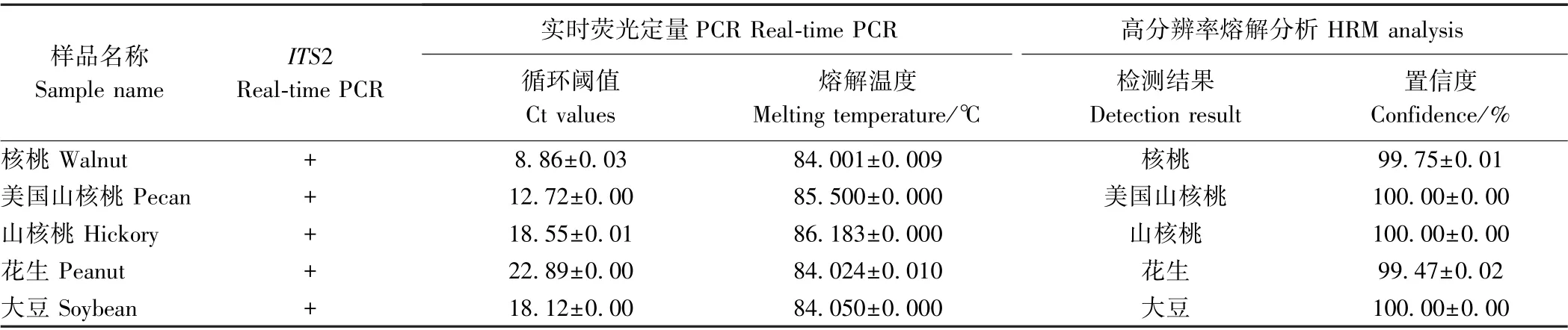
表4 5 种坚果样品的real-time PCR 及HRM 分析结果Table 4 Real-time PCR and HRM analysis results for five nut samples
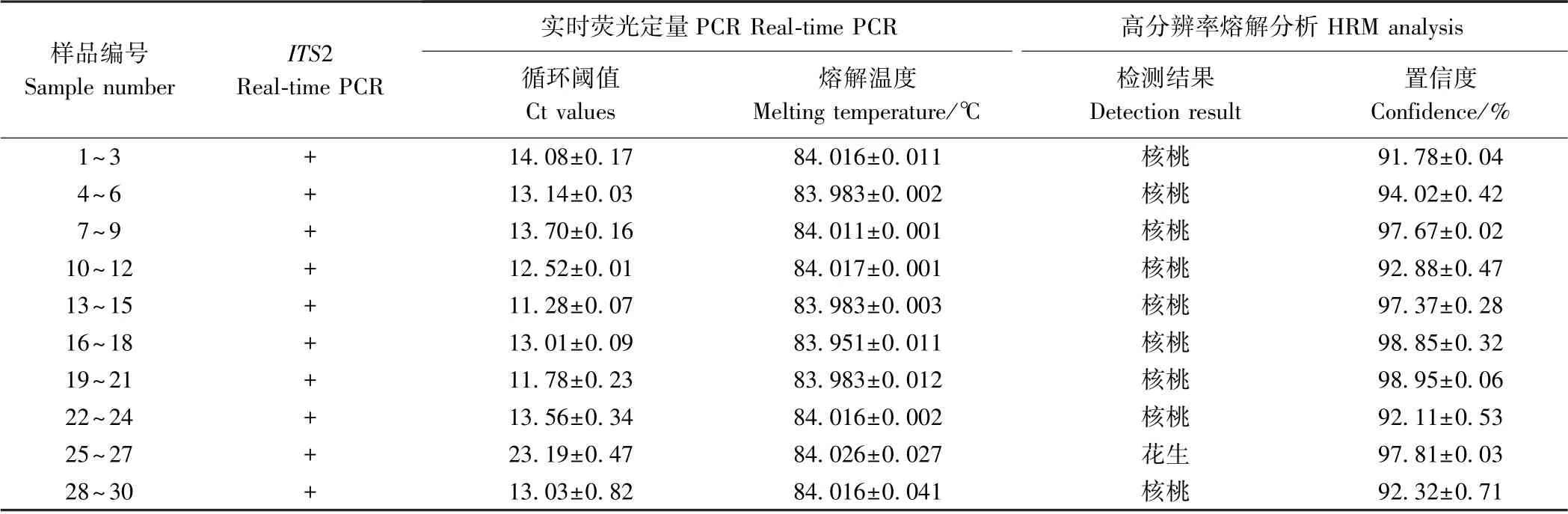
表5 核桃乳、山核桃乳样品的real-time PCR 及HRM 分析Table 5 Real-time PCR and HRM analysis of walnut milk beverage and pecan milk beverage samples
2.5 不同比例核桃、花生混合坚果样品的HRM 曲线分析结果
核桃、花生不同比例混合坚果样品提取的DNA 浓度范围为94~261 ng·μL-1,纯度OD260/OD280值在1.76~1.95 之间,提取DNA 质量高,符合HRM 试验要求。将核桃和花生设为参照标准,分析10%、30%、50%、80%及90% 5 种不同花生比例掺假样品HRM 曲线(图6)。结果显示,在截取的83.5~85.3℃之间,基于ITS2 序列进行HRM 分析,可以将核桃、花生和5 种不同比列混合品进行区分,在HRM 差异化分析(图6-B)中可看到明显差异。置信度设为95%,系统匹配结果显示,90%比例的混合品被识别为花生,置信度为96.76%;其余比例混合品识别结果为未知。将核桃、花生及5 种不同比例混合品设为参照标准,分析10 种不同品牌核桃乳、山核桃乳样品HRM 曲线(图7)。结果显示,除25~27 号核桃乳曲线在90%混合处外,其余核桃乳、山核桃乳均集中在核桃标准附近。系统匹配结果为25~27 号是90%比例混合品,其余核桃乳、山核桃乳均被识别为核桃,且置信度都在98%以上。
3 讨论
坚果乳饮料行业快速发展的同时,假冒伪劣产品也随之出现。食源不明、成分不符的掺杂造假产品不仅侵害消费者利益、危害市场秩序,也对消费者健康存在潜在的过敏风险。因此,需要一种快速、准确、低成本、高通量的核桃乳成分检测方法。植物DNA 条形码候选序列不唯一,其中基因组间隔区ITS序列因较高的鉴定效率被广泛应用于药物植物及种子的物种鉴定。王金灿等[25]利用ITS2 序列对9 种金莲花种子实现中药真实性鉴定。张雪瑛等[26]将DNA 条形码ITS2序列与红外光谱技术结合完成了9 种常见石斛的鉴定。林凤越等[27]利用ITS2 序列对易混的人参与西洋参种质资源完成鉴别。本研究对ITS2、rbcL及psbAtrnH3 种植物常见DNA 条形码进行筛选,得出ITS2是研究所选坚果最适DNA 条形码。
目前乳制品成分检测通常采用以蛋白质检测为基础的色谱法、免疫法和以DNA 检测为基础的PCR 方法、条形码方法以及PCR-RFLP 酶切法等[28]。在核桃乳成分鉴定的研究中,张敬敬等[29]建立了一种用高效液相色谱检测核桃乳中掺有大豆乳的方法。HRM 分析技术相对于色谱法更省时、安全且成本低。魏晓璐等[2]通过对大豆和花生特异性过敏源蛋白设计引物,建立了核桃乳中检测花生、大豆成分的PCR 方法。杨硕等[28]利用特异性引物探针,实现多重微滴式数字PCR 方法定量检测市售核桃乳中核桃、大豆源性成分。与PCR 方法相比,HRM 无需后续检测操作,通量大且不易污染。除此之外,HRM 比免疫法更适合深加工食品的鉴定,比DNA 条形码方法的成本更低,而且与酶切技术不同,不受靶基因序列酶切位点突变的影响。相对于其他检测方法,HRM 分析一管式闭管操作,步骤简单,具有省时、安全、成本低和通量大的特点。
DNA 条形码结合HRM 分析技术越来越多地应用于食品鉴定。Laura 等[30]利用DNA 条形码ITS结合HRM 成功对不同浆果进行物种鉴定。Soares 等[31]通过DNA 条形码及HRM 分析对相似度极高的薰衣草蜂蜜进行了区分。Ganopoulos 等[32]采用HRM 分析对希腊PDO 羊奶酪的真实性进行检测。说明基于特定DNA 条形码片段的HRM 分析能完成食品真伪性鉴别。本研究应用坚果最适DNA 条形码ITS2 序列,通过HRM 分析,对核桃乳、山核桃乳中目的种源(核桃、山核桃)以及非目的种源(花生、大豆)进行真伪检测,通过构建标准混合品,检测核桃乳掺假情况。结果发现两款产品存在标签不符、以次充好的造假现象。本研究为植物蛋白饮料真实成分检测提供了一定的科学依据。
4 结论
本研究通过扩增测序、生物信息学分析对ITS2、rbcL和psbA-trnH3 条植物候选DNA 条形码进行筛选,得到具有100%扩增效率和较高测序成功率、比对成功率且种内种间遗传距离合适的ITS2 序列作为区分坚果类最适DNA 条形码。基于ITS2 对市售核桃乳进行扩增测序检测,并设计适合Real-time PCR HRM 分析的ITS2 引物,开展HRM 对市售核桃乳、山核桃乳真伪鉴定分析。结果表明,在被检测的10 种样品中,有2 款产品存在花生替代核桃或核桃替代山核桃等标签不符、以次充好的问题,置信度大于98%。该研究证实基于ITS2 条形码序列的HRM 分析技术可以对市售核桃乳饮料成分真伪进行鉴定。

