复发性宫颈癌治疗进展论述
文茜,陈亚君
(长江大学第二临床医学院,湖北 荆州 434000)
0 引言
子宫颈癌是全球妇女中第四大恶性肿瘤[1],仅次于乳腺癌、结直肠癌、肺癌,在我国居妇科恶性肿瘤首位,在发展中国家死亡率居第二位,全世界每年有超过50 万妇女被诊断为宫颈癌,每年导致30 万人死亡[2]。随着近年来医学的不断进步,大部分的宫颈癌患者在经过全程规范化治疗之后都能实现长期存活,小部分患者会出现复发或转移。20%~30%的宫颈癌患者在治疗后出现复发或未获得局部控制,这是导致宫颈癌患者死亡的主要原因。
1 复发性宫颈癌概述
1.1 定义宫颈癌
残留病灶和复发性宫颈癌之间的区别具有重要意义。复发性宫颈癌定义为宫颈癌患者经过了放疗或者根治术后,达到临床治愈,放疗结束3 个月后或完成手术6 个月以后或后再次出现了与原来肿瘤相同病理类型的病灶,手术后复发是指根治术1 年后又出现肿瘤,根治术中肉眼所见全部肿瘤都已切除且手术标本切缘阴性无肿瘤,术后又出现肿瘤称为复发。反之,则为宫颈癌残留病灶。
1.2 复发时间及部位
宫颈癌患者在完成治疗的最初2 年中,复发的可能性很高。根据国际妇产科联盟分期,手术主要适用于Ia,Ib1 和IIa 期患者。IIb,IIIa,IIIb,IVa 和IVb 期主要通过放化疗治疗。临床试验表明,基于顺铂的同步放化疗是治疗IIb-IVa 期的标准方案[3]。但是,几乎有四分之一的病人在放化疗后出现骨盆中央复发。国际妇产科联盟(FIGO)分期ⅡB 期的患者复发率约为23%,Ⅲ期约为42%,Ⅳ期达74%。复发宫颈癌患者的预后差,既往报道的总治疗有效率仅为27%,中位生存时间仅9 个月,5年生存率为3.2%~13%。宫颈癌复发类型是基于复发肿瘤的位置被分类为盆腔、远端、淋巴结复发[4]。
2 复发性宫颈癌的治疗
2.1 治疗原则
复发性宫颈癌根据其首次治疗的方式,分为术后复发和放疗后复发;根据复发的部位,又分为盆腔复发和远处复发。2020年NCCN 指南和2018 年FIGO 指南,治疗方案取决于患者的体能状况、复发和(或)转移的部位和病变的程度以及初始治疗的方式,存在广泛的局部转移或远处转移患者应给与最好的支持治疗和姑息治疗,对于精神状态良好并且转移病灶局限的患者,行含铂双药全身化疗试验,无法通过手术或放疗挽救的局部复发,全身化疗反应差[5]。
2.1.1 未放疗区域的盆腔局部复发对于在初始治疗后出现中央型复发(阴道顶端,不累及盆壁的复发)的宫颈癌患者,经过全面的评估后未发现远处转移性病灶,可以考虑盆腔廓清术(pelvic exenteration, PE),术后再行EBRT+化疗+短距离放射治疗。初始手术治疗后出现盆腔局部复发的患者还可选择给予根治性放疗。
2.1.2 已放疗区域的盆腔中央型复发国际妇产科联盟(FIGO)和美国国家综合癌症网络(NCCN)的宫颈癌诊治指南都指出,放射治疗后盆腔中央型复发的宫颈癌可通过PE 获得良好的预后,相关文献报道得出同样的结论[6,7],可加或不加术中放疗 (IORT)。复发病灶或持续残留病灶小于2cm 的中央肿块,有学者认为可行广泛性子宫切除术[8]。
2.1.3 已放疗区域的盆壁复发这类患者通常5 年总生存率低于10%, 如果不能及时控制复发病灶, 所期望的平均生存时间只有7~9 个月[9]。由于其他盆腔结构(小肠、膀胱、直肠)辐射耐量有限,在进行最大照射剂量后,通常不可能再进行照射。通常盆壁复发可以采用横向扩大盆腔脏器切除术(laterally extended endopelvicresection,LEER) ,将真骨盆内的侧壁肌肉和主要血管连同盆腔器官一同切除[10]。手术切除范围可以包括梨状肌、闭孔内肌、耻骨尾骨肌、髂尾肌等盆底肌肉和髂内血管系统。当盆腔复发患者的肿瘤较难完全切除时,先行新辅助化疗使肿瘤缩小,清除可能难以切净的肿块,可以提高手术切除率及降低局部复发率。
2.1.4 腹主动脉旁淋巴结复发除骨盆外,最常见的复发部位是腹主动脉旁淋巴结(para-aortic lymph node,PALN)[11]。孤立性PALN 复发有1.7%至12%接受了根治方案[12,13]。尽管PALN 复发被定义为远处转移,但是一些PALN 复发患者可以存活很长时间,对孤立的PALN 局部复发患者,可选择:同步放化疗(CCRT)[14];腹主动旁淋巴结手术切除,术后补充放化疗。
2.1.5 远处复发转移远处转移患者若可行局部治疗,可选择手术切除±外照射或局部消融±外照射或个体化外照射±全身治疗,或者单纯化疗。不适合局部治疗者建议参与临床试验或化疗或最好的支持治疗[15]。
2.2 治疗方式分类
2.2.1 手术治疗
(1)盆腔廓清术:盆腔廓清术治疗复发宫颈癌已经有60 余年历史,随着宫颈癌手术治疗在术中及术后管理方面的进步,新的广谱抗生素的应用及重症医学的发展使手术相关死亡率降至5%以下。对于行放疗之后已放疗区域内复发的患者,由于治疗方案有限,再次放疗效果差,中位生存期约为12 个月[16,17],盆腔廓清术后预后良好。近年来,由于手术技术在不断提高,如盆腔填充、阴道重建术等,手术并发症及病死率明显下降,相关文献报道病死率小于10%,5 年生存率有着明显提高,达30%~60%,术后常见并发症有切口裂开、盆腔脓毒症、肠穿孔、尿瘘、肠梗阻等。放疗后患者若盆腔内复发,能够手术切除者,尽量切除,因为正常组织已被照射,易导致组织纤维化,脆性增加,不建议行根治性子宫切除术,建议行PE 术,行手术后再以盆腔动脉插管化疗[18]。针对手术方式选择,周晖等[19]学者总结了盆腔器官廓清术的不同类型及切除范围,表1 如下。
无远处转移的复发性宫颈癌手术治疗表1[19]。
(2)次广泛或广泛性子宫切除术对于行放疗后中心性复发且复发灶肿瘤直径<2 cm 的宫颈癌患者适用。对于复发性宫颈癌患者来说,若初始治疗方式为放疗,很难做到真正的根治,因为放疗后引起的组织纤维化作用及手术容易增加损伤及瘘的发生率。白萍等[20]报道,对10 例宫颈癌全量放疗后局部肿瘤未控或中心型复发患行次广泛或广泛性子宫切除术,行子宫广泛或次广泛切除术患者(7 例)的中位生存时间为26 个月,5 年生存率为40.0%。Maneo 等[21]报道,纳入34 例放射治疗后复发患者,均行根治性子宫切除术,出现各种严重并发症发生率为44%,包括各种瘘、肠道梗阻、盆腔脓肿、输尿管狭窄、膀胱麻痹等),各种瘘发生率为15%,包括膀胱-阴道瘘和直肠-阴道瘘。针对术后可能发生的并发症,术前需充分评估患者身体情况、手术风险。
2.2.2 放射治疗
(1)常规放疗对于未进行过放射治疗的复发性宫颈癌患者,则可选择根治性放疗加或不加同期化疗,放疗可以达到根治的目的。包德强等[22]对30 例复发性宫颈癌患者行三维适形放射治疗,每次2~3Gy、每周3~5 次,共计15~28 次完成,总剂量30~56Gy。有效率(RR)66.6%,其中完全缓解率(CR)23.3%,部分缓解率(PR)43.3%;疼痛缓解率90.9%(20/22),出血完全缓解率91.7%(11/12)。1、2、3 年生存率分别为50.0%、26.7%、16.7%,他们认为三维适形放射治疗复发性宫颈癌可以提高局部控制率和延长生存期。考虑到同步放化疗在宫颈癌初始治疗中的优越性,许多研究开始探索同步放化疗治疗复发性宫颈癌的优势。乔佳明等[23]报道,对34 例复发性宫颈癌淋巴结转移患者给予患者调强放疗或调强放疗联合化疗治疗,治疗客观缓解率,治疗客观缓解率(objective response rate,ORR)为52.94%,疾病控制率(disease control rate,DCR)为79.41%,6 个月局部控制率为70.59%,中位PFS时间为20 个月,中位OS 时间为36 个月。淋巴结转移数量≤3枚的患者中位PFS 时间显著长于淋巴结转移数量>3 枚的患者(P<0.05),ORR、DCR 和中位OS 时间二者之间比较差异均无统计学意义(均P>0.05);不论放疗剂量是否<60 Gy 或是否联合化疗,患者的ORR、DCR、中位PFS 时间、中位OS 时间或平均OS 时间比较差异均无统计学意义(均P>0.05)。放疗后患者总体不良反应发生率为88.24%,主要为骨髓抑制、消化道反应和放射性皮炎,经针对性治疗后,不良反应很快消失。杨春华等[24]对25 例盆腔复发的宫颈癌患者,采用盆腔调强放疗联合DDP同步化疗的方法,给予患者处方剂量95%PTV:50~60Gy/25~30 次/2Gy/次,放疗期间同步DDP 周方案化疗,观察患者的临床疗效及不良反应。结果显示腰腿疼痛缓解率为86.4%(19/22)。阴道出血缓解率为88.9%(16/18),下肢浮肿缓解率为88.2%(15/17),3个月后疗效评估,完全缓解率为52%(13/25),部分缓解率为24%(6/25),进展率为16%(4/25),有效率为76%(19/25)。近期不良反应有骨髓抑制、胃肠道反应及泌尿系统反应,≥Ⅲ度骨髓抑制发生率为12%(3/25),胃肠道反应和泌尿系统反应为Ⅰ~Ⅱ级,发生率分别为36%(9/25)、32%(8/25),他们认为调强放疗联合化疗治疗宫颈癌盆腔复发,能缓解患者症状,近期疗效好。
(2)术中放疗对于放疗后复发患者,可以采用术中放疗。术中放疗是指在开腹手术时,对有肿瘤残留风险的瘤床或无法切除的孤立残留病灶进行单次大剂量放疗。术中放疗可根据风险区域的大小选择不同施源器来限制照射的面积和深度,避免周围正常组织接受不必要的照射。
2.2.3 化疗
(1)单药化疗 1981 年,美国妇科肿瘤组 (Gynecologic Oncology Group, GOG) 的Ⅱ期临床实验奠定了单剂顺铂作为治疗晚期子宫颈癌及复发性子宫颈癌的基础化疗药物。GOG 对不同化疗药物进行了临床实验,子宫颈癌单药化疗的总缓解率都比较低,最高为顺铂,可达38%。2020NCCN 指南顺铂仍是治疗复发或转移性子宫颈癌的首选药物,其他方案包括卡铂、紫杉醇。
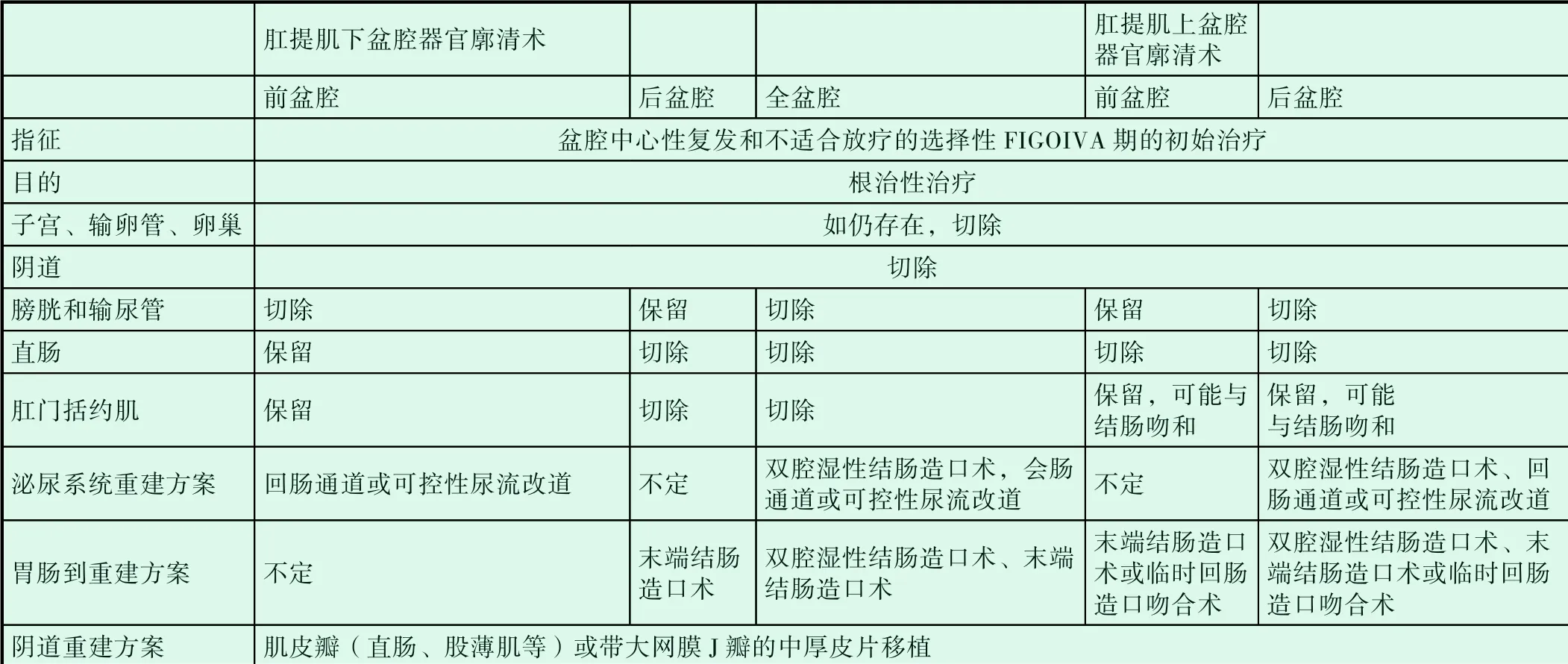
表1
(2)联合化疗根据2020NCCN 指南一线联合化疗方案首选顺铂/紫杉醇/贝伐单抗、卡铂/紫杉醇/贝伐单抗,其他推荐方案有紫杉醇/顺铂、紫杉醇/卡铂、拓扑替康/紫杉醇/贝伐单抗、拓扑替康/紫杉醇、顺铂/拓扑替康。对于一线治疗后病情进展的患者及不适于使用联合化疗方案的宫颈癌患者,可使用二线单药化疗方案。对于PD-L1 阳性或MSI-H/dMMR 者,使用派姆单抗,其他推荐方案有,贝伐单抗、白蛋白结合紫杉醇、多西他赛等,拉罗替尼或恩曲替尼用于NTRK 基因融合的肿瘤。
贝伐单抗是针对VEGF-A 的单克隆抗体,其目的是使异常的肿瘤脉管系统正常化,增加肿瘤的氧合作用和降低组织液压力[25]。Tewari 等[26]已经评估了贝伐单抗在452 例复发或转移性宫颈癌患者中的有效性。在化疗中添加贝伐珠单抗与总体生存期增加相关(17.0vs13.3 个月;死亡HR=0.71,98%CI 0.54-0.95,P=0.004)且有更高的缓解率(48%vs 36%,P=0.008)。与单纯化疗相比,贝伐单抗与2 级或更高级别的高血压(25%vs 2%),3 级或更高级别的血栓栓塞事件(8%vs 1%)以及3 级胃肠道瘘管(3%vs 0%)相关。2017 年,Virginia M. Rosen[27]等学者通过系统评价和网络荟萃分析(NMA)结果表明,与卡铂-紫杉醇和其他非贝伐单抗治疗相比,顺铂-紫杉醇-贝伐单抗和托泊替康-紫杉醇-贝伐单抗具有最高的有效性,并显示出OS 改善的趋势。相反,顺铂单药治疗改善OS 的可能性最低。卡铂-紫杉醇和顺铂-紫杉醇的等效作用表明,贝伐单抗与卡铂-紫杉醇联合使用也可能延长OS,尽管需要进一步的临床研究和实际数据来检验该假设。这些发现证明将贝伐单抗联合标准化疗对晚期、持续性和复发性宫颈癌的生存有益。贝伐单抗联合紫杉醇及拓扑替康或紫杉醇及顺铂可能比其他不含贝伐单抗的化疗药物更能延长总生存期。
2.2.4 靶向治疗
除上述提到的贝伐单抗外,其他靶向药也在复发性宫颈癌的治疗中发挥着重要作用。表皮生长因子受体(EGFR)蛋白的过度表达以及基因扩增与复发性宫颈癌密切相关。另外,它也可以直接影响疾病的预后。以下是HER 家族的成员:(i)EGFR / HER1;(ii)HER2;(iii)HER3;(iv)HER4[28]。基因毒性应激可以诱导EGFR 自磷酸化,促进增殖的信号通路,EGFR 还可以通过与DNA 修复机制的成分相互作用来调节DNA 损伤反应[29]。电离辐射可诱导EGFR 内化至细胞核,使EGFR 与DNA-PK 结合,增强DNAPK 复合物的激酶活性并增加DNA 链断裂的修复[30]。此外,EGFR 还可以积极调节前列腺癌细胞系中的ERCC1 表达[31]并与ERCC1 发生物理相互作用[32],提示EGFR 在DNA 修复中的作用独立于DNA-PK。实际上,与单独放疗相比,放疗和EGFR 抑制剂的组合可以改善局部肿瘤的控制,并且该策略已被引入临床放疗实践中[33]。V.H. de Almeida 等临床数据表明,西妥昔单抗是一种抗EGFR的单克隆抗体,可以使妇科肿瘤细胞对放化疗敏感[34]。
TisotumabVedotin(TV),是一种针对组织因子(TF)的抗体-药物耦联物(ADC)。组织因子(TF)一种跨膜蛋白,是凝血的主要生理起因,参与血管生成、细胞黏附及运动。肿瘤中TF 参与了肿瘤信号传导和血管生成的蛋白质,在大多数的实体瘤中的高表达及快速内化,因此TF 是ADC 药物的理想靶标。将靶向TF 的单抗与可裂解的接头和细胞毒性药物单甲基奥瑞他汀E结合起来的新药能治疗多种肿瘤。该药物对多种实体瘤(宫颈癌、卵巢、子宫内膜、膀胱、前列腺、头颈部、食道、肺癌)的治疗效果正在研究中。Tisotumabvedotin 将单甲基奥瑞他汀E 传递至表达TF 的细胞,以诱导直接的细胞毒性和对邻近细胞的杀伤[17,18]。在复发或转移性宫颈癌的患者中,David S. Hong[35]等在innovaTV 201 I / II 期研究中发现tisotumabvedotin,在尚无标准治疗方法的患者中显示出可控的安全性,并具有抗肿瘤活性。研究人员和独立审查委员会评估的ORR 和长期应答之间的一致性进一步支持了tisotumabvedotin 的抗肿瘤活性。tisotumabvedotin 反应的持久性在4 例反应时间>8 个月的患者中得到了证实,尽管tisotumabvedotin 停用,该患者病例仍显示持续PR。观察到的现象表明了tisotumabvedotin 作用机制有多种,包括直接细胞毒性,邻近细胞杀伤和单甲基奥瑞他汀E 诱导的免疫原性细胞死亡,以及Fcγ 受体介导的效应功能和TF / FVIIa 信号的抑制。治疗引发的不良反应有出血相关的事件(由于TF 在凝血中的作用)和眼部事件(例如结膜炎,结膜溃疡,角膜炎)。鼻出血大部分为1级,不需要临床干预。大部分的眼部病变为1/2 级,眼部上皮显示了TF 的表达,这可能是导致眼部病变的原因。
2.2.5 免疫治疗
PD-1/PD-L1 抑制剂通过抑制PD-1/PD-L1 信号通路,解除肿瘤细胞对机体免疫系统的抑制,激活免疫系统,从而达到清除肿瘤细胞的作用[36]。PD-L1 表达在34.4%-96%的宫颈癌组织中均有表达,但在正常宫颈组织中很少有表达[37,38]。通过组织学类型分析观察到80%的宫颈鳞癌中PD-L1 表达[39]。在TCGA 数据库中,在22%的宫颈鳞状细胞癌患者中观察到PD-L1 出现扩增[40]。此外,PD-L1 可以在TILs 上表达,这在抗肿瘤反应阻滞中起作用。在宫颈鳞状细胞癌样本研究中,癌细胞和TIL 中PD-L1 的表达率分别为59.1%和47.0%[41]。这些数据表明PD-L1 和PD-1 在宫颈癌肿瘤细胞和间质中广泛表达,从而为PD-1 / PD-L1 抑制剂治疗奠定基础。
在宫颈癌中进行的免疫抑制剂的临床试验是KEYNOTE-158,研究了Pembrolizumab 在多种癌症类型中的抗肿瘤活性和安全性。纳入的宫颈癌患者中79%PD-L1 阳性 (≥1%为阳性)。在PD-L1 阳性肿瘤人群中,中位PFS 为2.1 个月(95%CI,2.1-2.3)。在总人群中,OS 的中位OS 为9.4 个月(95%CI,7.7-13.1),在PD-L1 阳性肿瘤人群中,平均OS 为11 个月(95%CI,9.1-14.1个月)[42],根据研究结果,在2018 年6 月,美国FDA 批准抗PD1阻断剂pembrolizumab 用于复发或转移性宫颈癌[43]。CheckMate 358 是一项I / II 期研究,旨在研究nivolumab 对病毒相关的肿瘤的抗肿瘤活性和安全性。共入组十九名宫颈癌患者。18 例患者处于FIGO 的III 或IV 期。18 名患者中有17 名(89.5%)曾经接受过放疗。每两周静脉给予Nivolumab 240 mg,治疗两年。ORR 为26.3%(五例患者)。三名患者曾接受过外科手术和放射治疗,三名患者中的两名曾接受过针对复发/转移性疾病的全身疗法。在PD-L1 阳性肿瘤患者中,ORR 为20.0%。总人口中位数PFS 为5.1 个月(95%CI,1.9-9.1)[44]。另一种PD1 阻断剂西米普利单抗也显示出这种潜力,无论是单一疗法还是放射疗法联合疗法,目前都处于III 期临床试验中。其他检查点抑制剂包括durvalumab,atezolizumab 和camrelizumab 处于该疾病临床开发的不同阶段。最后,根据较早的研究结果,涉及的PARP 抑制剂rucaparib 和olaparib 均处于II 期临床试验[45]。
3 小结
近几年,免疫治疗在复发性宫颈癌的研究取得了较大进展,但仍不可代替手术及放疗在复发性宫颈癌中的地位。根据患者具体情况制定合理的个体化治疗方案,合理使用手术、化疗、放疗、靶向治疗、免疫治疗等多种治疗方法,把不同治疗方式的优势及缺点向患者及家属清楚讲述,决定治疗方案时将会出现的各种风险充分评估。关于现阶段的靶向治疗及免疫治疗的效果及不良反应有待于进一步研究。

