禽源NME/NM23核苷二磷酸激酶2(NME2)基因的克隆及表达鉴定
谢丽基,谢芝勋,王盛,黄娇玲,邓显文,谢志勤,罗思思,曾婷婷,张艳芳,张民秀,范晴
(广西壮族自治区兽医研究所/广西兽医生物技术重点实验室,广西 南宁 530001)
禽呼肠孤病毒(ARV)主要引起家禽的病毒性关节炎/腱鞘炎、矮小综合征及吸收不良综合征等,尤为严重的是诱发免疫抑制,造成家禽对疫苗免疫应答能力和各种病原体抵抗力降低。σA蛋白是禽呼肠孤病毒S2基因编码的结构蛋白,能激活PI3K-AKT信号通路的作用[1],与禽呼肠孤病毒抗干扰素作用有关[2],在ARV的感染致病过程中发挥重要作用。本课题组在前期的免疫共沉淀(CO-IP)、质谱鉴定以及酵母双杂交筛选的研究中发现,禽源NME2是潜在的与禽呼肠孤病毒 σA 蛋白互作的宿主蛋白[3]。
NME(non-metastasis cells)基因即NM23基因,是Steeg等[4]学者从7株转移能力不同的小鼠黑色素瘤细胞系中,用差示杂交的方法蹄选鉴定出的一种与肿瘤转移抑制相关的基因,他们将此基因命名为NME基因。迄今为止,已发现属于基因家族的有10种,它们分别是到NME1到NME10[5]。二磷酸核苷激酶(nucleoside diphosphate kinase,NDPK)活性是NME家族共同的特征[6],其中,NME2(NME/NM23核苷二磷酸激酶2)编码的NDPK的B亚基,具有核苷二磷酸激酶活性,催化二磷酸核苷转化为相对应的三磷酸核苷[7],参与细胞的的能量代谢[8]、微管解聚[9]等过程,影响肿瘤的浸润和转移。
因此,本研究构建禽源NME2基因的真核表达重组质粒pEF1α-Myc-NME2,为后续进一步验证宿主蛋白NME2是否与禽呼肠孤病毒σA相互作用,并研究其对σA基因功能的影响奠定基础。
1 材料与方法
1.1 主要试验试剂
RT-PCR试剂盒、pMDTM18-T Vector Cloning Kit、PrimeScript Ⅱ 1stStrand cDNA Synthesis Kit、pEF1α-Myc载体和限制性内切酶SalⅠ和NotⅠ购自宝日医生物技术(北京)公司;T4 DNA连接酶和质粒提取试剂盒购自Promega公司;LipofectamineTM3000 Transfection Reagent购自Invitrogen 公司;Anti-Myc tag Mouse mAb购自Cell Signaling Technology公司;山羊抗鼠IgG (FITC)购自Abcam 公司;碱性磷酸酶标记的山羊抗鼠IgG购自碧云天公司。
1.2 引物的设计与合成
根据GenBank中禽源NME2基因序列(登录号:NM_205047.1),设计合成了1对特异性引物(表1),引物序列的斜体标记为酶切位点(EcoRⅠ和NotⅠ)。

表1 引物序列
1.3 NME2基因的克隆
1.3.1 RT-PCR扩增NME2基因
提取鸡胚成纤维细胞传代系(DF-1)的RNA,使用PrimeScript Ⅱ 1stStrand cDNA Synthesis Kit反转录成cDNA,并用表1中的特异性引物,对NME2基因进行PCR扩增。
1.3.2 NME2基因的克隆
将50 μL PCR产物电泳后,切胶后用DNA片断胶回收试剂盒纯化回收。将纯化PCR产物克隆至pMD-18T载体,得到pMD-18T-NME2重组菌。抽提重组菌及空载体pEF1α-Myc的质粒,分别用限制性内切酶EcoRⅠ和NotⅠ同时进行双酶切,酶切产物切胶回收后,用T4 DNA连接酶连接转化到 DH5α 感受态细胞中,得到pEF1α-Myc-NME2重组菌。对重组菌进行PCR检测、双酶切验证,并送深圳华大基因科技服务有限公司进行测序验证。
1.4 NME2基因的表达
1.4.1 转染细胞
参照无内毒素质粒大量提取试剂盒说明书,大量提取质粒(pEF1α-Myc、pEF1α-Myc-NME2),-20 ℃保存备用。参照脂质体转染试剂盒使用说明书,将质粒分别转染长成单层的DF1细胞(6孔板),同时设立阴性细胞组(未转染质粒)。
1.4.2 间接免疫荧光和Western blot检测NME2的表达
细胞转染24 h后弃掉培养液,用PBST洗涤3次,用预冷的甲醇和丙酮混合溶液于冰上固定细胞10 min,用PBS(4 ℃预冷)洗涤3次。在pEF1α-Myc、pEF1α-Myc- NME2转染的细胞中加入Anti-Myc tag Mouse mAb(1∶1 000稀释),37 ℃作用2 h。弃去细胞板中的一抗,用PBS(4 ℃预冷)轻洗细胞5次,加入FITC标记的山羊抗鼠IgG(1∶1 000稀释),37 ℃避光作用1.5 h。弃去细胞板中的二抗,用PBS(4 ℃预冷)轻洗细胞5次,荧光显微镜观察结果。
同时,收集转染后的DF1细胞,参考文献[10]的方法,使用Anti-Myc tag Mouse mAb和碱性磷酸酶标记的山羊抗鼠IgG,对目的蛋白NME2进行Western blot检测。
2 结果与分析
2.1 重组质粒的PCR鉴定及测序
通过菌液PCR对所构建的真核表达重组质粒pEF1α-Myc-NME2的阳性克隆进行筛选。如图1所示,NME2扩增的基因片段大小为462 bp,与预期大小相符。测序结果也证实了pEF1α-Myc-NME2重组质粒的正确性。
2.2 重组质粒的双酶切验证
真核表达重组质粒pEF1α-Myc- NME2的双酶切鉴定结果见图2。重组质粒pEF1α-Myc-NME2双酶切后,得到4 622 bp的载体条带和462 bp的NME2基因条带,说明NME2基因已经正确插入到表达载体pEF1α-Myc。

M.Trans DNA Marker;1、2.pEF1α-Myc-NME2图1 真核表达重组质粒的PCR鉴定
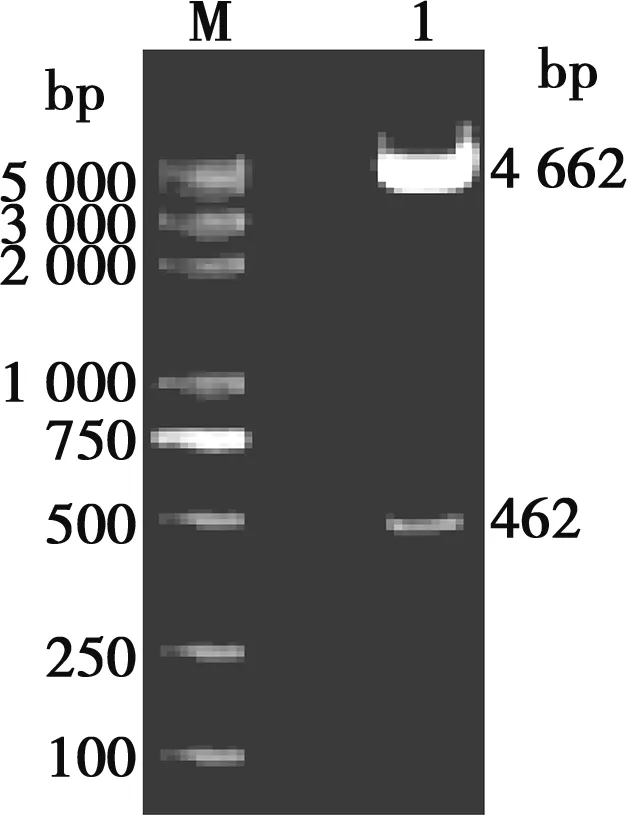
M.Trans2K Plus DNA Marker;1.pEF1α-Myc-NME2图2 真核表达重组质粒的双酶切验证
2.3 间接免疫荧光检测目的蛋白的表达
如图3所示,在荧光显微镜下,真核表达重组质粒pEF1α-Myc-NME2转染组的DF1细胞均可观察到绿色荧光的出现,而分别以鼠源Myc标签抗体为一抗的阴性对照组则无绿色荧光的出现。

A.阴性对照;B.pEF1α-Myc-NME2图3 间接免疫荧光检测结果
2.4 Western blot检测目的蛋白的表达
如图4所示,真核表达重组质粒pEF1α-Myc-NME2表达的Myc-NME2融合蛋白在大约19.4 kDa处有单一的目的条带,而阴性对照组没有条带。

M.蛋白Maker;1.阴性对照;2.pEF1α-Myc-NME2图4 Western blot检测目的基因的表达
3 讨论
NME2参与多种细胞活动,包括细胞增殖、生长、黏附和分化[11]。NME2 蛋白对于细胞凋亡也发挥重要作用。研究表明,NME2 蛋白作为Diva和Bcl2- L-10特异性结合蛋白,在细胞凋亡过程中发挥新的生物学功能[12-13]。NME2蛋白的过量表达能够诱导凋亡。Xiao等[14]研究报道,高表达量的NME2蛋白能够和TIP30转移抑制因子协同促进细胞凋亡;NME2蛋白的缺失引起Diva性凋亡活动的增加[15]。
本课题组在前期的CO-IP、质谱鉴定以及酵母双杂交的研究中,发现了禽源NME2基因蛋白是潜在的、与禽呼肠孤病毒σA蛋白互作的宿主蛋白[3]。为进一步的验证,需要将NME2基因克隆到真核表达载体,并与禽呼肠孤病毒 σA基因的重组质粒共同转染细胞,进行双向CO-IP和Western blot,验证NME2与禽呼肠孤病毒σA的相互作用。因此,本研究选定禽源NME2基因,分别设计了特异性引物进行RT-PCR扩增、双酶切和克隆,构建了宿主蛋白NME2的真核表达重组质粒,并命名为pEF1α-NME2。本研究构建重组质粒,所选用的真核表达载体pEF1α-Myc带有Myc标签,Myc这种标签的分子量较小,对后续表达的外源靶蛋白空间结构影响小,不会对蛋白质的功能产生影响。
本研究将真核表达重组质粒pEF1α-NME2转染DF1细胞后,经间接免疫荧光和Western blot两种方法,验证了Myc-NME2融合蛋白的正确表达,为后续进一步验证禽源宿主蛋白NME2是否与禽呼肠孤病毒σA蛋白相互作用奠定基础。

