Angiopep-2 用于脑靶向递药系统的研究进展
翁丹芳,鲁晟*,葛双敏
(1.湖州市第一人民医院药剂科,浙江 湖州 313000;2.宁波市医疗中心李惠利医院药剂科,浙江 宁波 315000)
20 世纪末,靶向给药体系成为药剂学研究的热点,对肝靶向、脾靶向及肺靶向的深入研究并取得突破性进展后,人们将目光放到脑靶向给药系统的研究上。脑部疾病如帕金森病(parkinson's disease,PD)、脑部肿瘤、脑血管疾病等的发病率逐年上升,已成为严重危害人类健康的一类重大疾病[1]。人体脑屏障(见图1)有:第一界面血脑屏障(blood-brain barrier,BBB),主要是由脑毛细血管壁的内皮细胞产生,存在于血液循环和脑实质之间,限制血液循环和脑实质间的内源性、外源性物质交换,使中枢神经系统相对独立于外周组织,保持一定的稳定性。第二界面为血脑脊液屏障[2],位于脑室脉络丛的血液与脑脊液之间,其结构基础主要是脉络丛上皮细胞之间有闭锁小带相连。但脉络丛的毛细血管内皮细胞上有孔,故仍具有一定的通透性。脑脊液通过脉络膜丛上皮细胞分泌进入脑室系统,而大脑细胞外液的其余部分即间质液,至少部分通过血脑屏障毛细血管内皮分泌。第三界面由硬脑膜下的无血管蛛网膜上皮提供[3],位于脑室和蛛网膜下隙的脑脊液与脑、脊髓的神经细胞之间,其结构基础为室管膜上皮、软脑膜和软膜下胶质膜。但室管膜上皮之间主要为缝隙连接,不能有效地限制大分子通过,软脑膜的屏障作用也很低。因此,脑脊液的化学成分与脑组织细胞外液的成分大致相同。虽然蛛网膜也形成屏障层,但其无血管性和相对较小的表面积,意味着它不代表血液和中枢神经系统之间交换的重要表面。一方面,BBB保护脑免受病原微生物、毒性分子甚至机体自身免疫系统等的侵扰,对维系脑稳态起重要作用;另一方面,BBB 可阻碍治疗药物(≥98%)的进入,限制治疗药物从血液向脑内转运,是目前治疗脑部疾病中难以逾越的障碍[4]。具有脑靶向性质的angiopep-2 是由19 个氨基酸残基组成,序列为TFFYGGSRGKRNNFKTEEY,广泛用于修饰纳米载体使其成为脑靶向递药系统。现就angiopep-2 在靶向递药系统中的应用作一综述。
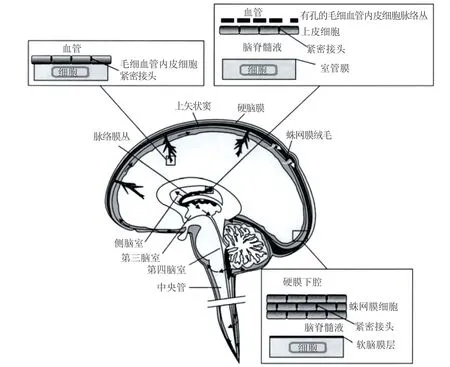
图1 血液和大脑之间的三大屏障[1]Figure 1 Three principal barrier sites between blood and brain
1 Angiopep 生物学性质
1.1 Angiopep 来源
研究人员通过对抑肽酶(aprotinin)中含有Kunitz 结构域的氨基酸序列进行筛选,最终鉴定出一类能与低密度脂蛋白受体相关蛋白(lowdensity lipoprotein receptor-related protein,LRP)结合,介导穿透BBB 的相关肽家族,命名为angiopep[5]。在原酶的作用下,血管中的angiopep 转变成angiopep-1,再经血管中的转变酶作用,得到angiopep-2。研究发现,angiopep-2 通过脑毛细血管内皮细胞上表达的LRP,介导治疗药物进入脑内(见图2)[6],脑部治疗药物与受体angiopep-2 特异性识别、结合并介导其跨越BBB 进入脑内,增加脑组织中的药物浓度,进而提高脑部疾病的治愈率[7]。研究表明,angiopep-2 负载药物高效进入脑实质细胞,其效率比经典靶向分子转铁蛋白更高[8]。另有研究显示,LRP 在胶质细胞瘤的细胞质及细胞表面均有表达[9]。

图2 Angiopep-2 穿越血脑屏障靶向胶质瘤示意图[6]Figure 2 Schematic diagram of angiopep-2 crossing BBB to target gliomas
1.2 Angiopep 在血脑屏障中的转运形式
Angiopep-2 是Kunitz 型抑肽酶的一种,与LRP-1 具有较高的结合率和大脑穿透能力,可用于胶质瘤靶向给药[10]。在BBB 中,有被动转运、载体介导的转运(CMT)、受体介导转运(RMT)、吸附介导转运(AMT)、吸附外排转运(AET)等多种转运机制[11]。Angiopep 是以RMT 的转运机制穿越BBB,即内源性物质与BBB 腔面上表达的特异性受体结合,通过胞吞作用形成内吞小体,再经胞吐作用释放配体,使其能穿过BBB 进入脑组织,从而发挥生物学作用[12]。Angiopep-2 与BBB 或脑胶质瘤细胞上高度表达的LRP-1 特异性识别并结合,angiopep-2 包覆特异性药物在病灶膜表面凹陷并形成转运小泡,透过BBB 进入病变部位,从而达到治疗目的。
2 脑疾病治疗中angiopep-2 介导通透血脑屏障
2.1 颅内真菌感染和脑胶质瘤
目前,颅内真菌感染的治疗并不是很理想,且死亡率比较高。针对脑膜炎这类疾病,疏水性抗真菌药两性霉素B(amphotericin B,AmB)已成为系统性治疗真菌感染的金标准,但AmB 难以渗透至中枢神经系统,所以治疗效果不明显。为了提高AmB 渗透性,Shao 等[13]开发了一种有效的脑靶向聚合物胶束系统,该系统是由angiopep-2、聚乙二醇(PEG)、聚乙烯(PE)和AmB 组成的具有靶向性的聚合物胶束angiopep-PEG-PE/AmB。结果表明,angiopep-PEG-PE/AmB 治疗组的治疗效果最好,脑中AmB 水平最高,降低组织病理学严重程度,并延长中位生存时间。治疗功效的提高可归因于该脑靶向递送系统促进AmB 穿过BBB 并渗透到大脑中达到治疗浓度。此外,也有研究发现,含有阿霉素(DOX)、angiopep-2 和PEG 的金纳米粒(An-PEG-DOX-AuNPs)系统可介导穿透BBB向神经胶质瘤细胞递药;细胞摄取研究表明,细胞内An-PEG-DOX-AuNPs 的分布强度明显高于不含angiopep-2 的PEG-DOX-AuNPs;在体内,An-PEGDOX-AuNPs 可以比PEG-DOX-AuNPs 和游离DOX更好地分布到神经胶质瘤中[14]。Lu 等[15]开发了一种双靶点药物输送系统,该系统将DOX 负载于包含angiopep-2的可生物降解的多聚体(Ang-PS-DOX)上,利用LRP 转运,大幅提高DOX 的输送效率;与载有DOX 的多聚体(PS-DOX)相比,Ang-PSDOX 在C6 细胞中表现出更高的细胞摄取率和更强的细胞毒性;体内药代动力学和脑组织分布实验表明,Ang-PS-DOX 在神经胶质瘤细胞中的分布比PS-DOX 更为广泛,且积累更为丰富;此外,相比PS-DOX 或游离DOX,Ang-PS-DOX 治疗脑胶质瘤大鼠的存活时间明显延长。这些结果提示,Ang-PSDOX 可以靶向神经胶质瘤细胞并增强化疗功效。
2.2 帕金森病
PD、阿尔茨海默病(alzheimer disease,AD)和卒中等神经退行性疾病病因与抑制神经细胞退行性改变的启动因子、阻断神经细胞退行性改变的信号传导和激活内源性神经保护机制相关。许多抗氧化剂对氧化应激下的中枢神经细胞具有保护作用,但往往受限于无法穿透BBB。近年来,用表面活性剂如聚山梨酯80、右旋糖酐或PEG 涂覆的药物递送系统已用于PD 的治疗[16]。Angiopep-2 与亲水性PEG、可生物降解的树状L 赖氨酸(DGL)偶联,生成的DGL-PEG-angiopep(DPA)对鱼藤酮诱导的慢性PD 的神经细胞起到保护作用[17]。结合内源性受体介导穿越BBB 的策略,将聚合物纳米粒(nanoparticle,NP)与转铁蛋白、胰岛素、谷胱甘肽(glutathione,GSH)、低密度脂蛋白(low-density lipoprotein,LDL)、angiopep、羟基丁酸或抗体缀合,不仅成功合成能够透过BBB 的药物载体,而且延长了给药时间及维持病变部位药物浓度稳定[18]。
2.3 癫痫
癫痫(epilepsy)是一种短暂的脑功能障碍的慢性疾病,临床表现为神经元突发性异常放电,也是较为常见的神经性系统疾病之一,发病率较高[19]。现阶段癫痫治疗主要为药物治疗,但效果欠佳。Ying 等[20]研究显示,以电响应性水凝胶纳米粒(ERHNPs)结合angiopep-2 来促进苯妥英钠的传递,有效缓解了癫痫发作病情。在该项研究中,电响应性ERHNPs 的作用是在脑电癫痫样异常状态下释放药物;设计的脑靶向药物angiopep-ERHNPs,与LRP 结合介导治疗癫痫;angiopep-ERHNPs 具有穿透BBB 的功能,且靶向药物易在脑电癫痫样异常的中央部位集中分布,从而达到治疗的目的(见图3)。由此可见,angiopep-ERHNPs 的结合不仅提高了药物抵达病变部位的效率,而且有效缓解了神经元突发性异常放电,是一种很有前途的治疗策略。在此基础上,Xu 等[21]研究发现,angiopep-ERHNPs 可降低苯妥英钠的使用剂量,与相同剂量的苯妥英钠溶液相比,angiopep-ERHNPs 具有更好地控制癫痫发作的效果。这些结果表明,angiopep-ERHNPs 能够有效地将苯妥英钠转运至大脑,并在发生癫痫样活动处释放。
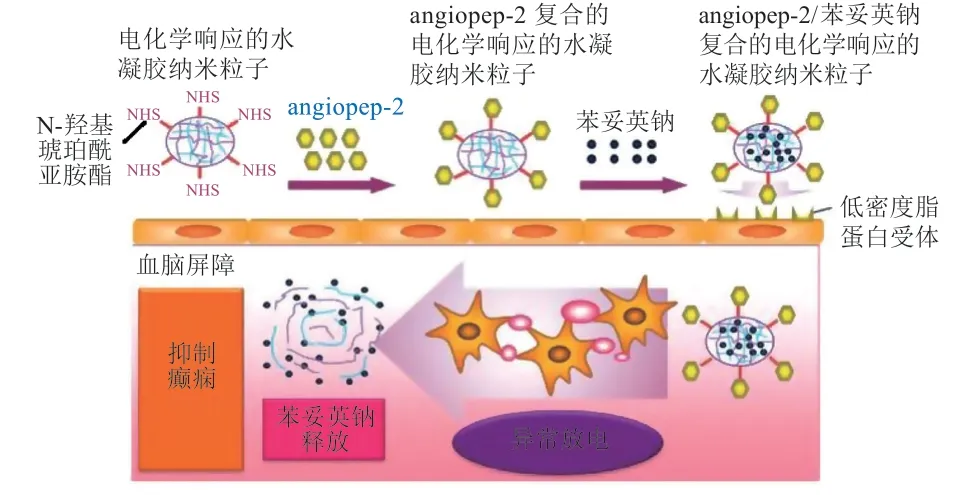
图3 Angiopep-ERHNPs 抗癫痫治疗的示意图[20]Figure 3 Schematic diagram of angiopep-ERHNPs antiepileptic treatment
3 Angiopep-2 的双重靶向作用
Angiopep-2 修饰的载药纳米粒既可以与LRP 特异性结合介导靶向BBB,也可以介导靶向脑胶质瘤。以angiopep-2 作为靶头构建的双重靶向递药系统具有1 个头基2 种靶向效应的“一头双靶”功能。因脑肿瘤的生长、进展的复杂性和特殊性,脑肿瘤治疗依旧未得到显著改善。相较于外周肿瘤,脑肿瘤的生理和病理环境差异较为明显。脑胶质瘤是最常见的脑瘤,为35 岁以下成人癌症死亡的第二大原因,占原发性中枢神经系统肿瘤的40%以上[22-23]。由于传统的手术切除不能防止癌细胞扩散入侵至周围的正常组织,必须用药物辅助治疗,然而由于BBB 的限制,脑部肿瘤化疗药物几乎无法进入脑内病灶[24]。在脑肿瘤不同时期BBB 差异较大,早期BBB 较为完整,中后期BBB 一定程度被破坏。研究显示,LRP 受体介导的纳米载体可促使化疗药物进入脑内,LRP 受体在BBB 上高度表达,可介导多种配体跨BBB 转运[25]。体内外BBB 和原位脑灌注模型中,aniopep-2 均显示出良好的渗透性,并且在脑胶质瘤细胞表面大量表达。Angiopep-2 发挥双级脑靶向功能,实现了对脑胶质瘤细胞的多重作用,如增强药物对病灶的作用、减少全身不良反应等。作为载体的纳米粒、脂质体和聚合物胶束可与angiopep-2 结合,从而构建脑靶向递药系统[9,26]。
3.1 纳米粒递药系统
Angiopep-2 修饰的纳米递药系统作用于LRP,促使递药系统向脑肿瘤部位释放治疗药物。已研究的载体材料有聚乙二醇-聚己内酯(PEG-PCL)、聚乙烯-聚乙二醇(PE-PEG)、聚酰胺-胺-聚乙二醇(PAMAM-PEG)、聚乳酸-聚乙二醇(PLA-PEG)等。在人脑微毛细血管内皮细胞(HBMEC)、U87 细胞系或C6 细胞系分别构建BBB 模型和脑胶质瘤模型中,常以单包或双包的形式将模型药物(化疗药物、基因药物等)进行包载,以angiopep-2 为单靶头或angiopep 结合其他靶头进行药物的靶向传递[27]。Parashar 等[28]使用angiopep-2 锚定PEG 化聚丙烯亚胺(PPI)树状大分子,合成了PPI 树状聚合物,并用PEG-2000 进行交联,进一步将PEG 化的PPI 树状聚合物与angiopep-2 偶联成ANG-PEG-PPP,其改善了通过BBB 进入脑神经胶质瘤附近的药物递送,配体缀合的PPI 树状聚合物载有紫杉醇,其最佳载药量为(57.42±0.8)%;对PPI 树状大分子负载紫杉 醇(PPI dendrimers were loaded with Paclitaxel,PAPP)聚合物的比色分析和细胞摄取研究表明,其对C6 胶质瘤细胞具有较强的抗增殖活性;脑毛细血管内皮细胞和C6 胶质瘤细胞的体外共培养模型发现,作为具有应用前景的纳米载体,angiopep-2共轭PEG 化的PPI 树状大分子,可将紫杉醇靶向递送至脑神经胶质瘤。Su 等[29]研究显示,angiopep-2修饰的人参皂苷-Rg3 纳米粒(ANG-Rg3-NP)可抑制C6 胶质瘤细胞的增殖;经angiopep-2 修饰使纳米粒更易穿过BBB 并加速细胞对药物的摄取。Han 等[30]研究冰片与DOX 负载聚酰胺-胺树状大分子(polyamidoamine dendrimer,PAMAM)药物传递系统相结合,对促进药物透过BBB 并协助胶质瘤的治疗作用时,发现angiopep-2 修饰可增强树突状大分子与靶细胞的亲和力,最终增加对药物的摄取,增强抗肿瘤能力;冰片物理结合可进一步提高该靶向递药系统穿透BBB 后的抗肿瘤效率;与游离DOX 相比,该靶向递药系统具有明显的释放药物持续性,且结构中的氨基在酸性环境下发生质子化反应易于释放药物。Angiopep-2 与细胞表面的LRP 特异性结合实现脑靶向性,该系统有望成为脑靶向基因药物递送的有效手段。此外,Xu 等[31]研究发现,angiopep 和DOX 连接到第4 代PAMAM 构建的G4-DOX-angiopep-PEG 树状聚合物,可增强对BBB 的穿透性和药物在神经胶质瘤细胞中的积累;在pH为7.4 和GSH 浓度为10 mmol · L-1时,体系中DOX的释放量达到44%,不含GSH 时DOX 仅释放3%;体外转运实验显示,G4-DOX-angiopep-PEG 可在12 h内递送11%的DOX;该载体可通过LRP 介导的胞吞作用而内化到C6 胶质瘤细胞中;angiopep-2 通过LRP 介导的内吞靶向作用使DOX 在肿瘤部位的蓄积增加,导致无血管C6胶质瘤球体的体积有效减小。
3.2 聚合物胶束递药系统
2-甲氧基雌二醇(2ME2)作为微管抑制剂和缺氧诱导因子1(HIF-1)抑制剂,可用于治疗脑缺血再灌注(I/R)损伤,但水溶性较差影响其作为神经保护剂的功效。Hu 等[32]成功合成了PEG 化2ME2和angiopep-2 修饰的PEG 化2ME2,并通过乳液-溶剂蒸发法制备了包含游离2ME2 的经angiopep-2 修饰的PEG 化2ME2 胶束(ANG-PEG-2ME2/2ME2);通过不同程度PC12 细胞损伤的氧-葡萄糖剥夺/复氧(OGD/R)模型评估该胶束对缺血-复氧损伤的作用发现,与游离的2ME2 相比,该胶束显著提高了PC12 细胞的细胞活力,可有效减少OGD/R 诱导的PC12 细胞损伤。Zong 等[33]用angiopep-2 修饰脂质-聚合物(缺氧放射增敏多药前体)递送替莫唑胺(TMZ)递药载体,在BBB 和人胶质瘤细胞中表达,从而提高胶质瘤药物包封效率。该研究中前体药物将水溶性差的TMZ 包裹起来,其表面硝基在低氧条件下转化为亲水性的氨基,以增强放射治疗过程中的敏感度;以angiopep-2 修饰的脂质体在药物壳上形成单分子层,进而形成具有靶向作用的脂质-聚合物递药系统,在BBB 和神经胶质瘤细胞中特异性表达。
3.3 脂质体递药系统
Li 等[34]构 建 了angiopep-2 修 饰 的1,2-二油酰基-3-三甲基铵丙烷(DOTAP),并设计了angiopep-2 修饰的阳离子脂质-乳酸-乙醇酸共聚物(PLGA),递送TMZ 和DNA 修复抑制剂(Dbait)进入胶质母细胞瘤细胞,实现了胶质瘤的化学放疗;在细胞水平上,构建的载体angiopep-2-PEG2000/DOTAP/PLGA(APDP)负载TMZ/Dbait 可被细胞内吞并增强药物在脑肿瘤中的蓄积。APDP+TMZ/Dbait 作为一种多用途的纳米脂质体药物,在协同化疗和放射增敏过程中对恶性肿瘤的治疗具有较大的潜力。Yang 等[35]研究了双肽脂质体抗肿瘤的疗效,以angiopep-2 和神经纤毛蛋白修饰的脂质体负载血管内皮生长因子和多烯紫杉醇,在肿瘤治疗过程中起到抗增殖的作用;双肽修饰的脂质体保持了与神经胶质瘤细胞的结合能力,而且通过特异性受体介导的内吞作用增强药物内化;与未经修饰的脂质体相比,双肽修饰的脂质体具有刺激基因沉默和抗增殖活性的作用。Kim 等[36]利用angiopep-2 和抗CD133 单克隆抗体开发了双靶免疫脂质体封装的TMZ,用于BBB 胞吞作用和特异性递送至胶质母细胞瘤干细胞,研究发现与游离的TMZ 和非靶向性的TMZ 脂质体相比,对恶性胶质瘤细胞的体外细胞毒性增加了425 倍和181 倍;与此同时,双靶免疫脂质体封装的TMZ 在恶性胶质瘤细胞中的凋亡和抗迁移能力也显著增强。由此可见,脂质体包封药物在穿透BBB 和肿瘤部位给药方面效果显著,可作为靶向治疗恶性肿瘤的有效手段。
4 Angiopep 与细胞穿透肽联合使用
细胞穿透肽(cell penetrating peptides,CPPs)是由5 ~ 30 个氨基酸组成的短肽,CPPs 毒性低,能够在保证活性分子正常发挥作用的同时不产生免疫反应,可以有效地将亲水性蛋白质和多肽[37]、核酸片段(DNA、RNA 和反义寡聚核苷酸)[38-39]、小分子药物、量子点[40]和MRI 成像造影剂[41]等在内的多种药物分子,通过离体和在体的方式导入种类广泛的细胞中。某些CPPs 甚至能够携带药物分子穿过BBB、血睾屏障、胎盘屏障等屏障系统发挥作用。此外,CPPs 不仅可以充当药物分子的运载工具,而且有些CPPs 本身就具有一定的生物学功能[42-43]。因而,CPPs 作为有效的生物活性分子细胞内的转运工具,尤其是在药物开发、基因生物治疗以及肿瘤靶向治疗等研究领域均具有广阔的应用前景。
Angiopep-2 作为靶头与CPPs 相结合可获得更好的治疗效果,是由于angiopep-2 对BBB 和肿瘤组织上的受体选择性高,但穿透性低;CPPs 恰好相反,CPPs 对BBB 和肿瘤组织上的受体选择性低,但其穿透性高,从而达到互补的作用,使药物更快、更准地到达靶部位。Jiao 等[44]开发了一种基因传递系统,以增强神经胶质瘤对放射疗法的敏感性。由于肿瘤微环境中基质金属蛋白酶2(MMP-2)的上调,利用MMP-2 反应性肽作为可酶降解的连接物来缀合angiopep-2;结果表明,微环境响应性胶束保持了合理的尺寸(80 ~ 160 nm),分布适中,交联平均直径减小,并且具有较低的临界胶束浓度,有效地提高了放射治疗中胶质瘤的敏感性。微环境响应性胶束在胶质瘤体外放疗中表现出较高的基因转染效率,提高了脑穿透和靶向胶质瘤的效率,改善了生物相容性,提高了治疗效果;体内研究也显示其对胶质瘤具有良好的靶向性,对正常组织无明显毒性。以上结果显示这种肿瘤触发胶束系统具有较好的应用潜力。
5 结语
综上所述,angiopep-2 作为靶头在靶向递药系统中发挥重要作用,在增强对脑胶质瘤靶向传递作用的同时,可增强药物对恶性肿瘤的细胞毒性,促进病变细胞死亡和增强对细胞的捕获能力。作为脑靶向的短肽,angiopep-2 可与药物载体连接用于治疗脑胶质肿瘤、PD、AD、脑卒中、癫痫等难治性脑部疾病。Angiopep-2 可包覆难以抵达病灶的药物或基因,与LRP 结合介导穿透BBB,成功将药物或基因递送至病变部位。此外,angiopep-2 有多重靶向作用,可介导多种修饰转运药物。但angiopep-2存在的缺点也受到广泛关注,肽键的不稳定性也是影响angiopep-2 靶向递药的问题关键,而且受药物结构的影响,angiopep-2 与药物的相互作用弱、可塑性差、不易复合,影响细胞内的转运。目前,对angiopep-2 的修饰通常以PEG 修饰,减小药物在体内的首过效应,增强穿越BBB 作用,从而达到治疗的效果。如何寻找一个比angiopep-2 更好或与其他稳定多肽结合产生更强靶向作用的靶头也是今后靶向制剂研究的热点。

