聚合物基仿生医用胶黏剂的开发与应用
吴可可,赵益涛,吴 敏,李 越,胡志奇,卢智慧,郭金山
(1.南方医科大学基础医学院组织胚胎学教研室,广州 510515;2.南方医科大学南方医院整形美容外科,广州 510515)
受伤组织的闭合是其结构和功能重建的关键步骤,全世界每年约有1.14亿例手术造成的组织损伤[1]。生物医用胶黏剂又称组织胶黏剂,是一类用于生物组织创伤黏合修复的胶黏剂。近年来,生物医用胶黏剂由于使用方便及在伤口闭合、止血、组织密封、植入物固定和药物输送等生物医学领域的广阔应用前景而引起越来越多的关注[2-9]。医用胶黏剂从功能上可分为黏合剂(adhesive)、止血剂(hemostatic agent)和密封剂(sealant);医用胶黏剂从剂型上又可分为可注射水凝胶类胶黏剂或黏附型贴片。
市场上现有的医用胶黏剂虽然在一定程度上能满足使用需求,但在湿态下如何使其对生物组织产生强力黏附一直是科学界面临的难题。经过长期进化,自然界中许多生物包括贻贝、蛞蝓、壁虎、章鱼、沙堡蠕虫等动物以及单宁、常春藤等植物,各自形成了独特的黏附策略[2,3],它们能在水下或潮湿环境中强力黏附在各种表面。动物或植物体内存在止血[2,10]、蛋白质交联(如谷氨酰胺转胺反应)[11]、黏性物质分泌[12-14]等生物过程。研究者师法自然,从生物、化学和物理仿生的角度模拟各种动植物的黏附策略,开发了一系列仿生医用胶黏剂。软组织手术伤口黏合修复和日常伤口护理是医用胶黏剂的传统市场,骨和牙齿填充修复也是医用胶黏剂的重要应用领域。慢性伤口再生修复以及医疗美容和微整形也涉及伤口闭合且市场更广,但医用胶黏剂需要引入抗菌、促进血管生成、促进骨再生或防止疤痕生成等功能才能应用在这些方面。近年来,医用胶黏剂也被用作药物载体,用于透皮、黏膜给药或肿瘤切除术后的原位治疗。
本文总结了各类聚合物基仿生医用胶黏剂及其应用(图1),包括:(1)纤维蛋白胶[10,15]、转谷氨酰胺酶催化的胶黏剂[11]、基于大鲵皮肤分泌物的组织黏合剂[14]、活体胶黏剂[12,13]等生物仿生胶黏剂;(2)多酚类(酪氨酸基(含单酚羟基)[16,17]、贻贝仿生(含邻苯二酚)[18-26]和单宁仿生(含邻苯三酚)[27-29])、沙堡蠕虫仿生胶黏剂[30]等化学仿生胶黏剂;(3)壁虎[18,31-33]、章鱼[34,35]和吸盘鱼[36]仿生胶黏剂以及常春藤仿生(纳米)胶黏剂[37]等物理仿生胶黏剂;(4)蛞蝓仿生[38-40]等其他类型仿生胶黏剂。本文还介绍了医用胶黏剂在手术伤口黏合、日常伤口护理、慢性伤口修复、骨和牙齿缺损填充与修复以及胶黏剂载药体系等生物医学领域中的应用,并展望了医用胶黏剂的未来发展方向,包括其在医疗美容和微整形领域的潜在应用前景和目前的产品开发策略。
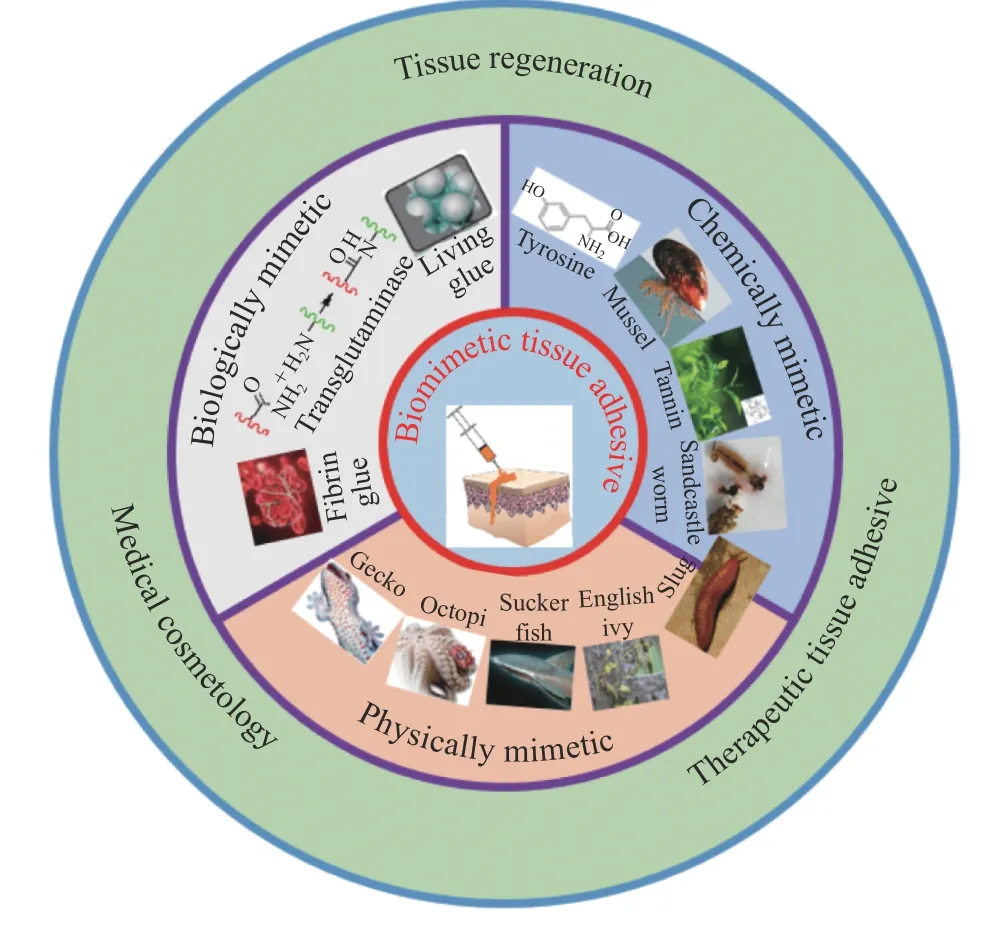
图1 仿生医用胶黏剂及其应用Fig.1 Biomimetic tissue adhesives and their applications
1 聚合物基仿生医用胶黏剂的开发策略与黏合机理
1.1 生物仿生胶黏剂
1.1.1 纤维蛋白胶(fibrin glue, FG) 作为人体血液中的一种蛋白质,纤维蛋白在血液凝固过程中起重要作用,其在外科手术中的应用可追溯到1909年[2]。典型FG主要由浓缩的纤维蛋白原(组分A,含凝血因子XIII和其他血浆蛋白)和凝血酶(组分B,含氯化钙和纤维蛋白溶解抑制剂)组成,它能模拟凝血级联反应的最后阶段,是目前临床上使用最广泛的组织黏合剂[10,15,41]。组分A和B混合后,纤维蛋白原在凝血酶作用下形成纤维蛋白单体,并进一步形成聚合物。同时凝血酶在氯化钙存在下激活凝血因子XIII,使其转变为因子XIIIa,通过使纤维蛋白分子间形成酰胺键交联并形成不溶性凝块而稳定交联网络,并同时与周围生物组织间形成交联(图2(a))。FG具有良好的生物相容性和降解性,可喷涂或注射,且具有成胶速率快、易于操作等优点,常被视为医用胶黏剂的标准。
纤维蛋白胶于1998年获得美国食品药品管理局(FDA)批准以前,已在欧洲广泛应用于临床。目前市场上的纤维蛋白胶品牌主要有Tisseel(Baxter公司)、Evicel(Ethicon)、CryoSeal(Thermogen)、Hemaseel(Haemacure Corp.)、Crosseal(Omrix)和TachoSil(Pharmaceuticals International GmbH)。纤维蛋白胶具有止血功能,常被用作止血剂和密封剂,在各类外科手术中用于局部止血、防止渗透、防止组织黏连和促进愈合[2,10],用在骨组织工程中[42]以及作为药物载体用于肿瘤切除后的局部免疫治疗[5]。然而,纤维蛋白胶对生物组织的黏附强度低,它的使用还可能带来风险和安全威胁。牛源凝血酶可引起一些病人的过敏反应,还有传染疾病的风险。人体血液与牛源凝血因子V或凝血酶反应时有可能产生一些抗体,它们可能与人体凝血过程产生交叉反应,严重时会导致出血。人源凝血酶的开发虽能在一定程度上解决这些问题,但也有艾滋病、甲/乙/丙型肝炎等血液源疾病传播的风险[10,22]。此外,蛋白等的低温储藏和冷链运输也增加了FG的使用成本。
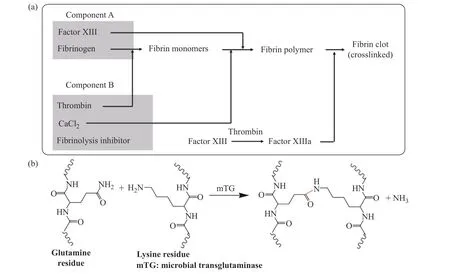
图2 (a)纤维蛋白胶的作用机理(模拟人体中凝血级联反应的最后阶段);(b)转谷氨酰胺酶催化的胶黏剂的交联机理Fig.2 (a)Mechanism of action of fibrin glue, simulating the final stage of the coagulation cascade in the human body; (b)Cross-linking mechanism of glutamine transferase-catalyzed adhesivers
1.1.2 转谷氨酰胺酶催化的胶黏剂 转谷氨酰胺酶可在人体中催化蛋白质间/内的酰基转移反应,从而导致蛋白质(或多肽)之间发生共价交联,一般用于形成生物屏障的制造以及结构的稳定所必需的交联蛋白质,如血液凝块(凝血因子XIII)[43]、皮肤(角质形成)和头发。在哺乳动物细胞中,转谷氨酰胺酶是钙依赖性的[43]。一种非钙依赖性的微生物转谷氨酰胺酶(microbial transglutaminase, mTG)的发现促进了各种相关应用的研究,尤其是在食品工业中被用来交联蛋白质,改善富含蛋白质食品如鱼糜、火腿、仿蟹肉和鱼丸等的质地[11]。2010年,这种被称为“肉胶”的食品添加剂在欧盟被禁止使用。然而,这并不影响其在胶黏剂领域中的应用。mTG曾被用于催化谷氨酰胺和赖氨酸残基之间的酰基转移反应而使明胶交联(图2(b)),凝胶时间可控制在几分钟之内。所得胶黏剂的杨氏模量与纤维蛋白胶相当,而其搭接剪切黏结强度(lap-shear adhesion strength)则显著高于纤维蛋白胶的相应值[11,44]。mTG除了能催化谷氨酰胺和赖氨酸残基之间的酰基转移反应,还能催化谷氨酰胺和其他壳聚糖侧链胺基等的反应[11,45],被广泛用于医用胶黏剂的开发中,且所得胶黏剂对生物组织的黏结力强,pH和热稳定性好,然而,mTG的生物安全性还有待进一步验证。
1.1.3 基于大鲵皮肤分泌物的组织黏合剂 大鲵(娃娃鱼)的皮肤腺体在受到刺激时会分泌白色黏液,其主要成分是蛋白质、氨基酸、黏多糖及抗菌肽等。据《本草经集注》记载,大约1 600年前的南北朝时期人们就用大鲵的皮肤分泌物来治疗烧伤。Deng等[14]收集了大鲵皮肤黏液,经纯化、冷冻干燥和研磨后即可得到一种用于伤口愈合的基于大鲵皮肤分泌物的组织黏合剂。这种组织胶黏剂比纤维蛋白胶具有更强的组织黏附能力,且展现出优于氰基丙烯酸酯胶黏剂的弹性和生物相容性,可以促进皮肤伤口的愈合并在3周内完全降解。Deng等[14]在大鲵、蟾蜍等3种两栖动物分泌的皮肤黏液中检测出56种不同类型的抗菌肽,这些抗菌肽能够显著抑制细菌的生长。基于大鲵皮肤分泌物的组织黏合剂的开发为仿生胶黏剂的研究开辟了新的领域。
1.1.4 活细菌胶黏剂 即使在水流不断冲刷下,细菌也能靠其对水下表面的黏附力在水下环境中定殖。新月形茎杆菌(Caulobacter crescentus)能够分泌一种黏稠的含糖物质,使其成为最早出现在水下表面的定殖菌之一[12]。2006年,Tsang等[12]利用一种微操作技术,测得了新月形茎杆菌单细胞在硼硅酸盐基底上的黏附力,发现其与基底的黏附强度大于68 N/mm2,超过壁虎的脚趾刚毛对表面的黏附强度,比其他任何已知的生物黏合剂的黏附强度都高。Zhang等[13]结合基因工程和材料科学,通过对枯草芽孢杆菌(Bacillus subtilis)进行基因改造使其能够将贻贝足蛋白(TasA-Mefp5)嵌入到富含工程淀粉样蛋白的功能化细胞外基质中,将贻贝、藤壶和沙堡蠕虫这3种海洋生物所采取的水下黏合策略整合起来,得到黏附性枯草芽孢杆菌生物被膜,首次发展了一种兼具强大黏附能力和生物活性的多功能活体胶水,展现出只有生命系统才拥有的环境响应和自我再生能力,可按需实现机械修复甚至自主修复,包括光控空间靶向修复和血液感应自主修复(图3)[46]。
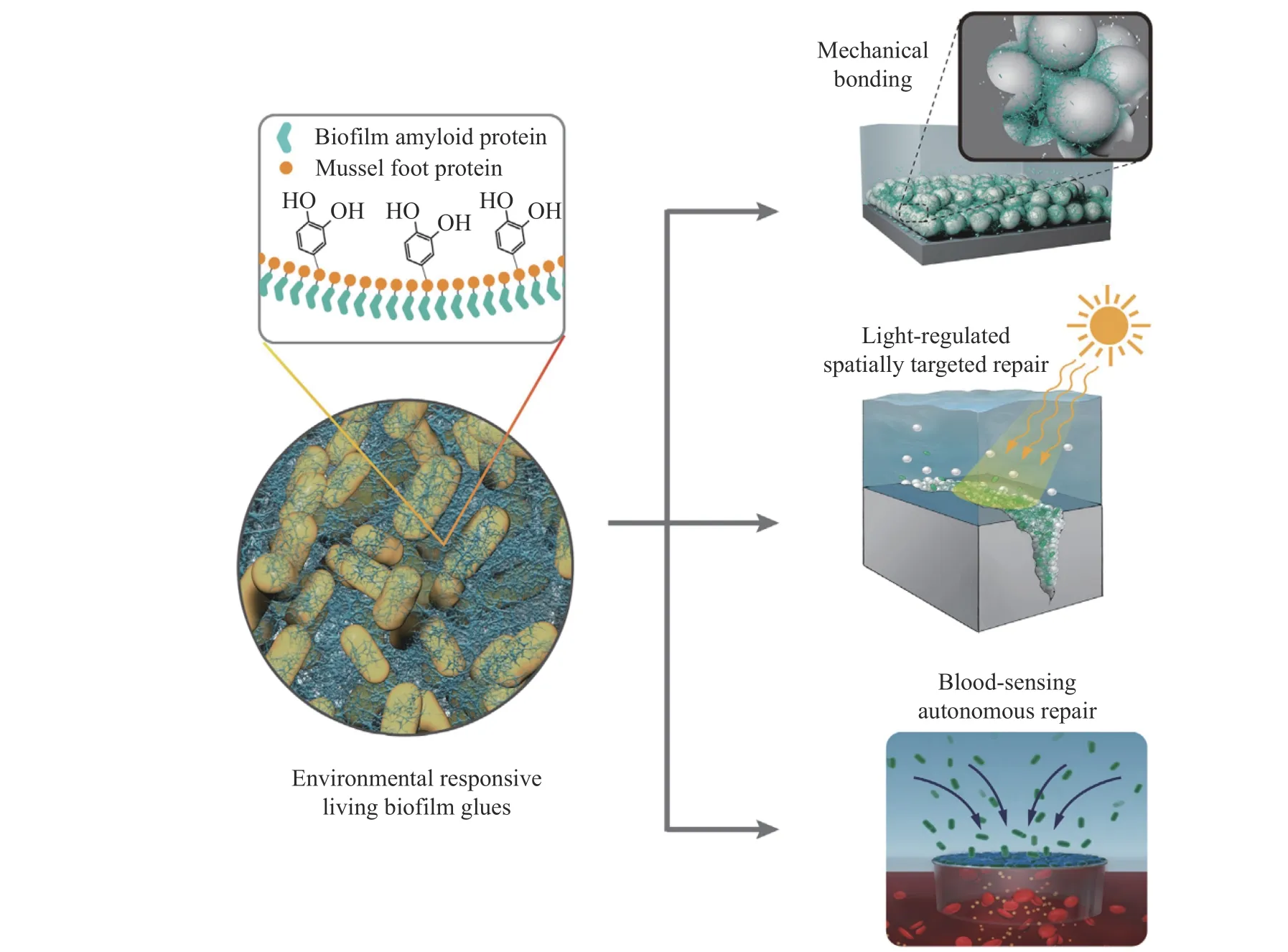
图3 工程化活细菌生物膜胶黏剂的环境响应和自主修复[46]Fig.3 Environmental response and self-repair of engineered live bacterial biofilm adhesives[46]
最近,乳酸杆菌提取物被证明能够促进干细胞迁移、干细胞标志物的表达、成骨分化和增殖,并能促进小鼠的创面愈合[47]。通过编码CXCL12的质粒进行基因改造的乳酸菌将CXCL12细菌局部注射到小鼠伤口,其作为活性药物工厂能促进真皮细胞和巨噬细胞的增殖,并通过产生趋化因子提高了巨噬细胞中转化生长因子β(TGF-β)水平的表达,在高血糖或周围缺血、慢性伤口相关疾病以及人类皮肤创伤模型中促进伤口闭合[48]。值得注意的是,用于伤口治疗的细菌多是益生菌。初步的安全性研究表明,局部应用基因工程改造细菌,使之只对伤口产生影响,在全身循环系统中检测不到细菌及其产生的趋化因子[48]。虽然目前活体胶水尚未应用于医疗领域,但随着近年来基因编辑技术的广泛应用,在不久的将来,能够产生黏性物质的细菌或基因工程改造的细菌有望作为多功能药用活体胶水用在慢性伤口等难愈合伤口的治疗中,这将成为医用胶黏剂领域的研究热点。
1.2 化学仿生胶黏剂
1.2.1 多酚类胶黏剂 本节将着重介绍含有酪氨酸基(含单酚羟基)[16,17]、贻贝仿生(含邻苯二酚)[18-26]和单宁仿生(含邻苯三酚)[27-29]的仿生医用胶黏剂的开发。
(1)仿生酪氨酸基胶黏剂:在蜻蜓翅树脂蛋白、蚕丝蛋白、蝗虫角质层等昆虫结构蛋白中,酪氨酸残基之间可以通过光氧化反应自发地发生交联[16,17,49],从而赋予蛋白质一定的结构稳定性和弹性。Jeon等[50]报道了一种富含酪氨酸基、可见光交联的仿生医用胶黏剂。在体内、外研究中,该胶黏剂表现出优异的湿态组织黏附性和良好的生物相容性。此外,使用可见光激活交联能实现可控、安全、快速的伤口封闭和愈合。Kim等[49]通过酪氨酸交联透明质酸(HA)和明胶制备了一种基于新型重组酪氨酸酶介导交联的胶黏剂水凝胶。该胶黏剂可在1 min内完全凝胶化,明显提升了胶黏剂水凝胶的物理性能和黏附性能。该水凝胶胶黏剂可注射或喷涂在组织工程和再生医学中,具有强大的应用潜力(图4)。
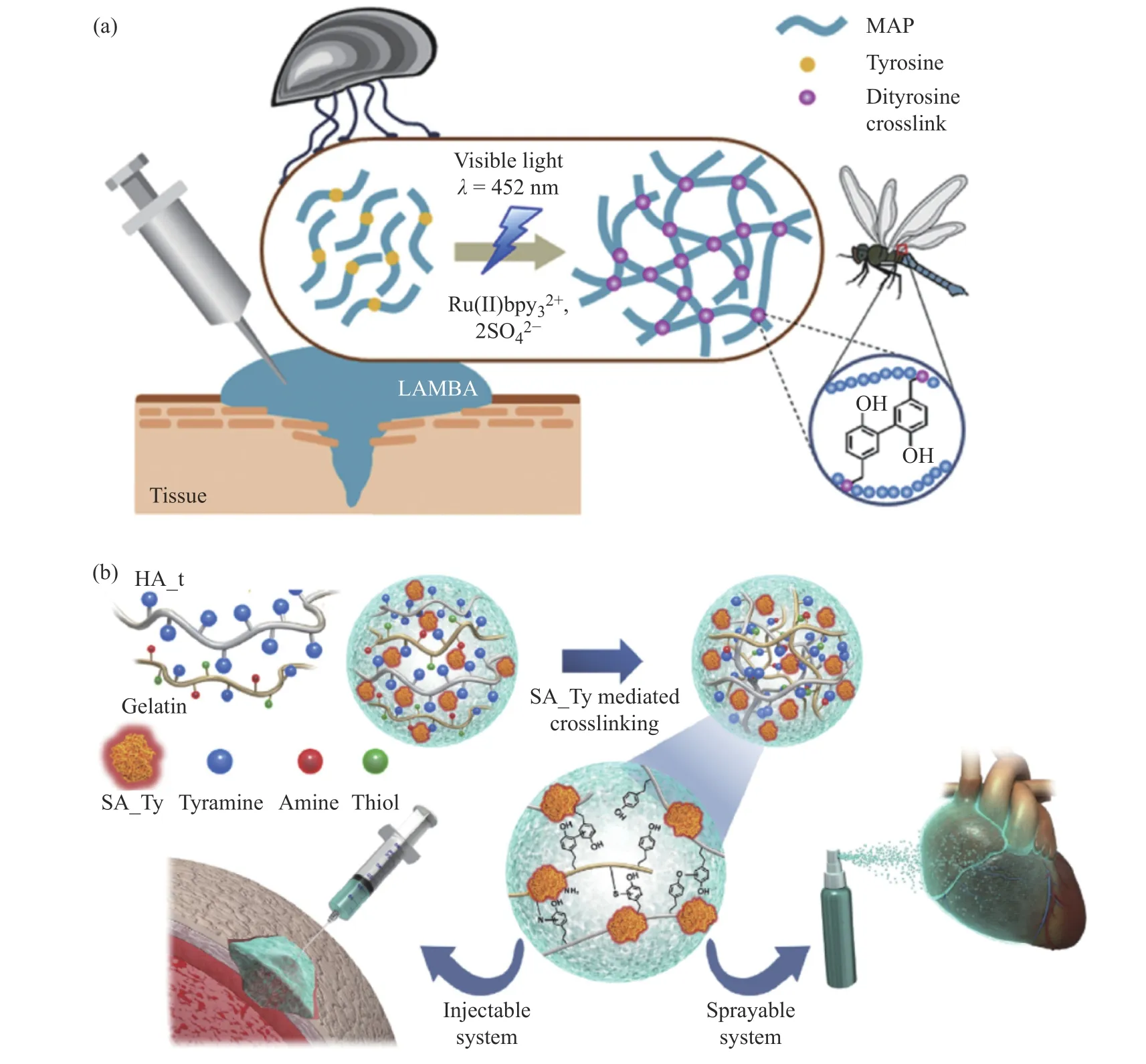
图4 酪氨酸基胶黏剂的合成与应用示例[49,50]Fig.4 Synthesis and representative application of tyrosine based adhesives[49,50]
(2)贻贝仿生胶黏剂:贻贝是一种广泛分布于沿海和近海区域的甲壳类海洋生物,在湿态环境或水下可在各种材料表面产生强力黏附,这是因为贻贝的足丝腺能够分泌大量的富含L-3,4-二羟基苯丙氨酸(L-DOPA,多巴)和赖氨酸(L-Lysine)的足丝蛋白(MAP),使贻贝通过“黏附盘”在水下牢固地黏附在各种材料表面(图5)[51-54]。L-DOPA 是一种含有儿茶酚(邻苯二酚)基团的特殊氨基酸,可以通过与有机或无机表面形成共价键或氢键、金属-儿茶酚复合物等非共价相互作用产生强力黏附[55]。在海水的碱性条件和氧化物存在下,儿茶酚基团能被氧化成苯醌,然后通过偶联反应形成交联网络,并同时与生物组织表面的―NH2、―SH、―OH和―COOH等官能团发生化学反应,通过化学锚定对生物组织产生强力黏附[22,24-26]。未氧化的邻苯二酚基团和海水中的多价阳离子之间的金属螯合作用也能提高黏附强度。在海洋中,贻贝需要借助带正电的赖氨酸残基驱赶岩石表面的水合阳离子,才能使多巴接近岩石表面,阳离子和儿茶酚基团协同能够提高黏附强度[56]。阳离子-π相互作用、氢键和范德华力等也是足丝蛋白强内聚力的重要来源。Xu等[57]研究表明,贻贝足丝角质层上Fe3+和Fe2+浓度沿着厚度方向呈现梯度分布。富含Fe3+的表层更加坚硬,可减少离子内渗,保护内部Fe2+与儿茶酚形成复合结构,增强抗拉能力,这对制备具有高强度、高韧性的生物黏合剂具有重要意义。
受贻贝黏附机理启发,科研工作者开发了一系列含多巴或其衍生物多巴胺等的贻贝仿生高分子胶黏剂。Barrett等[23]将多巴胺(DA)引入枝化的聚乙二醇-聚丙二醇(PEG-PPG)温敏共聚物的末端,开发了负溶胀的温敏胶黏剂。Liu等[59]开发了一种由多巴胺修饰的多臂聚乙二醇(PEG-D)和片状无机纳米粒子(锂藻土)组成的可二次成型的贻贝仿生水凝胶黏合剂。这种水凝胶固化初期显示出良好的拉伸性,同时保持了可塑性和黏合性,更容易停留在缝合区域从而实现有效密封,有望在临床上作为肠吻合术的辅助黏合剂。Cui等[20]开发了含疏水内核和多巴胺末端的超支化聚合物,该聚合物与水接触后会迅速发生相分离形成凝聚体,在各种环境中对各种材料产生较强黏附。Guo和Mehdizadeh等[24-26]将多巴胺引入柠檬酸基聚合物,通过简单的“一锅法”聚合反应开发了一系列受贻贝启发的柠檬酸基胶黏剂(iCMBA,图6),引入抗细菌和真菌的性能,用于软组织伤口黏合和硬组织修复,并发现生物相容性良好且有促成骨活性的氧化镁(MgO)颗粒也能交联iCMBA[60],拓展了氧化剂的选择范围。Ryu等[61]将壳聚糖和多巴胺共价接枝,然后通过与含巯基末端的聚醚F127(聚乙二醇-聚丙二醇-聚乙二醇(PEG-PPG-PEG)三嵌段共聚物)交联,制备出一种具有温敏性的胶黏剂。该温敏性胶黏剂在室温下呈现溶胶状态,在体温下能立即转变为凝胶状态,可作为单组分胶黏剂用于创面修复[62]。Zhao等[63]将邻苯二酚-Fe3+配位交联的聚(癸二酸甘油酯)-co-聚乙二醇-g-邻苯二酚(PEGSD)和四重氢键交联的脲基嘧啶酮改性明胶(GTU)结合,开发了一种生理条件下的可注射双网络自修复型水凝胶黏合剂,用于治疗耐药菌感染和全层皮肤切口/缺损修复。Han等[64]设计了一种高韧性聚多巴胺-聚丙烯酰胺(PDAPAM)胶黏剂水凝胶,该胶黏剂水凝胶具有良好的细胞相容性和组织黏附性。同时,利用PDA将氧化石墨烯(GO)部分还原为导电石墨烯,设计了一种导电、可拉伸、自黏附和自修复的胶黏剂水凝胶[65]。
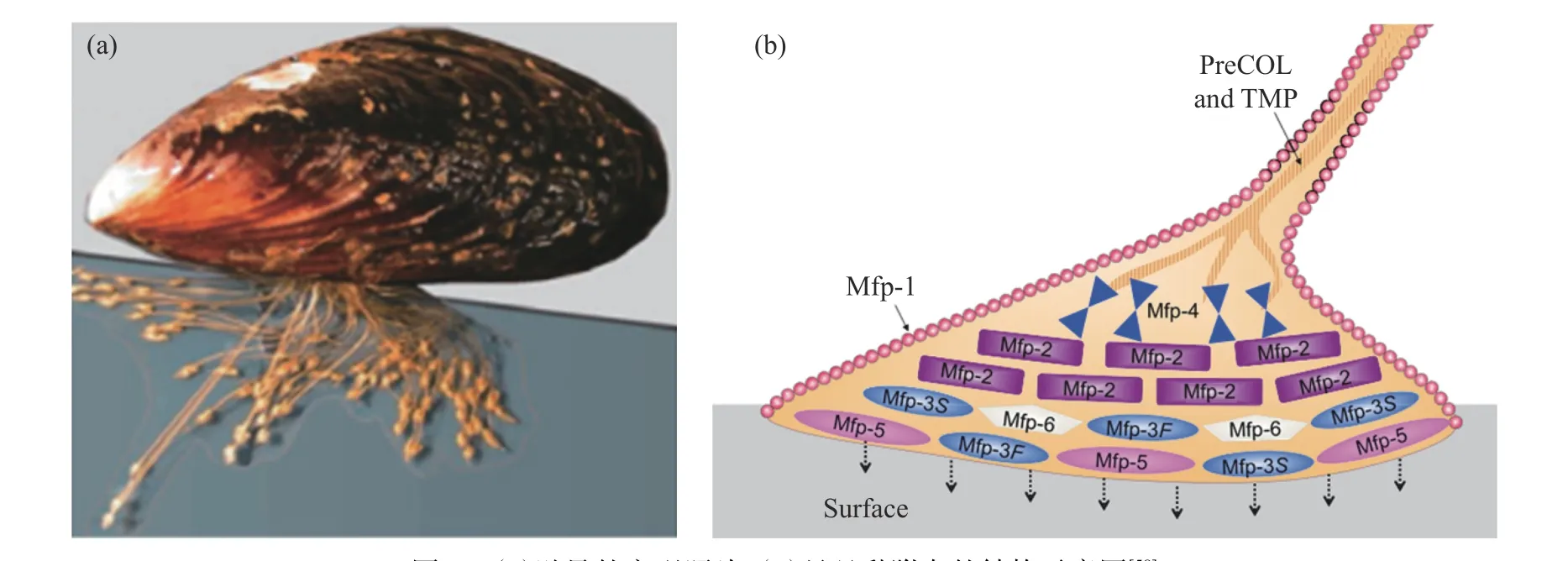
图5 (a)贻贝的宏观照片;(b)足丝黏附盘的结构示意图[58]Fig.5 (a) Photograph of mussel; (b) Schematic representation of the distribution of known proteins in the byssal plaque and distal thread[58]
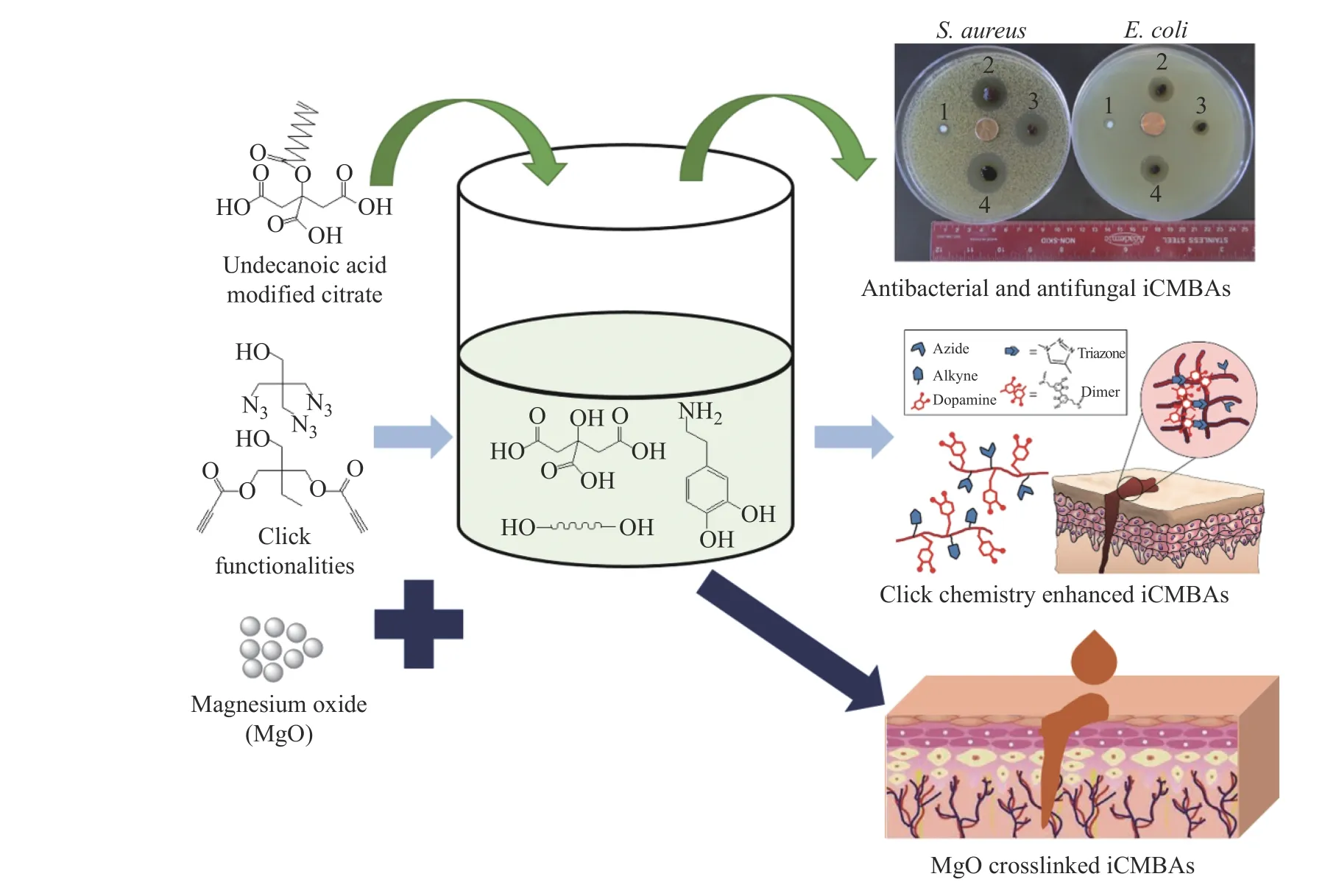
图6 受贻贝启发的柠檬酸基胶黏剂的开发[25, 26, 60]Fig.6 Development of citrate-based mussel inspired adhesives[25, 26, 60]
(3)天然植物多酚胶黏剂:天然植物多酚(plant polyphenol)是一类广泛存在于茶叶和水果中的具有多酚结构的聚合物[27,66,67],其中大多含有邻苯三酚基团(图7),具有很强的生物活性,并具有抗氧化、抗肿瘤、抗菌和止血等功能[68-72]。因此,植物多酚在仿生学、材料学和生物医学等领域应用较为广泛,大量用于黏合剂、化妆品、药品和食品等的生产和研究中。

图7 天然植物和饮料中各种多酚的化学结构[66]Fig.7 Chemical structure of various polyphenols in natural plants and drinks[66]
Gan等[73]受植物多酚黏附策略的启发,基于银(Ag)-木质素纳米粒子触发动态氧化还原儿茶酚化学,开发出具有优异力学性能、抗菌性能的胶黏剂。该氧化还原系统能循环产生儿茶酚基团,赋予胶黏剂长期和可重复的黏附能力。Ag-木质素纳米粒子可以产生自由基引发单体聚合,并可维持胶黏剂水凝胶网络中的醌基-儿茶酚基团的氧化还原平衡。胶黏剂水凝胶网络中存在的共价和非共价相互作用也赋予了胶黏剂高韧性。Zhao等[74]通过聚乙烯吡咯烷酮(PVP)中的叔酰胺基团和没食子酸(GA)中的羟基之间的氢键连接,制备了一种可自愈、可注射、可拉伸、自黏、生物相容性和导电性良好的PVP/GA复合水凝胶。PVP/GA复合水凝胶具有良好的损伤后自愈性能,且具有良好的延展性,并能附着在人体皮肤上,可根据阻力信号精确检测人体生理活动信号,可应用于电子皮肤、可穿戴生物传感器和人体运动监测设备。Ramírez-Barrón等[75]用没食子酸对明胶进行功能化,进而与有机硅聚合物形成交联网络,从而获得高效的生物黏附材料。Guo等[27]通过简便高效、易于量产的一步反应合成了单宁酸改性的明胶,然后与硝酸银(AgNO3)反应,使其原位还原为银纳米颗粒(Ag NP),得到了抗菌的医用胶黏剂。利用天然胶黏剂单宁的强黏附性能,Guo等[76]通过一步反应制备了单宁或单宁和银纳米颗粒涂覆的羟基磷灰石(THA或Ag-THA),并利用锚定在羟基磷灰石表面单宁的酚羟基与柠檬酸基聚合物中的羧基发生化学反应,将有机相和无机相桥连起来,改善了两相相容性,使复合物的压缩强度从低于220 MPa提高到大于320 MPa,超过了人体皮质骨的强度。单宁的引入还能促进细胞黏附和生物矿化,并带来抗菌性能,有望用于开发新型多功能骨科材料。Fan等[77]利用多酚超分子化学,通过一锅法制备得到的聚二甲基二烯丙基氯化铵/单宁酸(PDDA/TA)水凝胶可同时提高水凝胶体系的内聚力和黏附强度(图8(a))。Ke等[78]以丝素蛋白(SF)和单宁酸(TA)为基础构建的水凝胶胶黏剂在水凝胶形成过程中能原位生成银纳米粒子,以提高其抗菌能力,可用于组织/伤口愈合,对于缩短手术时间、减少治疗的细菌感染和防止体液泄漏等具有重要意义(图8(b))。
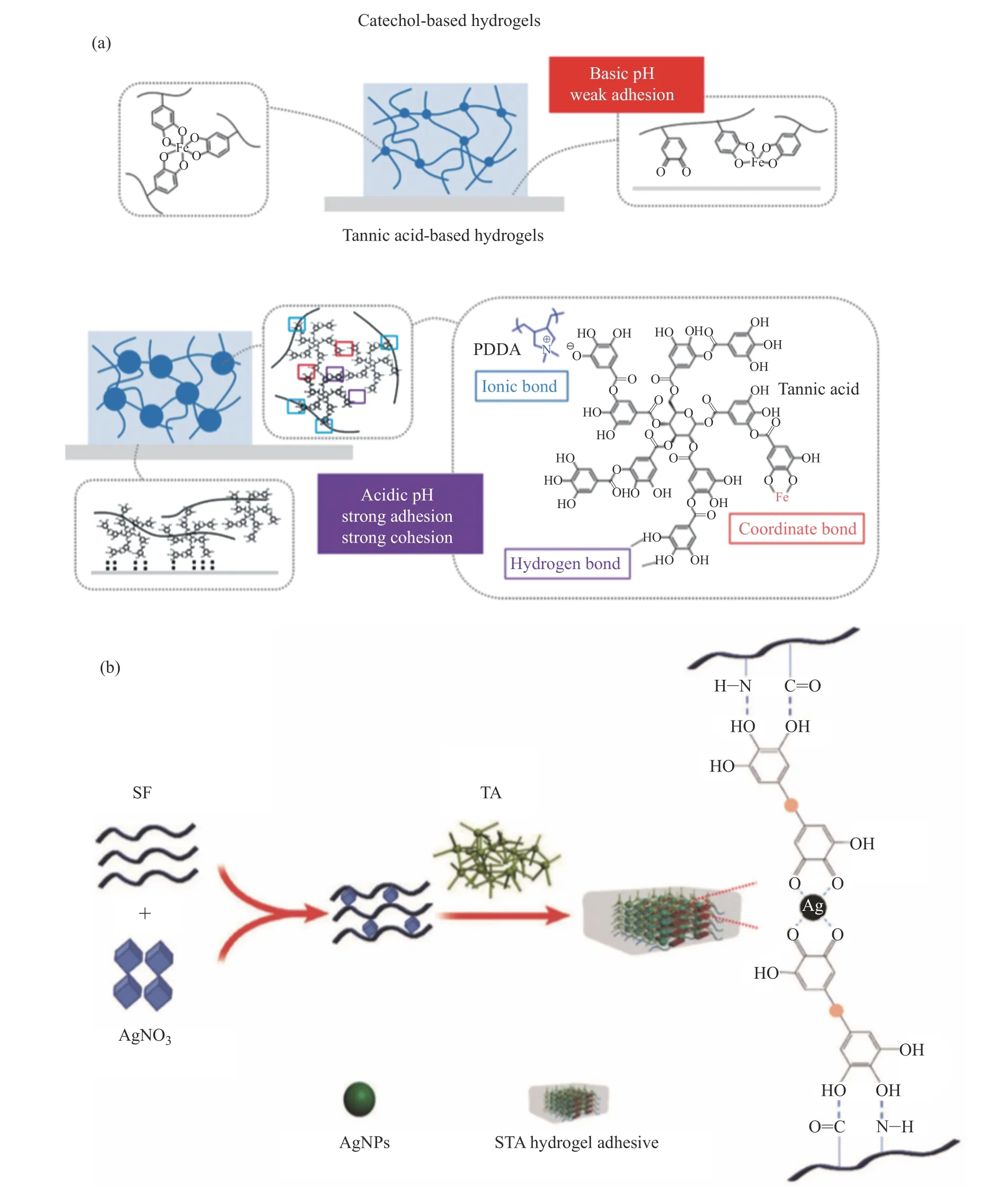
图8 TA基胶黏剂的合成[77,78]Fig.8 Synthesis of TA based adhesives[77,78]
1.2.2 沙堡蠕虫仿生胶黏剂 沙堡蠕虫(Phragmatopoma Californica)生活在北美西海岸,通过自身分泌的黏性物质将沙粒和贝壳碎片等黏在一起建造沙堡居住(图9(a)),其分泌腺的每个分泌细胞都有成百上千个黏合剂颗粒,能产生“均质”或“异质”分泌颗粒,可按需递送。沙堡蠕虫分泌出的生物黏附胶水除了有适量的DOPA存在,还包含6种不同类型的黏附蛋白(阳离子和阴离子型蛋白质)、硫酸多糖和镁离子(图9(c))。其中,阳离子型蛋白包括Pc1、Pc2、Pc4和Pc5;阴离子型蛋白质包括Pc3A和Pc3B[79]。沙堡蠕虫分泌的黏附剂在水下与这些颗粒混合,约30 s发生初始固化,依靠海水和分泌系统的pH差异使得Mg2+与Pc3之间的键强发生改变,又利用磷酸盐增强固化,Ca2+、Zn2+、Fe3+等通过与DOPA配位螯合促进固化,将分泌颗粒固定。初始固化后的几小时之后发生二次固化,其中DOPA可以利用氢键、阳离子-π相互作用、π-π相互作用等与目标表面和胶水内部形成非共价相互作用,从而增强胶水的内聚力,胶水的颜色逐渐从灰白色转变成褐色,黏附剂最终固化形成多孔结构,其间充满间隙液(图9(b))[80-82]。
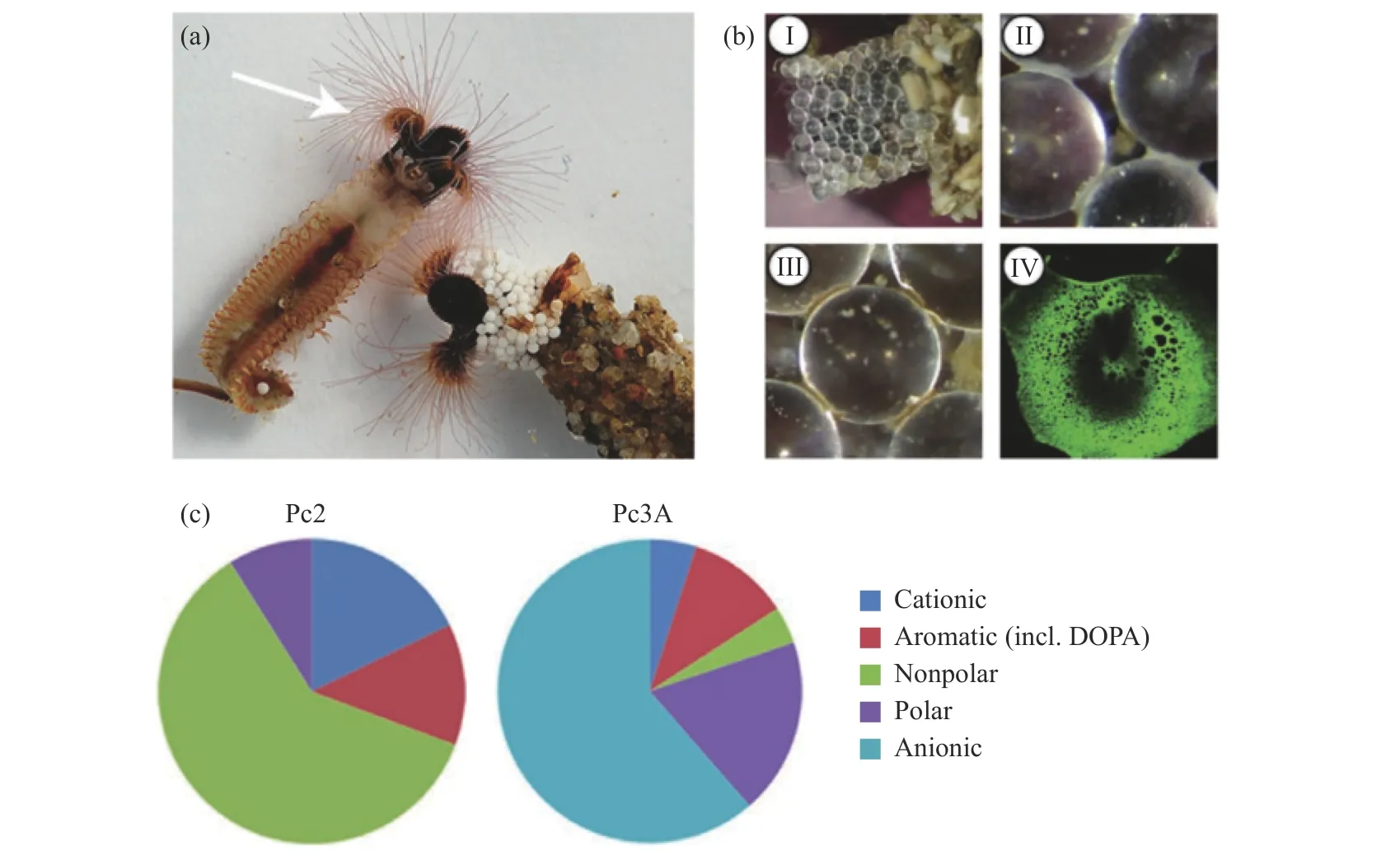
图9 (a)沙堡蠕虫的图像;(b)利用玻璃珠建造的保护壳(I)、玻璃珠之间的黏结(Ⅱ)、二次固化后变成褐色(Ⅲ)、固化后胶水的多孔结构(Ⅳ);(c)Pc2和Pc3A的化学组成[79]Fig.9 (a)Image of sandcastle worms; (b)Glass beads can also be used by the worms for building shells(I), the adhesive between glass beads(II), the initially white glue turned brownish after protein secretion(III), the final adhesive has a porous, foam-like structure(IV);(c)Chemical composites of cationic Pc2 and anionic Pc3A[79]
1.3 物理仿生胶黏剂
根据黏附机理的不同,仿生黏附材料大致可分为可逆黏附和永久黏附两大类。壁虎的可逆黏附是基于其脚趾多尺度微纳结构与接触面间的范德华力,贻贝的永久黏附则源自其分泌的黏附蛋白。本节将主要介绍受壁虎等启发的物理仿生医用胶黏剂的开发。
1.3.1 壁虎仿生胶黏剂 壁虎能牢牢黏附在各种基底表面,甚至垂直的墙壁,主要归功于其脚趾的精细结构(图10)。壁虎的每个脚趾上都有由数百个铲状匙突组成的刚毛阵列,铲状匙突和各种基底表面之间通过范德华力在亲水/疏水、粗糙/光滑的几乎任何表面上获得了大的黏附力和摩擦力[3,83]。
受壁虎脚趾黏附机理的启发,模拟壁虎刚毛表面拓扑结构的黏附表面已成为目前仿生材料的研究热点之一[84],研究者们相继开发了多种壁虎仿生医用胶黏剂。Mahdavi等[32]基于聚癸二酸甘油酯(PGSA)通过紫外光固化法制备了纳米图案化的PGSA黏附贴片,其黏附强度比无图案化的聚合物膜的黏附强度高近2倍。为了进一步提高黏附贴片对生物组织的黏附强度,Mahdavi等[32]在壁虎仿生PGSA黏附贴片上涂了一层薄薄的具有醛官能团的氧化葡聚糖以促进其与生物组织的共价交联。体内实验证明该黏附贴片排异反应小,可代替手术缝合线或铆钉用于封闭伤口。Liu等[85]设计了一种在PDMS基板上形成具有微图案结构的纤维蛋白胶和丝素蛋白黏附贴片(MSFA),即使在潮湿条件下也能牢固黏附在人的皮肤上,且可以很容易地集成到柔性电子设备中。通过对MSFA的黏附力进行微调,可以避免在设备去除过程中出现的疼痛,解决了现有医用胶黏带普遍存在的问题。MSFA的优异黏附性和可重复使用性使其成为各种流行传感器和设备应用(如脉搏、体温或化学传感器)的理想胶黏剂。Ma等[86]受壁虎启发,提出了一种新的概念,即可逆地调节湿态环境下的黏附和分离。通过聚二甲基硅氧烷(PDMS)制备出仿生壁虎黏合剂(TRGA),将PDMS电极与纳米粒子(NPs)结合,显示出良好的近红外(NIR)光热效应,进而通过NIR作用控制材料的黏附性能。
1.3.2 章鱼、吸盘鱼仿生胶黏剂 章鱼是一种通常在海底岩石或缝隙中栖息的海洋软体动物。章鱼臂上覆盖着用作肌肉液压调节的锥状吸盘,使其能够黏附在光滑、粗糙或不规则的各种表面。章鱼吸盘包括漏斗和髋臼两部分,其中漏斗作为吸盘的主要结构,可直接与材料界面接触,其表面存在大量凹槽和细齿状形态,有利于增强黏附(图11)[34,35]。漏斗边缘有一圈折叠的纤维组织,可起到密封作用。章鱼通过吸盘附着到目标物,在边缘处形成密封,然后在髋臼中引起负压从而产生附着力,附着力与目标表面的材料性质无关[87]。受章鱼吸盘黏附策略启发,研究者开发出了多种表面图案化的可逆组织黏性材料。Baik等[35]通过带丙烯酸酯侧链的聚氨酯的聚合物反应开发了一种牢固且高度可逆的胶黏剂,该胶黏剂可以轻松地附着在潮湿的粗糙表面上。Oh等[88]开发了一种模拟章鱼微结构的可贴在皮肤上的温度传感器黏附贴片。Chen等[89]开发了一种用于在PDMS基板上制造非密堆积纳米吸盘的简单且可扩展的模板技术。模板化的纳米吸盘阵列在干燥表面和潮湿表面上均显示了出色的黏附能力,可用于止血、伤口护理等。

图10 壁虎的分级结构:(a)壁虎的光学图像;(b)壁虎脚趾放大图;(c)刚毛阵列的SEM图;(d)单个刚毛的SEM图;(e)刚毛的细末分支的SEM图[3]Fig.10 Hierarchical structure of gecko: (a) Optical image of gecko; (b) Enlarged picture of gecko toe; (c) SEM image of bristle arrays; (d)SEM diagram of a single bristle; (e) SEM image of the finery branches of the bristles[3]
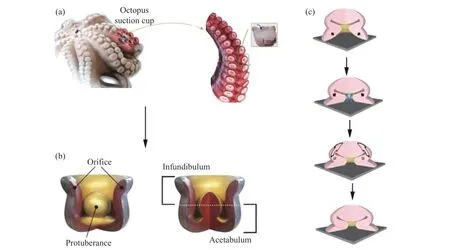
图11 (a)章鱼吸盘结构;(b)髋臼结构;(c)黏附过程[33,34]Fig.11 (a) Image of an octopus sucker; (b) Aacetabular structure of an octopus; (c) Adhesion process of octopus[33,34]
吸盘鱼又名懒汉鱼,它们依靠头上的吸盘将自己牢牢地固定在海龟、鲨鱼或船底,以宿主吃剩的残渣为生。受吸盘鱼特殊吸盘结构启发,Wang等[36]通过3D打印模拟吸盘鱼的构造,开发了吸盘鱼仿生黏附材料,用于水下航行器的开发。
1.3.3 常春藤仿生胶黏剂 常春藤(English ivy)是原生于欧洲和西亚的藤状植物,能爬升陡峭乃至垂直的表面。Huang等[37]研究表明常春藤之所以能“抓住”陡峭墙壁,并对其施加强大的黏附力,以致可以从墙体上撕下砖块并破坏建筑物外墙,是因为它能分泌球状糖蛋白纳米颗粒。这些常春藤纳米颗粒分散液由于特性黏度低(比海藻酸钠溶液、果胶等低约1个数量级),能顺利渗透到墙体缝隙中成膜,并通过钙交联进一步增强膜强度,从而使常春藤的须根与其攀爬的表面之间形成强有力的机械锁合(图12)。常春藤糖蛋白是一组由阿拉伯聚糖蛋白(arabinoglactan proteins, AGPs)组成的大分子,属于富含羟脯氨酸的糖蛋白家族[90,91]。果胶基体上的糖醛酸残基与AGPs之间的钙依赖性静电结合是胶浆有效交联(固化)的驱动力。常春藤所采取的黏附策略启示了我们改变聚合物的水分散状态从而改变其流动性能够使胶黏剂更好地浸润并渗透到所黏接的表面,为医用胶黏剂的开发提供了新思路。
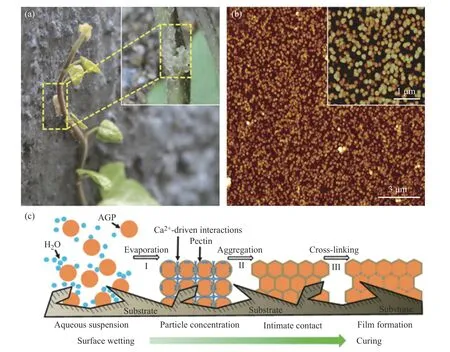
图12 (a)常春藤枝附着在墙上(黄色圈出的区域有丰富的须根);(b)常春藤纳米颗粒的AFM图;(c)常春藤纳米颗粒的交联和黏附过程[37]Fig.12 (a) Ivy shoots attached to the wall(Rich adventitious roots observed in the area circled in yellow); (b) AFM image of the purified ivy nanoparticles; (c) Crosslinking and adhesion of ivy nanoparticles[37]
1.4 蛞蝓仿生等其他仿生胶黏剂
蛞蝓是陆生腹足类软体动物,能分泌一种由电荷相互作用构成的坚韧基质和贯穿其中的阳离子蛋白组成的黏液,使蛞蝓能强力黏附在其爬行表面(图13(a))[92]。受此启发,Suo、Zhao课题组[38-40,93]开发了一类对生物组织黏附强度高(高强)、韧性好(高韧,内聚强度高)的高强韧固态胶黏剂。它们由黏附层和耗散层组成:黏附层通过电荷相互作用润湿并通过共价键化学锚定生物组织(表面带负电荷),同时足够柔软以适应组织的动态运动[38,39,93];耗散层足够坚韧,能通过形变滞后有效耗散黏附界面被拉伸时传递的能量。两者协同,使该高强韧固态胶黏剂对生物组织的湿态黏附能量高达1000 J/m2以上,为纤维蛋白胶(应用最广的医用胶黏剂)的100倍以上,远高于聚合物网络的强度极限[94]。
绒虫是生活在南半球和赤道附近温带和热带森林的灌木丛中的无脊椎动物。它们可以通过头部两侧的喷嘴状延伸处喷出一种由分散的纳米微球组成的黏液(称为黏液乳头),在喷射过程中,液体黏液转变为黏弹性黏附纤维,可以附着并捕捉猎物(图13(b))[95-97]。Baer等[98]证实这种黏附机理主要是成分蛋白上的磷酸基团介导的静电相互作用,该研究对于仿生超分子化学聚合物的制备具有一定的启发。
树蛙主要通过脚趾垫和黏附基底之间的流体进行湿式黏附,黏附力被认为是毛细作用以及与黏度有关的流体动力,但不排除范德华力的作用[99]。树蛙的黏附机制在柔软的湿润表面上提供了良好的黏附性和摩擦力。Kim等[100]报道了一种具有六角形微图案、高度排水、可重复使用的黏性皮肤贴片的设计,该图案的灵感来自于树蛙脚趾垫中的分层微通道网络和章鱼吸盘中的结构(图13(c))。用氧化石墨烯涂层之后,该贴片可用作柔性电极,即使在运动状态下也足够灵敏,可以在潮湿的皮肤上接收生物信号,从而为开发适用于内部和外部器官的体外和体内集成医疗设备建立新的策略。

图13 (a)蛞蝓照片;(b)绒虫防御时分泌的黏液;(c)树蛙脚垫的照片和其脚垫上六边形结构的SEM图像[100]Fig.13 (a) Photograph of slug; (b) Ejection of capture slime by the animal after provoking defensive behavior; (c) Photograph of pads of a tree frog and SEM images of hexagonal structures on its pads[100]
2 仿生胶黏剂的应用
2.1 软/硬组织再生修复
2.1.1 伤口黏合剂 相对于传统的手术缝合线等伤口缝合方式,医用胶黏剂使用方便,可以缩短手术时间、减少对组织的损伤、促进伤口愈合并减轻疤痕形成,提供更好的液/气密封。医用胶黏剂被广泛用于软组织伤口特别是狭长的小伤口的封闭中。纤维蛋白胶是临床应用最广的医用胶黏剂,能用于软组织伤口黏合修复,但其对生物组织的黏附强度较低[2,3]。mTG催化交联的明胶或壳聚糖也曾被用于软组织黏合,其对生物组织的黏附强度显著高于纤维蛋白胶[11,44]。大鲵皮肤分泌物制备的组织胶黏剂也展现出优于纤维蛋白胶的组织黏附能力,以及优于氰基丙烯酸酯胶黏剂的弹性和生物相容性,可促进皮肤伤口的愈合[14]。
为解决现有医用胶黏剂对生物组织黏附强度低的问题,Mehdizadeh等[26]将多巴或多巴胺引入柠檬酸基聚合物中,开发了可注射的iCMBA,其对生物组织的湿态黏附强度最高为纤维蛋白胶的8倍,能代替手术缝合线用于软组织的黏合修复。进一步地,Guo等[24]将“点击化学”引入到iCMBA中,使胶黏剂对生物组织的黏附强度提高到纤维蛋白胶的13倍,并同时显著增强了胶黏剂的内聚强度。Lu等[60]还发现氧化镁(MgO)颗粒通过与iCMBA简单的非均相混合即能得到交联,并能同步赋予胶黏剂抗菌活性。鉴于镁离子的促成骨活性,该胶黏剂既适用于软组织黏合修复又具有作为硬组织黏合剂的潜力。Peng等[101]以多巴胺和双丙烯酰胺为原料,通过Michael加成反应一步合成了一系列含儿茶酚的聚酰胺(CPAA)聚合物,并引入双性离子磺酸基甜菜碱来调节亲、疏水性,从而用作软组织伤口黏合修复。Liu等[102]通过多巴胺修饰PEG结合已经合成的纳米硅酸盐制备得到可注射纳米复合水凝胶胶黏剂。多巴胺的仿生黏附性提高了胶黏剂的力学性能和黏附性能。在大鼠皮下植入实验中,该纳米复合水凝胶胶黏剂产生的炎症反应较轻,因此可较好地用于组织修复。此外,Li等[103]在多巴胺改性聚乙二醇胶黏剂中加入一定量明胶微凝胶,缩短了凝胶时间,提高了胶凝网络的弹性模量和交联密度,显著提高了胶黏剂的黏附性能并改善了生物活性。Pandey等[104]在贻贝仿生胶黏剂中引入聚乳酸-乙醇酸(PLGA)纳米颗粒,增强了胶黏剂的黏附强度并将其用于伤口黏合。Zhao等[63]设计了一种生理条件下可注射的物理自修复水凝胶黏合剂,以治疗多药耐药细菌感染和全层皮肤切口/缺损修复。该水凝胶胶黏剂由邻苯二酚-Fe3+配位交联聚(癸二酸甘油酯)-co-聚(乙二醇)-g-邻苯二酚和多重氢键交联的脲嘧啶酮改性明胶组成,具有优异的抗氧化性、近红外/pH响应性和形状适应性。Huang等[105]利用明胶和多巴胺的低温聚合制备了一系列可生物降解的互穿聚合物网络(IPN)冻干凝胶止血材料。明胶和聚多巴胺交联组成的IPN结构使得该冻干凝胶具有良好的可注射性、较强的力学性能和形状记忆功能,能够快速止血,且具有优异的抗氧化活性和光热杀菌能力。
2.1.2 止血剂 过度失血是战争创伤、交通事故、自然灾害以及手术治疗过程中致死的主要原因,因此对于中、重度出血的快速、高效止血尤为重要。因为仿生胶黏剂都是模拟人体凝血过程的最后阶段而开发的,纤维蛋白胶及转谷氨酰胺酶催化的胶黏剂常被用作止血剂[2,3]。Cui等[20]通过季戊四醇四丙烯酸酯、短链聚乙二醇二丙烯酸酯和多巴胺盐酸盐进行三元迈克尔加成反应,制备了一种同时具有疏水骨架和亲水官能团的超支化聚合物黏合剂(HBPA)。该黏合剂遇水即黏,不仅可以实现在水下对多种基质的强黏附,并且利用模块化反应在该黏合剂体系中引入长链烷基胺还可实现对动脉血管以及深度不规则伤口的快速止血。Liu等[106]研制了一种可降解、抗菌的聚多巴胺包覆二氧化硅纳米颗粒(PDA/SiNP)用于出血控制。PDA/SiNP冻干后形成多孔网络,含有酚羟基、氨基,疏水性好,有利于细胞聚集和凝血。PDA/SiNP可激活凝血级联反应、黏附血小板和聚集红细胞从而显著促进凝血,比市售Celox体外止血剂的凝血时间缩短了近150 s。另外,PDA/SiNP在208 h后仍表现出对大肠杆菌的持久抑制作用,为二氧化硅止血剂和非金属离子抗菌剂的设计提供了新的途径。Hasani-Sadrabadi等[107]受生物膜与贻贝强力黏附机制的启发,以壳聚糖接枝甲基丙烯酸酯(CMC-MA)、多巴胺和N-羟甲基丙烯酰胺(NMA),通过简单的自由基聚合过程,制备了一种新型的双仿生黏附水凝胶(DBAH)。该水凝胶在湿润和动态的体内环境表现出优异的止血能力和抗菌活性。植物多酚如单宁等由于具有强烈的收敛性,也常被用来开发止血材料。Shim等[108]利用天然植物TA与DNA制备新型胶黏剂水凝胶(TA水凝胶)。TA通过一种新的作用方式在磷酸二酯键之间可逆连接,起到了“分子胶”的作用,从而形成可降解的DNA水凝胶,在体内表现出优异的止血能力。Ke等[78]以丝素(SF)和单宁酸与原位生成的银纳米粒子结合制备了功能化抗菌水凝胶胶黏剂。丝素单宁酸复合生物黏合剂可作为伤口敷料用于组织/伤口愈合,对于缩短手术时间、减少细菌感染和防止体液泄漏等组织/伤口愈合具有重要意义。
2.1.3 密封剂 密封剂用于提供水密性(如脑脊液(CSF))或气密性(如肺手术后)密封。医用胶黏剂常被用作密封剂,用于防止脑脊液渗漏,心脏、肺等内脏器官密封,以及血管缝合后用于防止渗漏等[2,3]。通过蛞蝓的黏附策略仿生,Li和Sun等[38,39]通过黏附层和耗散层结合的策略开发了一系列高强、高韧的固态胶黏剂,该固态胶黏剂被用作黏附贴片黏附在有渗漏的离体猪心脏上以防止液体渗漏,其破裂压力(burst pressure)接近400 mmHg(1 mmHg≈133.3 Pa)。Yuk等[40]开发了由天然聚合物(明胶或壳聚糖)和接枝N-琥珀酰亚胺酯的聚丙烯酸组成的干燥双面胶胶黏剂(DST)。干燥的DST通过吸水作用能快速去除生物组织表面的界面水,从而与表面通过氢键产生初黏力,并通过与组织表面的胺基发生共价交联进一步提高DST的黏附稳定性和强度。体外小鼠、大鼠和猪离体模型实验表明,DST可在5 s内实现多种湿动态组织与工程固体的强黏附,可用作组织黏合剂和密封剂,以及将可穿戴和可植入装置黏附到湿组织上。尿路瘘管是泌尿系统的异常开口,是一种严重的并发症,传统的治疗方法并不令人满意,液体组织黏合剂或密封剂能用来更有效和无创性地修复瘘管。Kim等[109]开发了一种独特的与水不互溶的贻贝启发的蛋白基生物黏附剂(WIMBA),它具有较强的水下黏附性,能成功封闭离体尿瘘,具有良好的耐久性和适应性。
2.1.4 硬组织胶黏剂 除了用于软组织伤口黏合修复,医用胶黏剂还能用于骨和牙齿缺损的填充,用于骨折特别是粉碎性骨折的内固定以及连接软组织和硬组织。与传统的内固定装置相比,骨胶黏剂在治疗骨损伤方面具有显著优势,包括粉碎性骨折的更好固定和分散性骨折碎片的空间位置保持。骨胶黏剂的设计除了具有黏接性能外,还具有生物降解性、生物相容性和多种功能性。受沙堡蠕虫启发,Kirillova等[30]制备了一种以磷酸钙和磷酸丝氨酸为原料的新型骨胶黏剂,这种骨胶黏剂在潮湿环境中几分钟即可固化,具有较高的骨黏接强度。在该骨胶黏剂中添加7%(质量分数)的PLGA颗粒黏接强度最好。Winslow等[110]以沙堡蠕虫分泌的天然黏合剂为模型,合成了聚合物基医用胶黏剂并用于大鼠颅骨修复。该沙堡蠕虫仿生医用胶黏剂体内、外生物相容性良好,可促进成骨细胞的黏附和迁移,在颅骨重建方面具有一定潜力。Xie等[4]将贻贝启发的柠檬酸基生物胶黏剂与羟基磷灰石复合,开发了骨胶黏剂,其展现出较强的骨黏附能力,能促进兔粉碎性骨折的黏合修复。Bai等[111]利用单宁酸与丝素蛋白和羟基磷灰石进行自发共组装,制备了一种耐水和诱导骨再生的有机/无机骨胶黏剂,在体内显示出良好的骨再生效果。
2.1.5 慢性伤口修复 相对于常规的伤口敷料,免缝合的医用胶黏剂得益于其湿态黏附性能在糖尿病足等慢性伤口的再生修复领域更具有应用前景,但需要在胶黏剂中引入抗菌、抑炎、促再生等功能性。通过含儿茶酚末端的四臂聚乙二醇与硝酸银发生交联反应,同时原位生成的银纳米颗粒,Fullenkamp等[112]制备了负载银纳米颗粒的胶黏剂,其能在PBS溶液中持续释放银离子至少2周,可以抑制细菌的生长,但对哺乳动物细胞的存活率没有显著影响。通过引入抗真菌的十一烯酸及银纳米颗粒等,Guo、Lu等[24,25, 27, 60]先后开发了一系列贻贝及单宁启发的抗菌胶黏剂,展现了良好的慢性伤口再生修复前景。Wang等[113]针对糖尿病创面易感染、难以血管化及愈合等问题,构建了一种基于天然聚(ε-聚赖氨酸)和外泌体生物活性颗粒组成的水凝胶胶黏剂,该胶黏剂具有抗菌、自修复、可注射、创面黏附特性,长期智能响应控释外泌体并维持其生物活性,高效实现抗感染,促进内皮细胞增殖迁移、血管形成,可加快糖尿病创面的血管化、胶原沉积和重塑、创面的再上皮化,从而促进慢性创面的快速愈合。外泌体的引入还能增强皮肤附属器如毛囊的再生[114],最终实现皮肤组织再生。
2.1.6 其他组织再生修复 传统的黏多糖基水凝胶的力学性能差,无法满足软骨再生的力学要求,且细胞亲和性有限,不易固定细胞。针对这些问题,Han等[115]通过在多巴胺聚合过程中加入硫酸软骨素(CS),形成PDA-CS 复合物,并将 PDA-CS 复合物分散在弹性高分子网络中,交联形成具有合适的力学性能、细胞黏附性和诱导软骨再生功能的水凝胶PDA-CS-PAM,其中 PDA 和 CS 协同创造无生长因子诱导软骨再生的微环境,解决了黏多糖力学性能差、缺少细胞黏附性的问题,是软骨修复新型水凝胶的一大进步。
心肌梗死(MI)是冠状动脉发生病变,使得动脉内的血流急剧减少或中断,继而出现严重而持久的心肌急性缺血,最终导致心肌缺血性坏死。梗死后的心肌再生能力差,各种临床治疗手段效果都不尽理想。近年来,随着再生医学的发展,可注射水凝胶和心脏贴片这2种不同的策略被广泛应用于重建梗死后的心肌功能。Liang等[116]设计出一种在体内动态潮湿环境下具有优异黏附性的免缝合导电水凝胶贴片,它能够方便、快速地涂抹于心肌,成功探索出修复梗死心肌的新途径:首先将多巴胺和吡咯基团引入超支化聚合物,然后再用Fe3+作为多功能引发剂,使超支化结构中的吡咯和多巴胺基团同时发生聚合,从而赋予凝胶优异的导电性和湿态黏附性,获得一种免缝合的可涂抹型导电贴片。
针对心血管支架在长期植入过程中会出现再狭窄和晚期血栓的一个重要临床医学问题,Yang等[117]通过贻贝仿生设计合成出具有儿茶酚侧基和叠氮端基的多肽模拟物,巧妙地将贻贝足蛋白分子的广谱黏附机制和生物正交点击化学(bioorthogonal click chemistry)的特异性分子修饰相结合,并用于心血管类支架材料的表面改性。通过快速促进内膜再生修复,有望显著降低或解决临床血管支架在应用中面临的支架内再狭窄和晚期血栓等并发症的发生。Yang等[118]还自主开发了“金属-酚-(胺)”表面涂层技术,通过逐步修饰策略,实现了血管支架表面基于NO和肝素协同修饰的内皮功能仿生设计。基于“金属-酚-(胺)”表面涂层改性技术在血管支架表面构建的Cu(II)-DA/HD纳米涂层,不仅赋予血管支架长期、持续、稳定及可控NO催化释放能力,且表面引入的丰富反应性基团氨基实现了高密度的肝素共价固定,固定的肝素保持了高度的生物活性。通过优化NO和肝素的修饰计量,实现了血管支架内皮功能仿生的最优化设计。该技术构建的内皮功能仿生涂层应用于支架表面改性,赋予了支架优异的抗血栓、调控炎症、促进内皮再生和抑制支架再狭窄的能力,为发展具有病灶治愈和血管组织修复功能的新一代血管支架提供了极其宝贵的思路并奠定了坚实的基础。
2.2 胶黏剂药物载体
手术缝合或器械固定的标准选择可能不适合位于主要神经和血管周围的以及脆弱、形状易于改变或活动的器官或组织。近年来,越来越多的研究者利用胶黏剂将组织再生修复与药物治疗结合起来,开发了一系列具有药物治疗功能的组织胶黏剂(therapeutic tissue adhesive),并将其用于肿瘤切除术后的组织再生和防止复发转移等。有节奏的(即低剂量和长期的)光动力疗法(mPDT)用于治疗内部病变,需要将光学器件稳定地固定在内部组织表面,以实现连续的局部光传输。Yamagishi等[6]开发了一种由基于近场通信的发光二极管芯片和生物黏附、可伸缩的聚多巴胺改性聚二甲基硅氧烷纳米片组成的可植入无线驱动的mPDT装置,该装置可以稳定地固定在动物组织的内表面上。用该装置以传统PDT方法约1/1000的强度照射移植到小鼠皮下的肿瘤组织10 d,能产生显著的肿瘤抑制作用。该策略可能有助于治疗难以检测的微小肿瘤和深部病变。Jeong等[7]开发了负载阿霉素(DOX)的生物工程贻贝黏附蛋白(MAP)纳米颗粒(MAP@DOX NPs),并将其喷涂到肿瘤组织部位用于局部肿瘤治疗。MAP@DOX NPs能高效地被癌细胞摄取,经溶酶体运输,随后在低pH微环境诱导下释放DOX。局部喷洒的MAP@DOX NPs在体内对肿瘤生长有明显的抑制作用,是肿瘤辅助治疗中很有前景的局部给药方法。Chen等[5]利用纤维蛋白胶开发了一种用于肿瘤切除后的原位免疫治疗的水凝胶。负载抗CD47抗体的碳酸钙纳米颗粒被包裹在纤维蛋白胶中并在肿瘤组织酸性微环境刺激下释放抗CD47抗体,阻断癌细胞中的“不要吃我”信号,从而增加巨噬细胞对癌细胞的吞噬作用。巨噬细胞可以促进有效的抗原递送,并启动控制肿瘤生长的T细胞介导的免疫反应。免疫治疗纤维蛋白凝胶能“唤醒”宿主固有的以及适应性的免疫系统,以抑制术后局部肿瘤复发和潜在的转移扩散。Zhou等[119]将单分散的聚多巴胺功能化生物活性玻璃纳米粒子(BGN@PDA)分散至聚乙二醇-聚丙二醇-聚乙二醇(PEG-PPG-PEG,F127)和ε-聚赖氨酸组成的多功能抗菌水凝胶中制得了纳米复合水凝胶。纳米复合水凝胶具有良好的自修复和可注射性,在体外和体内对耐药细菌等展现出强大的抗菌活性。纳米复合水凝胶还具有良好的光热性能(近红外激光照射),在皮下肿瘤模型中可以有效地杀死肿瘤细胞(效率超过90%),抑制肿瘤生长(抑制率高达94%)。此外,纳米复合水凝胶能有效促进体内伤口愈合。这些结果表明基于BGN的纳米复合水凝胶在皮肤肿瘤治疗、伤口愈合和抗感染方面很有潜力。
2.3 医用胶黏剂在医疗美容中的应用初探
相对于手术缝合线等传统伤口闭合方式,利用生物医用胶黏剂黏合伤口可减少疤痕生成[2,3, 26,101]。为了将医用胶黏剂更好地应用在医疗美容领域,必须进一步强化其防止疤痕形成的功能。局部硅胶(硅酮)贴片治疗似乎仍是临床推荐的疤痕治疗一线疗法,尤其是针对已形成的疤痕[120]。硅胶贴片能提供更好的伤口封闭并起到保水作用,帮助新形成的、发育不全的角质层保持最佳水含量。如果角质层脱水,它会向表皮层中的角质形成细胞发出信号,产生细胞因子,而细胞因子又会指示成纤维细胞产生过量的胶原蛋白,以帮助角质层的水分保持。胶原蛋白在伤口部位的过量堆积就会导致疤痕形成。用硅胶局部稳定次氯酸(HClO)被证明可以抑制疤痕生成并起到强力杀菌作用[121]。Park等[122]研究表明通过聚阳离子介导制备凝聚素,用来分阶段先后递送转化生长因子β3(TGF-β3)和白细胞介素10(IL-10)两种生长因子能够有效增加再生皮肤组织的数量和质量,而不会形成疤痕。病理生理性疤痕形成的细胞外基质异常研究表明导致愈合障碍的主要因素之一是胶原重组异常。基于decorin(一种胶原靶向蛋白多糖)在胶原重塑中的重要作用,Jeon等[123]构建了一种由贻贝黏附蛋白和特殊的糖胺聚糖组成的预防疤痕的胶原靶向胶,胶原靶向胶以剂量依赖性的方式与I型胶原特异结合,调节纤维形成的速度和程度。在大鼠皮肤切除模型中,胶原靶向胶通过有效的再上皮化、新生血管化和快速胶原合成成功地加速了初始伤口的再生,且再生的胶原纤维大小均匀,排列整齐,提高了伤口的愈合率和愈合质量,能有效抑制疤痕。在28种哺乳动物的胶原中,I型和III型胶原在皮肤组织中最丰富。Fleischmajer等[124,125]证明I型胶原是纤维构建模块,III型胶原是人类皮肤纤维形成过程中纤维直径和生长的调节器。III型胶原与肌成纤维细胞分化之间存在联系;在无疤痕胎儿伤口中,没有肌成纤维细胞时,III型胶原与I型胶原的比率更高[125]。在胶黏剂中添加III型胶原可以作为无疤痕愈合的一种手段。目前已经临床应用的皮肤替代物PriMatrix含有30%的III型胶原,在严重外伤性皮肤损伤的应用中能够实现完全再上皮化并带来最小的疤痕[125]。
蚕丝具有较低的免疫原性[126],被广泛用作生物组织工程材料。蚕丝蛋白中含有丰富的丝氨酸,基于此,Zhang等[127]人工合成了聚β-丝氨酸,其在体内能有效抵抗异物反应,保持开放的胶原蛋白结构,没有形成胶原包囊。Li等[128]在最新的研究中发现,用丝素蛋白水凝胶(SFHs)在兔子身上进行动物实验时产生的疤痕更薄,颜色更浅。SFHs处理可以降低α-平滑肌肌动蛋白的表达,降低胶原纤维密度,使胶原纤维排列更有序,首次证明丝素蛋白可以作为一种治疗增生性疤痕的有效材料。
3 结论与展望
近年来,通过从生物、化学和物理等方面模拟自然界中各种动植物的黏附策略,相继开发出多种仿生医用胶黏剂,取得了丰硕的科研成果,并有多项产品被推向临床应用。与传统的医用胶黏剂相比, 仿生医用胶黏剂的开发更具有定向性,形式多样,具有生物相容性好、组织黏附强度高、力学性能优异等优点。仿生医用胶黏剂被广泛用作黏合剂、止血剂和密封剂,用于软组织伤口闭合或硬组织损伤修复等组织再生修复领域;作为药物载体用于局部给药及用于肿瘤切除后防止复发转移等;在医疗美容领域用于抑制疤痕生成。
随着现代医学的不断发展完善,医用胶黏剂的应用场景将会日渐增多,因此对于多功能医用胶黏剂的诉求势必增加。诸如纤维蛋白胶、氰基丙烯酸酯类或聚氨酯类等传统的医用胶黏剂[2,10]基本都是针对临床应用对医用胶黏剂黏合和封闭伤口的基本诉求设计的,无法满足不同应用场景对医用胶黏剂更高的诉求。相对于手术伤口黏合和日常伤口护理这两个市场,以糖尿病足为代表的慢性伤口再生修复以及医疗美容和微整形是医用胶黏剂更庞大的潜在市场。然而,这需要胶黏剂能够具有诸如抑炎、抗菌、抑制疤痕生成等功能性。另一方面,近年来医用胶黏剂或水凝胶越来越多地被用作局部药物缓释载体用于肿瘤术后的辅助治疗,局部给药的方式能够提高药物疗效并减少抗肿瘤药的全身系统毒性,然而,如何进一步地将防止肿瘤复发转移与组织再生修复结合起来仍是巨大挑战。本文所提及的多种仿生医用胶黏剂的开发正是基于临床应用需求,并着眼于解决上述重大挑战。此外,自修复胶黏剂[19]、环境响应性胶黏剂[23,61]、可逆胶黏剂[18,129]、活体胶黏剂[12-14]等具有独特功能的医用胶黏剂应运而生。这些多功能医用胶黏剂大多处于实验阶段,但随着研究者对仿生黏合机理的深入理解以及独特新颖的设计理念的引入,它们将被逐渐投入到产业应用中。
未来新一代胶黏剂将根据不同的应用场景发展出多功能通用性医用胶黏剂或特定功能的医用胶黏剂,被用在更加宽广的应用领域。兼具生物活性和黏附基本性能两方面特征的活细菌胶黏剂毋庸置疑将是未来医用胶黏剂研究的一大热点。可以想象,结合基因工程和材料科学技术,经过基因编辑的细菌不仅能用来分泌贻贝黏附蛋白等黏附材料,还能作为具有药用功能的活性肽等的微型加工厂,用来发展具有强大黏附能力、生物活性(自我再生、具有一定环境适应性)和药物治疗功能的活体胶黏剂。另一方面,将组织再生与药物递送结合,负载抗肿瘤药物或免疫调节剂的药用组织胶黏剂(therapeutic tissue adhesive)的开发也是医用胶黏剂发展的重要方向。随着人们对组织伤口修复质量的要求进一步提高,具有预防疤痕生成或祛疤(减轻已有疤痕)的功能化胶黏剂也将是医用胶黏剂发展的重点方向,其成功开发将极大拓展医用胶黏剂在医疗美容领域的应用。

