一种慢性阻塞性肺疾病合并气管支气管软化症模型制备方法及调补肺肾方干预效果评价
余 薇,周鹏程,陈科伶,唐文君
(1. 成都中医药大学临床医学院,四川 成都 610072;2. 成都中医药大学附属医院,四川 成都 610072)
慢性阻塞性肺疾病(COPD)是一种常见的以持续呼吸道症状和气流受限为特征的可以预防和治疗的疾病,呼吸道症状和气流受限由有毒颗粒或气体导致气道和/或肺泡异常引起,是呼吸系统最常见疾病之一[1]。世界卫生组织预计该病到2020年将位于全球死亡原因第三位,世界疾病负担第五位[1]。最新的流行病学调查显示我国40岁以上人群COPD患病率高达13.7%[2],中国患者每年平均发生0.5~3.5次急性加重[3],年人均疾病经济负担高达20 107.58元,24.4%~24.8%的患者处于极高经济风险[4]。随着老年化社会的加剧以及环境污染等多种因素作用,我国COPD的防治任务十分艰巨。气管支气管软化症是因慢性炎症等因素导致气道软骨变性、坏死或膜部松弛,管壁失去支撑作用,管腔受胸内外压力改变并随着呼吸运动呈动态性狭窄的一种病理状态[5],临床表现为反复肺部感染、肺功能加速恶化和呼吸衰竭,甚至猝死,危害巨大。目前普遍认为COPD是导致气管支气管软化症的最主要危险因素之一, COPD合并气管支气管软化症的检出率高达53%~59%[6-7]。而气管支气管软化症则进一步加速COPD病情进展,因此改善或阻断气管支气管软化对于改善COPD不良事件结局及降低社会经济负担等具有重大意义。目前COPD合并气管支气管软化症发病机制不清,缺乏有效治疗药物及方法,国内外尚没有相关的模型制备方法报道,严重影响了对疾病病理机制的深入理解以及对潜在的干预方法进行评价。本课题组建立了一种COPD合并气管支气管软化症模型并评价了调补肺肾方的干预机制,现将结果报道如下。
1 实验材料与方法
1.1实验材料 大鼠气管软骨细胞(Procell CP-R087)。调补肺肾方由骨碎补15 g、桑寄生15 g、川牛膝10 g、黄芪30 g、人参15 g、熟地黄15 g、补骨脂15 g、丹参15 g、山茱萸15 g、续断15 g、浙贝母10 g、矮地茶15 g、甘草5 g组成,制备成免煎颗粒,根据人与大鼠等效剂量的折算系数换算大鼠剂量(人与大鼠的折算系数为6.3,调补肺肾方对大鼠的等效给药剂量(g/kg)=人体有效剂量(g/kg)×6.3换算而得),加入滚开水搅拌均匀,充分溶解后,冷却,冰箱冷藏备用,使用时过滤除菌,按比例(0%,1%,5%,10%,15%,20%)加入正常培养基,流式细胞分析检测 24 h 细胞凋亡率,根据实验结果筛选合适作用浓度。
1.2实验试剂与仪器 Ultrapure RNA 超纯RNA提取试剂盒(CW0581M,CWBIO 康为世纪);HiFiScript cDNA 第一链合成试剂盒(CW2569M,CWBIO 康为世纪);内参一抗:Mouse Monoclonal Anti-GAPDH(TA-08,中杉金桥,1/2 000 ) ;二抗:辣根酶标记山羊抗鼠IgG(H+L)(ZB-2305,中杉金桥,1/2 000);目的一抗:Rabbit monoclonal Anti-caveolin-1(ab32577,abcam,1/1 000~1/10 000);目的一抗:Rabbit Polyclonal Anti-p-p38(bs-0636,Bioss,1/500~1/2 000);BCA蛋白定量试剂盒(BCA Protein Assay Kit);Annexin V-FITC/PI Apoptosis Kit(AP101-100-kit,MULTI SCIENCES 联科生物);软骨染色液(甲苯胺蓝法)(8101A16,LEAGENE);CollagenⅡAntibody(AF0135,Affinity);大鼠软骨细胞完全培养基(CM-R087 Procell);p38-MAPK(HY-10256 MCE);白细胞介素-1β(IL-1β)(203014-10Genscript);CCK8试剂盒(KGA317,凯基生物);荧光PCR仪[CFX ConnectTM实时,伯乐生命医学产品(上海)有限公司];蛋白垂直电泳仪(DYY-6C,北京市六一仪器厂);超高灵敏度化学发光成像系统[Chemi DocTM XRS+,伯乐生命医学产品(上海)有限公司];NovoCyteTM流式细胞仪[艾森生物(杭州)有限公司,型号:NovoCyte 2060R]。
1.3实验方法
1.3.1香烟烟雾提取物(CSE)的制备 将 1支去过滤嘴香烟连于一个连续抽吸驱动装置点燃,抽吸5 min,以5 cmH2O(约 0.1 kPa)的负压持续吸引。吸入的烟雾经过真空容器的一个入口通入10 mL PBS液中制成悬液,悬液用1 mol/L的NaOH调制 pH至 7.4,经0.22 μm微孔滤膜过滤作为CSE原液。配制好的CSE于30 min之内用于实验。流式凋亡摸索 CSE 的处理浓度(0%,2.5%,10%,20%,30%,40%,50%),根据实验结果筛选合适作用浓度。
1.3.2分组、造模及干预 实验分为空白组、模型组、模型+调补肺肾方组。空白组以低糖DMEM和1%FBS培养。模型组、模型+调补肺肾方组以低糖DMEM和1%FBS培养基础上,参考文献[8]方法用CSE处理气管软骨细胞(Procell CP-R087)48 h构建COPD 细胞模型,COPD细胞模型构建成功后,加入白细胞介素-1β(IL-1β)10 ng/mL干预24 h建立COPD合并气管支气管软化症模型(甲苯胺蓝染色和Ⅱ型胶原免疫组化染色对模型进行鉴定),然后换培养液,模型组用正常培养基继续培养48 h,模型+调补肺肾方组用含调补肺肾方培养基继续干预 48 h。
1.3.3流式细胞凋亡检测 收集(1~3)×106个细胞,加1 mL PBS 1 500 r/min 离心,3 min,洗2遍,用双蒸水将5×Binding Buffer稀释为1×Binding Buffer,取300 μL 预冷的1×Binding Buffer 重悬细胞,每管各加入3 μL Annexin V-FITC和5 μL PI-PE,轻微混匀后,室温避光孵育10 min,再向每管中加入200 μL 预冷的1×Binding Buffer,混匀后上流式仪检测。
1.3.4甲苯胺蓝染色观察 去除孔中的培养基,然后加入PBS清洗3次,每次5 min,再加入软骨染色液,浸染15~20 min(根据细胞量的多少而定),自来水洗2 min,再吸干,加入丙酮分化至软骨细胞呈紫蓝色清楚可见,逐级乙醇脱水,封片,镜检。
1.3.5Ⅱ型胶原免疫组化染色观察 在培养板中将已爬好细胞的培养皿用PBS浸洗3次,每次3 min;用4%的多聚甲醛固定15 min,PBS浸洗培养皿3次,每次3 min;0.5%Triton X-100( PBS配制 )室温通透20 min;培养皿加入新鲜配制的3%双氧水,以去除内源性过氧化物酶封闭液,室温孵育10 min,PBS充分淋洗;PBS浸洗培养皿3次,每次5 min,移液枪吸干培养皿内的PBS,在培养皿内滴加5%BSA,37 ℃封闭30 min;用移液枪吸干培养皿内的封闭液,不洗,每个培养皿滴加足够量的稀释好的一抗;Collagen Ⅱ(1:200)放入湿盒中,4 ℃孵育过夜,取出4 ℃孵育过培养皿,室温静置45 min,PBS浸洗玻片3次,每次5 min,滴加聚合HRP标记抗兔IgG二抗工作液,37 ℃孵育30 min,PBS充分淋洗;DAB显色5~10 min,在显微镜下掌握染色程度,PBS或自来水冲洗1 min;苏木精复染3 min,盐酸酒精分化,返蓝;自来水冲洗1 min,脱水、透明、封片、镜检。
1.3.6软骨细胞中p-p38、caveolin-1表达Western blot检测 利用BCA试剂盒进行蛋白浓度测定。蛋白变性、上样、电泳1~2 h,湿法转膜30~50 min。4 ℃孵育一抗(Rabbit monoclonal Anti-caveolin-1、Rabbit Polyclonal Anti-p-p38)溶液过夜;室温孵育二抗(辣根酶标记山羊抗兔IgG)1~2 h。在膜上滴加ECL曝光液,曝光。用“Quantity one”软件分析各抗体条带灰度值。
1.3.7软骨细胞中MMP-3、caveolin-1 mRNA表达RT-PCR检测 取各组细胞进行RNA提取,提取RNA后根据反转录试剂盒合成cDNA,以cDNA为模板,在荧光定量PCR仪上进行检测,以GAPDH为内参,计算出各组的相对表达量。引物序列:MMP-3上游引物为5’-TTCCTTGGGCTGAAGATGAC-3’,下游引物为5’-GATCCTGGAGAATGTGAGTGG-3’;caveolin-1上游引物为5’-CAAATGCCACTTTGCTCAGA-3’,下游引物为5’-ACAAAGCCATTTCCCAAGTG-3’;GAPDHF上游引物为5’-GCAAGTTCAACGGCACAG-3’,下游引物为CGCCAGTAGACTCCACGAC-3’。
1.4统计学方法 数据采用SPSS 23.0软件进行统计分析。计量资料进行正态性及方差齐性,呈正态分布采用均数±标准差表示,多组比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结 果
2.1不同浓度CSE干预软骨细胞凋亡率 Annexin-V FITC/PI双染流式细胞分析显示,空白组凋亡率为8.90%,2.5%,10%,20%,30%,40%,50%浓度CSE干预后软骨细胞凋亡率分别为23.35%,83.95%,88.33%,77.25%,90.69%,85.99%,其中2.5%浓度CSE干预后气管软骨细胞凋亡率最低,因此确定2.5%CSE作为实验浓度。
2.2不同浓度调补肺肾方干预软骨细胞凋亡率 Annexin-V FITC/PI双染流式细胞分析显示,空白组凋亡率为8.34%,1%,5%,10%,15%,20%浓度调补肺肾方干预后软骨细胞凋亡率分别为10.95%,27.39%,47.61%,49.27%,66.04%,其中1%浓度调补肺肾方干预后气管软骨细胞凋亡率最低,因此调补肺肾方最佳实验浓度确定为1%。
2.3各组软骨细胞倒置显微镜下表现 空白组软骨细胞大小一致,呈多角形,胞浆丰富,胞体大,1~2个核仁清晰可见;模型组软骨细胞狭长,多为单层生长,胞内可见较多空泡形成,核仁变形,细胞形态不规则;模型+调补肺肾方组软骨细胞大小较均匀,呈椭圆形或多角形,形态较规则,胞浆多,胞体大,核仁较清晰。见图1。

图1 各组软骨细胞倒置显微镜下表现
2.4各组软骨细胞甲苯胺蓝染色表现 空白组可见软骨细胞内蓝紫色异染颗粒,细胞核呈深蓝色,细胞周围有少量浅蓝色异染颗粒,1~2个核仁清晰可见;模型组软骨细胞染色明显变浅,细胞狭长,多为单层生长,胞内可见较多空泡形成,核仁变形,细胞形态不规则,细胞明显退变;模型+调补肺肾方组软骨细胞胞质呈浅蓝色,核仁较清晰,胞内可见少许空泡,细胞形态较规则。见图2。
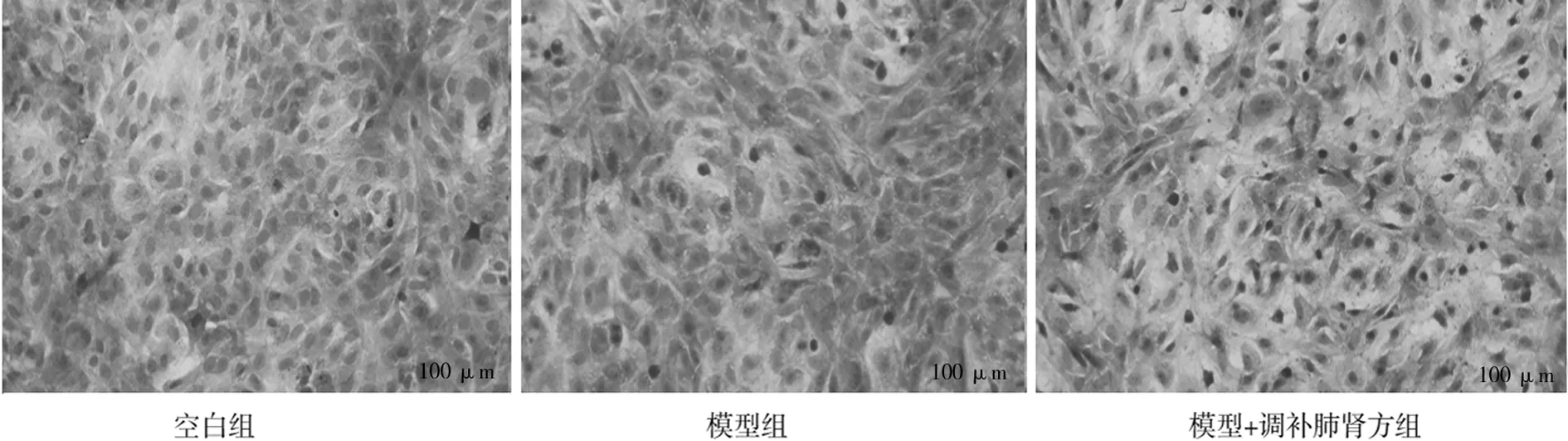
图2 各组软骨细胞甲苯胺蓝染色表现
2.5各组软骨细胞免疫组化染色表现 空白组软骨细胞胞浆被染成棕黄色,其中可见黄褐色颗粒,细胞外也可见棕黄色染色,所有的软骨细胞中均可见Ⅱ型胶原的表达;模型组Ⅱ型胶原表达明显减弱,基本为阴性;模型+调补肺肾方组Ⅱ型胶原表达减弱,在较多软骨细胞质及胞外可见。见图3。
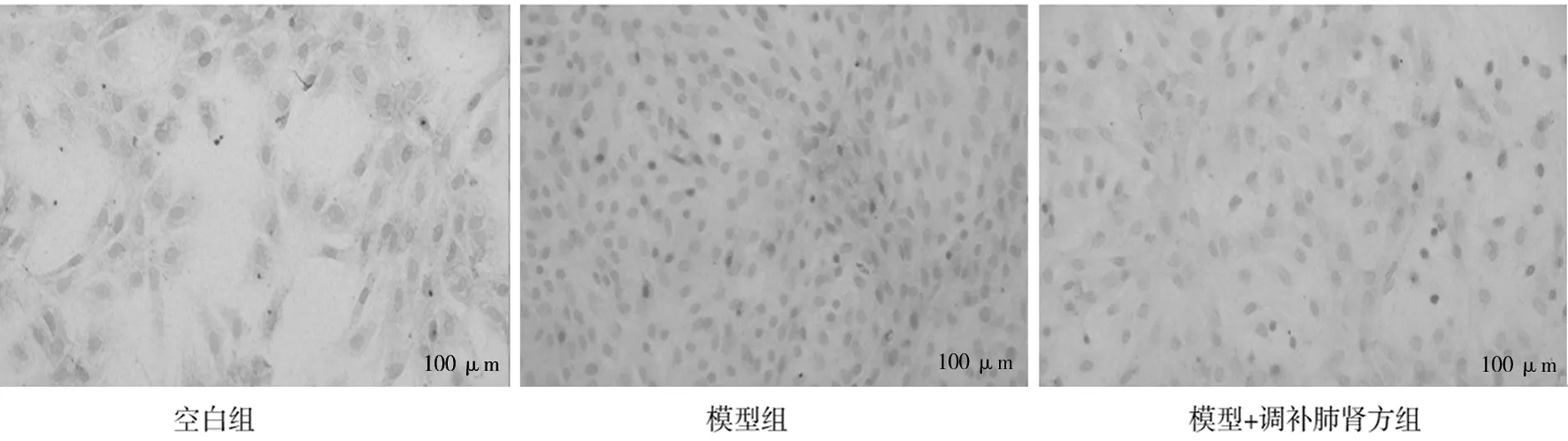
图3 各组软骨细胞免疫组化染色表现
2.6各组软骨细胞中p-p38、caveolin-1表达情况 模型组中p-p38、caveolin-1蛋白相对表达水平均明显高于空白组(P均<0.05),模型+调补肺肾方组均明显低于模型组(P均<0.05)。见图4。
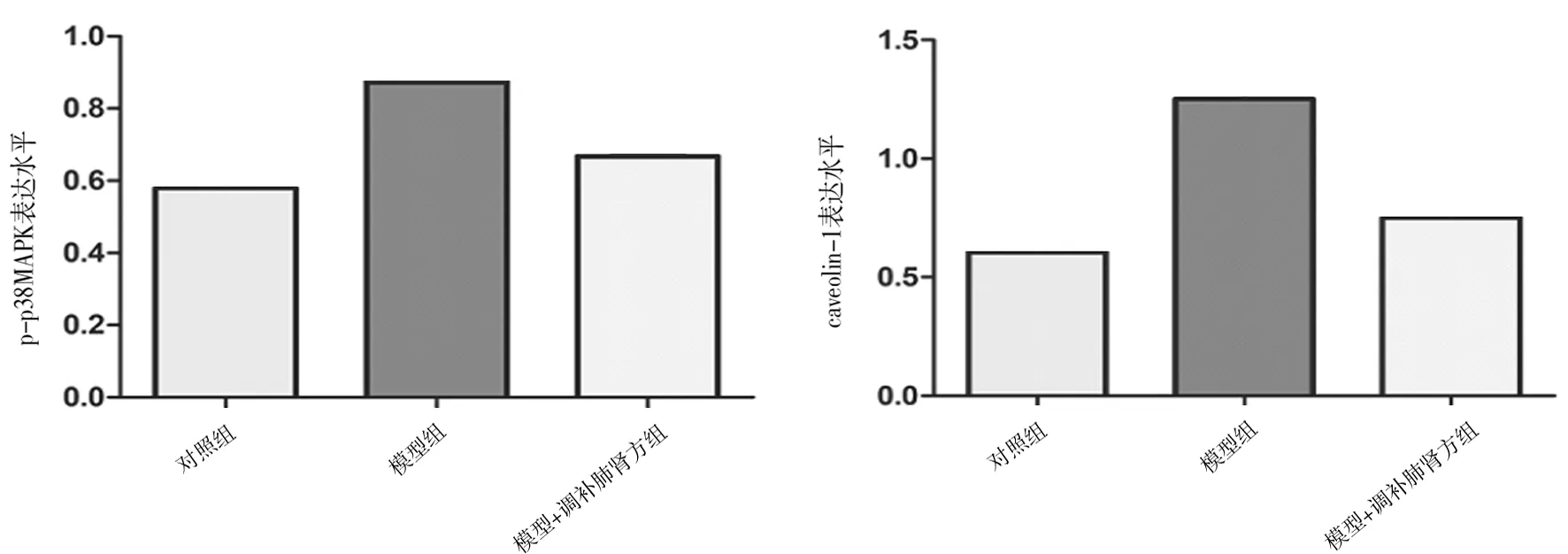
图4 各组软骨细胞中p-p38、caveolin-1表达情况
2.7各组软骨细胞中MMP-3、caveolin-1 mRNA表达情况 模型组中MMP-3、caveolin-1 mRNA相对表达水平均明显高于空白组(P均<0.05),模型+调补肺肾方组均明显低于模型组(P均<0.05)。见图5。
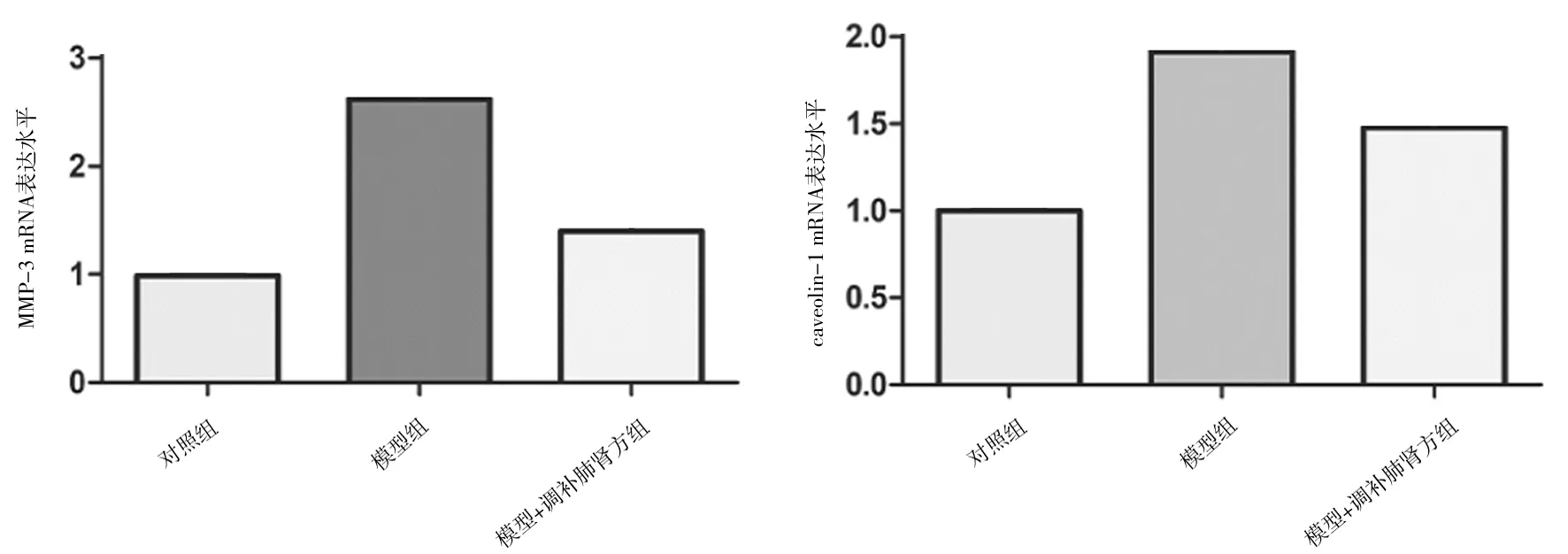
图5 各组软骨细胞中MMP-3、caveolin-1 mRNA表达情况
3 讨 论
气管支气管软化症好发于气管、左右主支气管及右肺中间段等中央气道,是儿童常见的先天性气道发育不全性疾病,而成人可见于气管插管或切开、气管外伤、气道结核、COPD、甲状腺或纵隔肿瘤、复发性多软骨炎、Mounier-Kuhn综合征等疾病[9]。目前认为COPD是气管支气管软化症最常见的危险因素之一,但其诱导气管支气管软化症的机制仍旧不明,多数学者认为与反复的慢性气道炎症、肺气肿有关[10]。Sverzellati等[11]发现气道管壁越厚软化症越重。Murgu等[12]运用超声内镜发现COPD合并气管软化症不仅软骨环存在不规则增厚,而且膜部组织明显变薄松弛。随着研究的深入,越来越多的学者认为气管支气管软骨细胞的退变是气管软化症的关键病理基础,因此进一步了解软骨细胞的退变机制对于找到有效的治疗方法或药物具有十分重要的意义。
迄今为止尚没有COPD合并气管支气管软化症的疾病模型,这对于深入了解其发病机制存在挑战。临床上并非所有的COPD会伴随气管支气管软化症的发生,为了让COPD模型出现明确的气管软骨退变,在本实验中先采用CSE处理气管软骨细胞建立COPD细胞模型,然后参考骨关节炎软骨退变模型的制备方法[13-15],加入10 ng/mL IL-1β诱导气管软骨退变,结果经甲苯胺蓝染色和免疫组化染色证实采用CSE联合 IL-1β处理气管软骨细胞能够成功制备COPD合并气管支气管软化症模型。
caveolae相关蛋白最初由日本Yamada在1955年使用电子显微镜观察小鼠胆囊上皮细胞质膜时发现,最初认为与细胞的离子转运有关[16]。目前在哺乳动物中已发现有3种caveolin蛋白,分别为caveolin-1, caveolin-2, caveolin-3,其中caveolin-1是caveolae主要的结构蛋白,现在认为该蛋白与肺气肿和骨关节炎等衰老性疾病密切相关[17]。唐跃琼等[18]发现骨关节炎患者软骨的损害程度与caveolin-1的表达呈正相关,且IL-1β呈时间依赖性地促进软骨细胞表达caveolin-1,后者又诱导p38MAPK信号通路激活,使软骨基质中II型胶原和蛋白多糖降解增多。本研究显示,模型组caveolin-1蛋白表达水平明显高于空白组,表明caveolin-1参与了COPD模型气管软骨细胞退变过程。
p38MAPK是一种分子量为38kD的酪氨酸磷酸化蛋白激酶,能被细胞外环境的改变、促炎因子等多种细胞外刺激所激活,参与细胞的生长、分化、退变、衰老及凋亡等多种生理病理过程[19]。近年来研究发现p38MAPK信号通路在关节软骨的破坏中可能处于一个枢纽地位,与软骨细胞表型的保持和分化、软骨细胞的肥大和钙化、凋亡、软骨基质金属蛋白酶的合成、软骨炎性细胞因子的产生等都有密切关系[20]。本研究显示,模型组p38MAPK蛋白表达水平明显高于空白组,表明p38MAPK参与了COPD模型气管软骨细胞退变过程。
MMPs是一系列以降解细胞外基质成分为主要功能的金属蛋白酶,可引起软骨基质的破坏进而导致关节结构与功能的紊乱,MMP-3是基质金属蛋白酶的一种,在基质降解中具有主要作用[21]。Xu等[22]研究发现骨关节炎时,IL-1β可诱导MMPs表达上调,p38MAPK信号转导途径参与了这一过程, MMPs的表达增加导致软骨胶原的降解加强。本研究显示,模型组MMP-3蛋白表达水平明显高于空白组,表明MMP-3参与了COPD模型气管软骨细胞退变过程。
调补肺肾方是成都中医药大学附属医院治疗COPD的常用协定方,全方由骨碎补、桑寄生等13味药物组成,具有补肺益肾、止咳定喘之功,方中黄芪、党参补肺益肾,山茱萸、熟地黄滋阴补血,骨碎补、补骨脂、续断补肾强骨,丹参、牛膝活血化瘀,矮地茶止咳平喘,浙贝母肃肺化痰,甘草调和诸药。前期研究显示,在常规对症治疗基础上联合调补肺肾方治疗COPD合并气管支气管软化症较单纯西医治疗能够更好地改善患者临床症状,提高生活质量,改善FEV1等肺功能指标[23]。本研究结果显示,模型+调补肺肾方组甲苯胺蓝染色显示软骨细胞形态相对规则,胞内空泡较少,退变明显减轻;免疫组化法显示Ⅱ型胶原表达减弱,在较多软骨细胞质及胞外可见;软骨细胞中p-p38、caveolin-1表达水平和MMP-3、caveolin-1 mRNA表达水平均明显低于模型组。提示调补肺肾方可能通过下调caveolin-1、p38MAPK、MMP-3表达,从而减轻软骨细胞退变,保护气管软骨。
本研究首次提出了COPD合并气管支气管软化症模型的制备方法,并发现调补肺肾方能通过降低caveolin-1、p-p38、MMP-3的表达,从而保护气管软骨细胞退变,部分阐述了中药复方干预软骨细胞退变的作用机制,具有开创性意义。但因研究经费有限,本研究仅对几个主要指标进行了观察,而中药有效成分众多,往往发挥着多靶点及多信号通路作用,下一步需要借助网络药理学、系统生物学或者多组学技术等进一步阐述其作用机制,从而提高中医药治疗水平。
利益冲突:所有作者均声明不存在利益冲突。

