医疗器械唯一标识系统中包装相关概念和应用
易力,郑佳,余新华
中国食品药品检定研究院医疗器械标准管理研究所,北京市,102629
0 引言
医疗器械唯一标识系统(unique device identification system,UDI系统)是当前国际医疗器械监管领域的热点。2013年12月,国际医疗器械监管机构论坛(international medical device regulators forum,IMDRF)发布《UDI指南》IMDRF/UDI WG/NF FINAL:2013,提出应对医疗器械本身或其包装分配一个医疗器械唯一标识(unique device identifier,UDI),其更高级别的包装也应具有独立的UDI[1]。2019年8月,国家药品监督管理局发布《医疗器械唯一标识系统规则》(以下简称《规则》),规定UDI包括产品标识(device identifier,UDI-DI)和生产标识(production identifier,UDI-PI),要求医疗器械注册人/备案人应当选择与其创建的UDI相适应的数据载体标准,对以其名义上市的医疗器械最小销售单元和更高级别的包装或者医疗器械产品上赋予UDI数据载体[2]。我国医疗器械唯一标识数据库(unique device identification database,UDID)于2020年3月31日开放数据共享功能,包装相关信息是我国UDID核心字段的重要组成[3],也是当前UDI试点企业反应问题比较集中的难点。正确的理解包装相关概念以及在UDI系统中的应用对医疗器械注册人/备案人实施UDI系统和各方积极应用UDI开展相关管理有着积极的借鉴作用。
1 包装与UDI系统制度紧密相关
1.1 包装在各国家和地区UDI系统建设中均有体现
包装对于UDI系统的实施必不可少,在各国家和地区的UDI法规中均有体现,见表1。2019年IMDRF发布《UDI系统应用指南》(IMDRF/UDI WG/N48 FINAL:2019),针对UDI在包装级别的应用设置了专门的章节,强调UDI系统的主要原理之一是将UDI应用于医疗器械的每个包装级别,各包装级别上的UDI-DI应保持唯一(虽然UDI包括UDI-DI和UDI-PI,但UDI-DI和包装直接相关且为UDI中必须部分),以区分不同包装级别中器械的数量[4],满足供应链各方识别需求。
1.2 强调包装的概念是UDI系统制度核心的体现
2007年《FDA补充法案》确立了美国UDI系统的立法依据,明确了FDA可以发布UDI法规,要求医疗器械的标签附载有UDI(除例外和豁免的情况),以便在流通和使用环节充分地识别医疗器械[5]。欧盟在2017年颁布的医疗器械法规中针对UDI系统设置了专门的章节,并将UDI定义为通过国际公认器械标识和编码标准创建的字符,能够对市面上特定的医疗器械进行无歧义的识别[6]。从相关国家和地区对UDI系统的定位来看,该制度的核心在于对医疗器械的充分和准确识别。市场上流通的医疗器械很多都是以多级包装的形式存在,供应链中的某一方通常无法接触到所有的包装级别,只有UDI在医疗器械各级包装上保持唯一,才能使各相关方快速准确地获取所需信息而不必拆包,从而提升供应链效率,实现UDI系统预期目的。
2 UDI系统中包装相关重要概念及关系
2.1 器械在流通使用环节存在形式和相关概念
表2结合器械在流通环节的存在形式梳理了包装相关概念,其中最小销售单元直接体现在《规则》中,其它术语(除运输包装)为我国UDID数据项,运输包装虽未直接出现,但和产品包装级别关系密切,对判断其范围至关重要也被列入。表2中相关概念的定义/描述优先选择YY/T 1681—2019《医疗器械唯一标识系统基础术语》中包含的定义[7],在标准不包括的情况下则使用了我国UDID中相应数据项的描述,由于最小销售单元缺乏标准的定义/描述但对于UDI系统实施至关重要,将用专门的章节介绍。
2.2 最小销售单元的理解
除《规则》外,最小销售单元也体现在UDI的实施政策中。《国家药监局关于做好第一批实施医疗器械唯一标识工作有关事项的通告》(2019年 第72号)和《国家药监局 国家卫生健康委 国家医保局关于深入推进试点做好第一批实施医疗器械唯一标识工作的公告》(2020年第106号)规定了第一批实施UDI的9大类69个品种和相关实施要求。从2021年1月1日起,申请首次注册、延续注册或者注册变更时,注册申请人/注册人应当在注册管理系统中提交其最小销售单元的产品标识;而对于2021年1月1日起生产的医疗器械,在其上市销售前,注册人应当按照相关标准或者规范要求将最小销售单元、更高级别包装的产品标识和相关数据上传至UDID,如相关数据发生变化时需要动态维护[8-9]。从《规则》实施方面,本概念贯穿UDI的创建、赋予以及数据库建设的整个系统建设;从医疗器械的管理方面,本概念贯穿上市前和上市后的全生命周期。
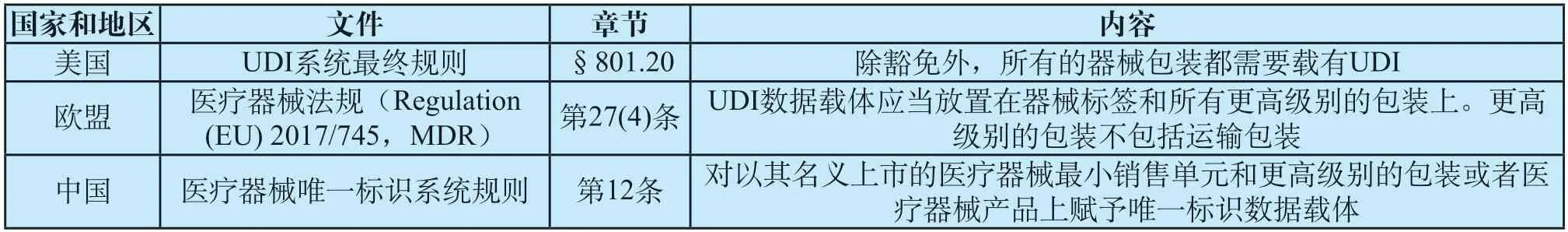
表1 各国家和地区UDI法规中包装相关内容Tab.1 Packaging related contents in UDI regulations of various countries and regions
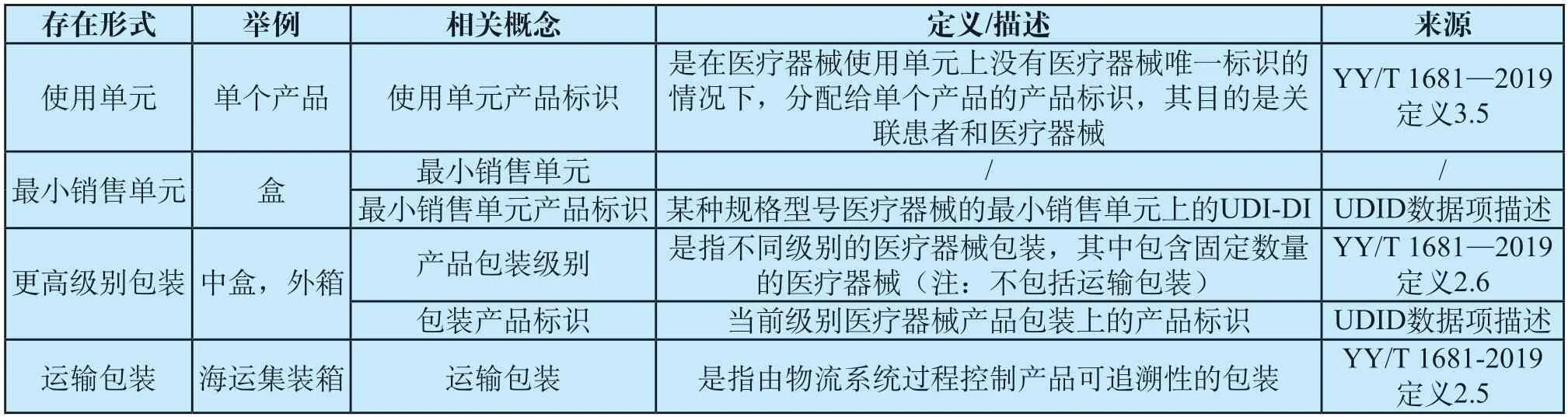
表2 包装相关概念和定义/描述Tab.2 Packaging related terms and their definition/description
最小销售单元未在法规和相关标准中做具体定义,试点中企业反应问题较多。不做明确定义一方面是该概念已在商品行业被广泛使用,另一方面是能够使法规具备灵活性和可操作性,有利于企业实施。在UDI系统实施中,最小销售单元虽然由企业确定,但这并不意味着企业能随意设置,最小销售单元选择不当会导致产品在供应链中无法被充分识别。由于最小销售单元是法规要求包含完整UDI的最低层级包装,一旦被打开其包含的医疗器械产品会因缺乏UDI标识无法被识别,该概念的核心是在器械流通环节单独销售的最小包装且不会被拆包。最小销售单元设置不当会对器械流通使用造成影响,例如某生产企业将包含5 000个注射器的箱包装作为最小销售单元,但在实际流通环节,包含产品数量太多会导致经营企业和医院拆包满足小订单或不同科室需求,使产品失去原包装而不可识别,无法实现UDI系统的预期目的。在药品行业也普遍存在药品最小销售单元包装设置过大,不适合临床使用需要,医院使用前需拆开内包装分零的现象[10]。在美国医疗保健资源和材料管理协会(The Association for Health Care Resource &Materials Management)自发成立了UDI学习社区,研究UDI系统实施的最佳实践,其中低计量单位(low unit of measure,LUM)项目主要解决的问题就是针对包含完整UDI最低包装拆开后,内部产品由于缺少完整UDI无法识别的情况[11]。
2.3 相关概念之间的关系
2.3.1 特定包装以及其对应的UDI-DI
UDI需应用到每个包装级别,各级别的医疗器械包装都应有特定的UDI-DI与之相对应,表2列举的概念中最小销售单元和产品包装级别在数据库中对应的UDI-DI分别为最小销售单元产品标识和包装产品标识。使用单元由于未出现在《规则》和我国的UDID中,因此未作为相关概念在表2中列出,但同样适用,对应UDID数据项为使用单元产品标识。
2.3.2 产品包装级别和运输包装
产品包装级别是指不同级别的医疗器械包装,其中包含固定数量的医疗器械。“固定数量”是把握产品包装级别以及其与运输包装区别的关键,对于特定的医疗器械包装,例如盒、箱等,如包含产品的数量是确定的,就应该视为医疗器械产品的包装级别。对于运输包装,例如快递箱、货运托盘、海运集装箱等,包含的医疗器械数量不固定且在物流系统过程控制中有自身的追溯性要求,不属于产品包装级别范畴。理解运输包装的核心在于其是否包括固定数量的医疗器械而非该包装的用途,对于某些类型的医疗器械,其外箱包含固定数量的医疗器械但也可以作为物流包装,此种情况应视为符合产品包装级别定义的要求。
3 包装在UDI系统建设中的应用
正确地理解UDI系统中包装相关概念有助于各方更好实施UDI系统,以下将从四个关键环节介绍包装在UDI系统实施中的应用。
3.1 包装和UDI的分配
根据《规则》,UDI包括UDI-DI和UDI-PI,其中UDI-DI为识别注册人/备案人、医疗器械型号规格和“包装”的唯一代码。医疗器械行业标准YY/T 1630—2018 《医疗器械唯一标识基本要求》明确了UDI-DI应在各级医疗器械的包装上保持唯一[12],强调UDI的唯一性体现在为各级别的医疗器械包装分配“不同”的UDI-DI,此要求是IMDRF《UDI系统应用指南》包装相关内容核心思路的体现,和其他各国要求保持一致。
虽然《规则》仅要求注册人/备案人按照发码机构的标准创建UDI,但在实际操作中,注册人/备案人应理解产品包装级别包含的内容,为各级固定数量的医疗器械包装(包括使用单元)分配不相同的UDI-DI,运输包装则无需分配。
3.2 包装和UDI的赋予
《规则》要求医疗器械注册人/备案人在医疗器械最小销售单元和更高级别的包装上赋予唯一标识数据载体。表3结合医疗器械的各级包装举例示意了UDI的赋予要求,需要强调的是法规仅要求对医疗器械最小销售单元和更高级别的包装赋码,对于最小销售单元中产品数量大于1的情况,UDI的分配和赋予要求存在差异。从经济学角度,把UDI的赋予的最低要求确定在最小销售单元而非使用单元能节省企业的合规成本,但从临床使用的角度,使用单元缺少可供扫描的条码会对医院的耗材使用和结算带来困难,目前医院反应比较集中[13]。由于最小销售单元由医疗器械注册人/备案人确定,对于某些医疗器械,例如采血管、手术缝线、一次性使用无菌注射器等耗材,最小销售单元通常包含多个产品,但在医疗器械的临床环节单个使用,且器械的计费方式和价格也存在差异[14],医院可能要求某些器械使用单元赋码,造成了法规要求和实际应用需求的差异。
美国和欧盟都在法规中豁免了运输包装的UDI要求,我国《规则》虽未包括运输包装相关内容,但由于运输包装包含器械数量不固定,无需分配UDI-DI,因此也不存在UDI的赋予,我国UDI系统建设对于运输包装的考虑也是同国际接轨的。
3.3 包装和UDID数据上传
《规则》要求医疗器械注册人/备案人在产品上市销售前将产品标识和相关信息上传至医疗器械唯一标识数据库。最小销售单元产品标识是数据库的主键,所有产品的相关信息都与其绑定,除此之外,注册人/备案人还需在UDID中维护和关联各级包装信息。通过这种方式,相关方扫描任何一个级别的包装都能正确获取产品相关信息和包装内医疗器械产品的数量。使用单元产品标识是UDID中条件必选项,当使用单元未被赋予UDI(最小销售单元中产品数量大于1)时必选,注册人/备案人应为其分配独立的UDI-DI并填写,实现医疗器械产品和患者相关联[15]。
运输包装无UDI的分配和赋予的要求,不适用于UDID数据上传,其他各国UDID中同样不包括运输包装信息。UDID是一个静态数据库,包含UDI-DI和相关属性信息,不包括UDI-PI、产品生产计划、流向等动态信息,由于运输包装中包含的器械数量不固定,如需上传,会极大增加数据库中的数据量,而这些数据对于准确的识别特定的医疗器械并无帮助,这也是运输包装不适用于UDID的一个重要原因。
3.4 包装和UDI系统的应用
UDI系统应用在各方,只有所有相关方(从制造商到医院和患者),都在各自的工作流程中使用UDI,UDI系统的益处才能得以体现[1]。UDI系统在顶层设计中充分考虑到了流通使用环节的需求,将UDI定义为贸易项目,对各级别医疗器械的包装赋予UDI并在UDID中进行关联,使企业能够把UDI和自身出入库和结算等业务流程结合在一起,变被动记录为主动扫码,提高企业实施的积极性,促进形成完整的闭环结构,实现医疗器械产品的来源可查、去向可追、责任可究,保障人民群众用械安全。建议各方在今后的业务流程中逐渐用标准的UDI代替原有的自编码,不仅能促进信息互联互通,杜绝信息孤岛的情况,还有助于科学评价医疗器械,提高产品的精细化管理水平。
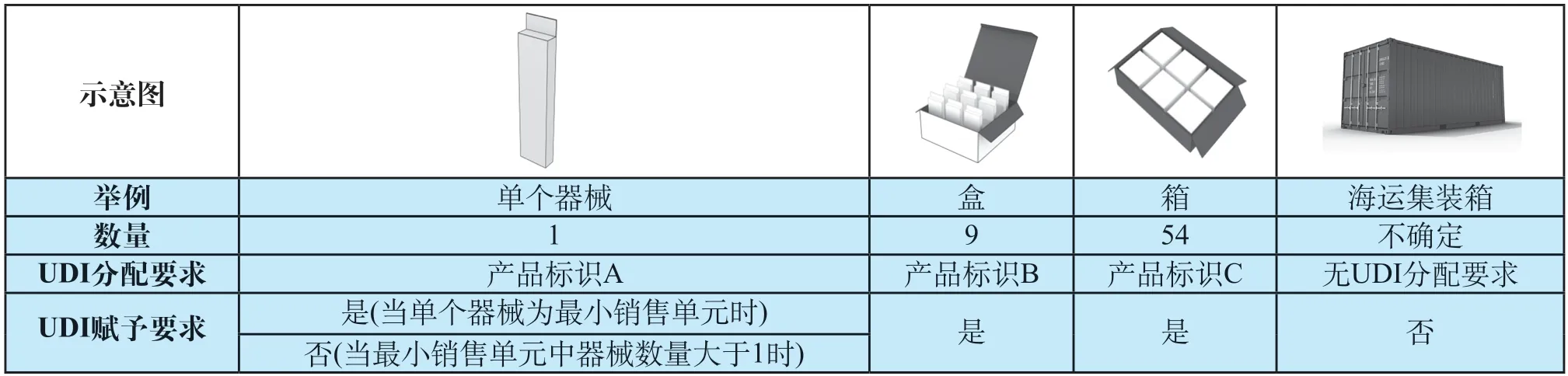
表3 UDI的分配与赋予示意Tab.3 The assignment and placement of UDI
4 对企业实施UDI系统的建议
UDI是医疗器械的“身份证”,正确地对医疗器械各级包装分配和赋予UDI,并将其在数据库中相关联有助于各方快速准确的获取所需信息,提高企业管理水平,提升监管效率。在UDI系统的实施中,建议企业能:
(1)理解UDI制度的核心在于对医疗器械的充分和准确的识别,UDI在各包装级别上保持唯一有助于提高器械在供应链中的识别效率,实现UDI系统的预期目的。
(2)结合自身产品特点和流通方式合理确定医疗器械产品的最小销售单元,避免在供应链中出现因拆包导致包装内产品缺少UDI而无法识读的现象。
(3)强化对“固定数量”一词的理解,正确区分产品包装级别和运输包装的关系,把握UDI系统的适用范围。
(4)正确掌握最小销售单元中产品数量大于1的情况下,UDI分配和赋予要求的差异。
(5)在满足法规最小销售单元和更高级别包装赋码要求的同时,了解医院对特定类型器械使用单元赋码的需求,并平衡两者之间的关系。

