荒漠草原土壤微生物矿化对灌丛引入过程及水分的响应
孙忠超,周玉蓉,赵亚楠,郭天斗,于 露,王红梅,2,*
1 宁夏大学农学院, 银川 750021 2 西北退化生态系统恢复与重建教育部重点实验室, 银川 750021
为缓解宁夏东部荒漠草原植被退化问题,大规模引入灌丛柠条(CaraganaKorshinskii)已成为植被恢复的一项重要措施[1],由于植被类型的转变加剧土壤水分利用和消耗,引起土壤侵蚀以及原生植被多样性丧失[2],使得草地生态系统中的水、碳、氮等要素发生改变,进而影响着土壤微生物碳氮矿化过程[3- 4],加之微生物活动易受全球降雨模式变化的影响,即使干旱地区降雨微弱变化也会影响土壤微生物适应性,最终导致草原生态系统功能发生转变[5- 9]。
土壤水分作为干旱、半干旱地区植被格局的驱动因子,在土壤氮转化(微生物功能响应)和抗土壤侵蚀等方面起着关键作用,可直接影响气体交换、微生物活动等过程,对土壤碳、氮矿化过程产生重要的作用[10- 11]。而土壤微生物是草地生态系统的重要组成部分,同时也是草地土壤养分变化的重要指标[12],在土壤有机物分解、腐殖质的形成、养分转化等环节中起重要作用[13- 14],微生物生物量、微生物功能多样性不仅反映土壤的生物活性,也可反映生态应激机制下微生物群落的生态特征[15- 17]。受全球气候变化的影响,降雨格局影响着土壤水分变化,土壤微生物在不连续降雨脉冲和土壤湿度环境作用下影响着土壤表层矿化过程,使其释放出N素或其他矿物质[9]。荒漠草原地区灌丛引入加速了土壤水分利用和消耗,使其土壤水分表层及深层表现不连续的变化特征[18],进而影响地上草本植物的生长及土壤微生物活动过程,使得草原土壤与植被呈现出明显的异向演变格局[19]。近年来,虽然有研究表明灌丛化过程中能够增加碳固定[20-21],但均出现在灌丛化过程“沃岛”区域[22],“沃岛”效应增加了荒漠草原土壤微生物呼吸、矿化特征的空间异质性。目前,已开展全球降雨模式的改变对灌木侵入的干旱生态系统内的微生物群落结构、功能及其矿化影响的研究,发现短期降雨脉冲的增加可以加速微生物的分解作用[23-24],表明降水是调节土壤碳氮库的重要因素,其中在北美高草草原地区降雨的增加能够增加土壤真菌数量[25],真菌对于土壤水分的响应较为明显[26],而美国南部Chihuahuan干旱地区的研究发现,降雨变化直接影响着土壤真菌的群落丰富度及多度从而影响着该生态系统的微生物功能[9,27-28]。然而,宁夏东部荒漠草原地区在20世纪末期进行人为大规模引入灌丛用于植被恢复,在一定程度上加速土壤水分消耗和多年生草本退化,土壤微生物作用也随之发生变化,而在全球气候变化灌丛引入过程土壤微生物矿化特征仍有待研究。
鉴于此,本研究选取宁夏东部荒漠草原柠条锦鸡儿(CaraganaKorshinskii)灌丛人工引入近30年内的典型区域,以不同年限、密度灌丛引入过程的土壤特性响应特征为基础,开展不同水分处理下荒漠草原灌丛引入过程土壤微生物氮矿化特征,以期揭示荒漠草原人工植被恢复过程对全球气候变化(降雨)的响应特征,为荒漠草原生态恢复的可持续性提供科学依据。
1 材料与方法
1.1 研究区概况
研究区位于宁夏东北部(37°05′—38°10′ N,106°30′—107°39′ E),气候属于典型的温带大陆性气候,降水稀少且时空分布不均匀、蒸发量大,年均气温8.1 °C,年日照时数2863 h,年均无霜期160 d,年均降水量在250—350 mm之间,超过80%的降水分布集中在7—9月,年均蒸发量是2139 mm,年均风速为2.8 m/s。该地区类型为荒漠草原,主要植物有草本主要植物种有:蒙古冰草(Agropyronmongolicum)、短花针茅(Stipabreviflora)、白草(Pennisetumcentrasiaticum)、草木樨状黄芪(Astragalusmelilotoides)、糙隐子草(Cleistogenessquarrosa)、狗尾草(Setariaviridis)、米口袋(Gueldenstaedtiaverna)、牛枝子(LespedezapotaniniiVass)、乳浆大戟(Euphorbiaesula)、砂珍棘豆(Oxytropisracemosa)、雾冰藜(Bassiadasyphylla)、画眉草(Eragrostispilosa)、远志(Polygalatenuifolia)、 猪毛蒿(Artemisiascoparia)等,灌木主要为人工引入的锦鸡儿属柠条(CaraganaKorshinskii)。土壤类型主要为灰钙土,土壤结构松散,肥力低,含沙量大。
1.2 样地选择
样地选取盐池县东北部封育草地/EG、放牧地/GL、不同种植年限(3年/SY3、12年/SY12、22年/SY22)和不同种植间距(40 m/SI40、6 m/SI6、2 m/SI2)柠条地(90年代种植)(表1),利用时空代替法来代表“荒漠草原-退化-人工灌丛引入”的不同过程,即:1)草地-放牧-不同种植年限灌丛引入过程;2)草地-放牧-不同种植间距灌丛引入过程。
1.3 研究方法
1.3.1土壤全氮
2017年7月集中采样,封育草地、放牧地样地里随机选10个样点,重复3次,柠条灌丛样地分别在带内、带间选取5个采样点,重复3次,用土钻钻取0—100 cm土层的土壤,每20 cm为一层,共5层,充分混匀土样,并装入自封袋,用于土壤全氮的分析。采用半微量开氏法测定土壤全氮[29]。
1.3.2土壤微生物数量测定
2017年6月,在5个样地内分别随机选取3个点,每个采样点设3个重复,取0—20 cm 土层用于土壤微生物种类与数量的测定。土壤微生物数量测定采用平板涂抹接种法,以营养琼脂培养细菌,PDA(马铃薯葡萄糖琼脂)培养基培养真菌,培养3—7 d观察计数[30]。

表1 样地概况表
1.3.3土壤微生物矿化培养试验
野外原位矿化培养方案:采用顶盖埋管法[31],于2017年4月中旬在各样地中一次埋入1批PVC管(内径15 cm,高10 cm),PVC管垂直打下去进行取土,然后用刀轻轻去除多余的土样,PVC管底部垫上棉纱,再用纱布系牢。该试验设置持续干旱 (不浇水)、前期饱和(浇水饱和)、和自然降雨3个水分梯度,表明降雨增加或干旱缓解变化过程。根据水分梯度要求,对于浇水至饱和和干旱处理的管口进行避雨处理后,埋在样点的原始位置的坑内,自然降雨处理直接恢复表层覆盖物。各水分处理均有3个重复,各样地分别设置9个矿化原位管用于观测。依次于2017年6、8、10月各采集一批PVC埋管土,该3批埋管土采集相当于分别原位矿化培养60、120、180 d,同时采集 2017年4月背景土(0—10 cm)作为对照,土壤低温保存运输回实验室后做相关指标分析,对其主要观测了土壤微生物量氮(Soil microbial biomass nitrogen, SMBN)、硝态氮、铵态氮等指标。
1.3.4土壤微生物量氮及氨态氮、硝态氮测量方法
土壤铵态氮、硝态氮采用新鲜土样,先用1 mol/L KCl 浸提,然后用SKALAR San++流动分析仪测定;SMBN浸提采用氯仿熏蒸K2SO4提取[32]。
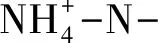


1.3.5采用Microsoft Excel 2010和Origin 2017软件作图、DPS数据统计软件对相关数据分析处理。
2 结果与分析
2.1 荒漠草原灌丛引入过程中土壤全氮变化特征
由图2可知,不同年限灌丛引入过程土壤全氮含量为0.25—0.51 g/kg,随灌丛引入年限的增加,在0—20 cm和0—100 cm土层土壤全氮含量较放牧地呈现逐年增加的趋势,分别为0.28—0.42、0.28—0.51 g/kg,其中22年灌丛地显著高于3年灌丛地、12年灌丛地(P<0.05),但与封育草地土壤全氮含量无显著差异。由图2可知,不同间距灌丛引入过程中土壤全氮含量为0.25—0.51 g/kg,随灌丛引入密度的增大,在0—20 cm和0—100 cm土层土壤全氮含量较放牧地呈现增加的趋势,分别为0.27—0.42、0.27—0.51 g/kg,并且均随密度增加呈现先增加后降低趋势,在间距6 m时为最大值,显著高于放牧地、间距40 m灌丛地、间距2 m灌丛地(P<0.05),但与封育草地无显著差异。

图2 草原-放牧-灌丛引入过程土壤全氮变化Fig.2 Changes of soil total nitrogen in the process of grassland-grazing-shrub introduction 不同小写字母表示不同处理间差异显著(P<0.05)Different small letters showed significant difference between different treatments(P<0.05).统计样本数:n=15
2.2 荒漠草原灌丛引入过程中土壤微生物数量变化特征
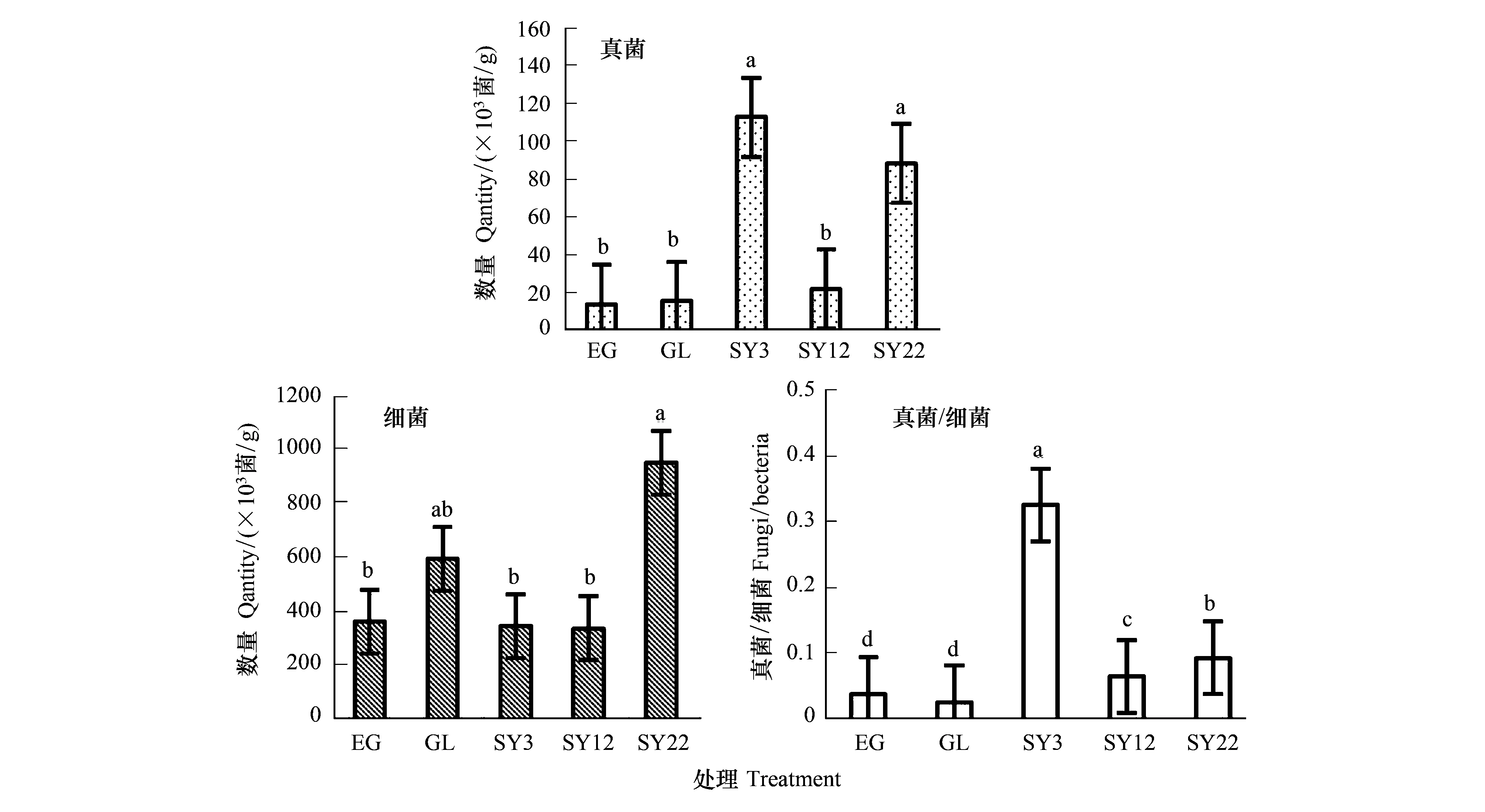
图3 草原-放牧-不同年限灌丛引入过程土壤微生物数量变化Fig.3 Changes of the number of soil microbials in the process of shrub introduction with different years不同小写字母表示不同处理间差异显著(P<0.05);统计样本数:n=15;EG:封育草地;GL: 放牧地; 不同种植年限(3年/SY3、12年/SY12、22年/SY22); 不同种植间距(40 m/SI40、6 m/SI6、2 m/SI2)
由图3可知,不同年限灌丛引入过程3年、22年灌丛地真菌数量均显著高于封育草地、放牧地(P<0.05),且3年灌丛地真菌数量达最大值,为112.83×103菌/g。22年灌丛地细菌数量显著高于封育草地、放牧地、3年灌丛地、12年灌丛地(P>0.05),达最大值953.25×103菌/g。土壤真菌/细菌比值为0.03—0.33,3年灌丛地达最大值为0.33,显著高于封育草地、放牧地(P<0.05),并随引入年限增加呈降低趋势。
由图4可知,不同间距灌丛引入过程,间距6 m灌丛地真菌数量达最大值,为88.48×103菌/g,显著高于封育草地、放牧地、其他间距灌丛地(P<0.05),且这四个样地间无显著差异(P>0.05)。间距6 m灌丛地细菌数量达最大值,为953.25×103菌/g,显著高于其他四个样地(P<0.05),密度最大时,真菌、细菌均呈显著降低变化,但均与封育地差异不显著,而各个样地土壤真菌/细菌比为0.03—0.22,其中间距2 m灌丛地达最大值,为0.22,显著高于封育草地、放牧地、其他灌丛地(P<0.05),随密度增加呈增加趋势。
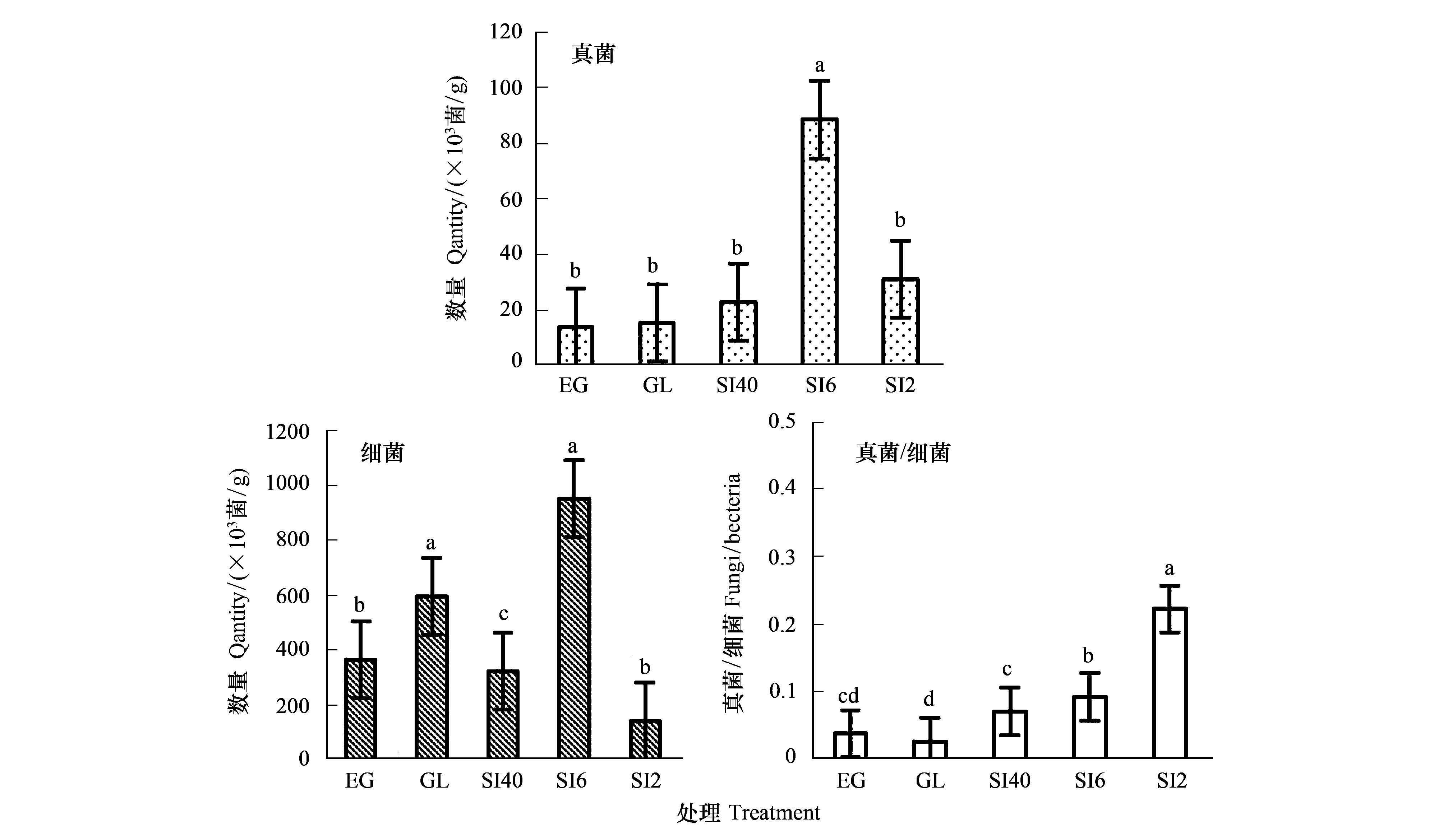
图4 草原-放牧-不同间距灌丛引入过程微生物数量变化Fig.4 Changes of the number of soil microbials in the process of shrub introduction with different intervals
2.3 荒漠草原灌丛引入过程SMBN变化特征
由图5可知,不同年限灌丛引入过程,SMBN含量变化为0.041—0.103 mg/kg,放牧地最高为0.103 mg/kg,显著高于封育草地、灌丛地,但封育草地显著高于灌丛地;灌丛地SMBN含量变化为0.041—0.057 mg/kg,其中22年灌丛地与3年灌丛地、12年灌丛地均存在显著性差异(P<0.05)。由图5可知,不同间距灌丛引入过程,SMBN含量变化为0.041—0.103 mg/kg,放牧地为最高,显著高于封育草地、灌丛地,且灌丛地随密度的增大而增大,SMBN含量变化为0.041—0.081 mg/kg,以间距2 m灌丛地为最高,但与封育草地无显著差异(P>0.05)。
2.4 荒漠草原灌丛引入过程中土壤无机氮及微生物氮矿化特征
图6 草原-放牧-不同年限灌丛引入过程微生物矿化的变化特征Fig.6 Characteristics of microbial mineralization in the process of shrub introduction with different years在含量和含量、矿化速率变化中,不同小写字母表示每个样地不同培养时间差异显著(P<0.05),统计样本数:图含量和图 含量n=60,图矿化速率n=45
2.5 荒漠草原灌丛引入过程土壤微生物矿化对水分的响应
图8为草地-放牧-不同年限灌丛引入过程土壤净矿化速率、净硝化速率、净氨化速率对不同水分的响应。其中净矿化速率表现为:不同水分条件下各时期封育草地的净矿化速率为0.027—0.046 mg kg-1d-1,均为正值;放牧地在干旱处理下的净矿化速率均为负值,自然降雨条件下为正值,分别为-0.104、-0.105、0.019 mg kg-1d-1;而各灌丛地随着年限的增加净矿化速率为0.061—-0.166 mg kg-1d-1,均向负值变化发展,当22年时灌丛地各水分梯度均呈负值,且自然降雨矿化速率大于两个干旱处理。各样地净硝化速率表现为:封育草地、放牧地净硝化速率为正值,水分梯度之间差异不显著(P>0.05),但显著高于灌丛地(P<0.05),但放牧地和灌丛地不同水分梯度和不同时期净硝化速率大都表现为负值,变化范围为0.168—-0.401 mg kg-1d-1,且自然降雨条件下的硝化速率均大于其他两个干旱处理,随着水分梯度的增加硝化速率呈现增加趋势,各样地的硝化作用除封育草地随水分梯度无显著变化外,放牧地、灌丛地均随水分梯度增加而增加;各样地氨化速率表现为:封育草地氨化速率不同水分梯度下其数值均无明显变化,放牧地氨化速率明显呈负值,变化范围为-0.149—-0.203 mg kg-1d-1。随水分梯度变化和时间的延长呈增加趋势,而灌丛地氨化速率变化幅度不大,变化范围为0.027—-0.108 mg kg-1d-1,且随年限增加氨化负值趋势也增加。各样地氨化作用随着水分梯度的增加呈现降低趋势。
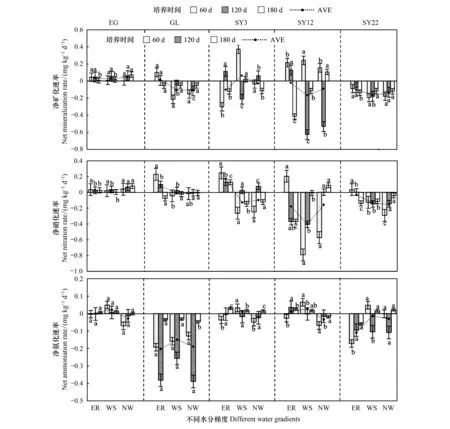
图8 草原-放牧-不同年限灌丛引入土壤微生物矿化对水分的响应Fig.8 Response of soil microbial mineralization to water levels in shrublands with different yearsNW:不浇水no water; WS:浇水饱和:water saturation; ER:自然降雨:embient rainfall.不同小写字母表示每个样地相同时间不同水分梯度下差异显著性(P<0.05)统计样本数:n=75
图9为草地-放牧-不同间距灌丛引入过程中土壤净矿化速率、净硝化速率、净氨化速率对不同水分的响应。其中净矿化速率表现为:不同水分条件下各时期封育草地中的净矿化速率均为正值,变化范围为0.027—0.046 mg kg-1d-1;放牧地在干旱处理下的净矿化速率均为负值,自然降雨条件下为正值,分别为-0.104、-0.105、0.019 mg kg-1d-1;而各灌丛地随间距的缩小净矿化速率均呈负值变化发展,变化范围为-0.095—-0.222 mg kg-1d-1,间距40 m灌丛地、间距6 m灌丛地、间距2 m灌丛地各水分梯度均呈负值,其中间距6 m灌丛地自然降雨矿化速率大于两个干旱处理,各个样地净硝化速率表现为:封育草地、放牧地净硝化速率为正值,水分梯度之间差异不显著(P>0.05),显著高于灌丛地(P<0.05),但放牧地和灌丛地不同水分梯度和不同时期大都表现为负值,变化范围为0.083—-0.280 mg kg-1d-1,且前期饱和自然降雨条件硝化速率均大于其持续干旱处理,随着水分梯度的降低硝化速率呈现降低趋势,封育草地,其中放牧地、灌丛地均随水分梯度的增加呈降低趋势;各样地氨化速率表现为:封育草地氨化速率随水分梯度和培养时间的变化均无明显变化,放牧地氨化速率明显呈负值,变化范围为-0.149—-0.203 mg kg-1d-1。随水分梯度变化和时间的延长呈增加趋势,而灌丛地氨化速率变化幅度不大,变化范围为0.031—-0.108 mg kg-1d-1,并随着间距的缩小,氨化速率向负值发展的趋势也减少,各样地氨化作用随着水分梯度降低而降低。
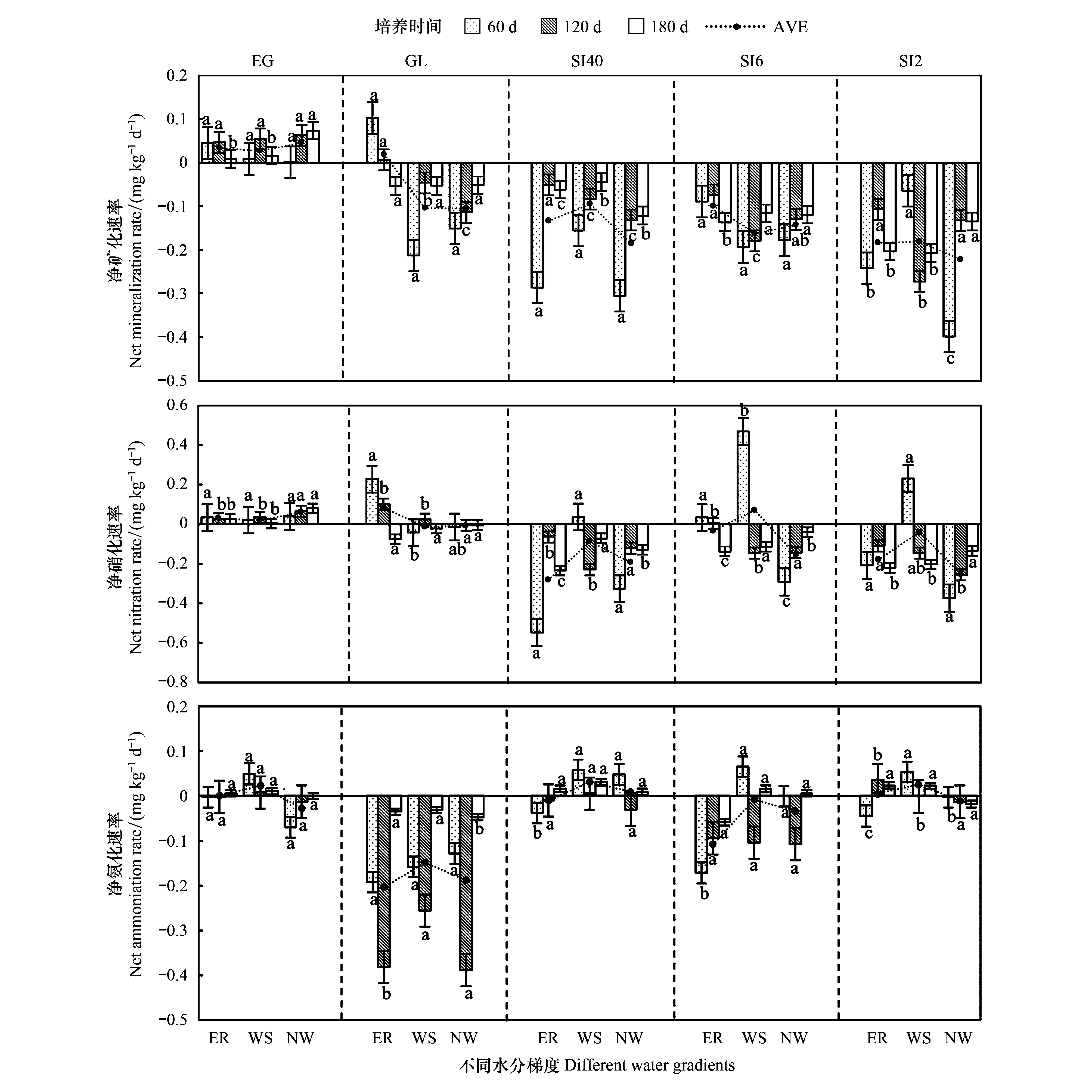
图9 草原-放牧-不同间距灌丛引入土壤微生物矿化对水分的响应Fig.9 The response of soil microbial mineralization to water levels in shrublands with different intervals
3 讨论
3.1 荒漠草原灌丛引入对土壤全氮及微生物影响
荒漠草原处于降雨稀少的干旱、半干旱地区,生态环境较为脆弱,土壤水分、养分和有机质含量较低,且存在明显差异性,易受气候和人类干扰影响,出现草地荒漠化和严重的土壤退化[33-34]。人工引入灌丛不仅对土壤物理性质(孔隙度、水分等)发生作用,还对土壤化学性质(如:土壤全氮)产生影响[18]。本研究中发现灌丛引入过程中0—20、0—100 cm土层的土壤全氮均高于放牧地,且灌丛地随时间推进呈增加趋势,但达到一定年限又会随密度的增加呈下降趋势,可能原因是由于22年种植柠条灌丛对深层土壤水分的过度消耗加之密度增大,造成较低的土壤含水量(试验中最低含水量)[35],从而影响了土壤微生物矿化过程,后期的矿化研究也表明放牧和灌丛引入加速硝化氨化作用,消耗底物速度较快。Song等[36]研究发现总氮矿化速率在耕地向草地转变过程中显著下降,而草地向森林转变过程中显著增高,并且总氮矿化速率和硝化速率随土壤全氮的增加而增加,该研究结果与本研究结果趋势相同,矿化和水分关系密切,荒漠草原向放牧地、灌丛地转变过程中存在土壤水分的消耗或加剧,使得净矿化速率和硝化速率呈显著降低的趋势,但从本研究来看灌丛地、放牧地均存在硝化氨化前期加速后期显著降低的现象,说明底物加速消耗的过程,且以硝化为主。
随着灌丛引入,发生了不同程度的“沃岛效应”[22],进而对土壤微生物造成影响。而土壤微生物作为草地生态系统中碳氮循环最为活跃的部分[37],主要随着季节变化中温湿度改变而变化,王杰等[12]在贝加尔针茅(Stipabaicalensis)草原的土壤微生物研究中发现,添加水分能缓解氮肥对微生物的抑制,并提高微生物代谢活性和利用碳源与水的能力。水氮相互作用可提高碳源利用率和土壤微生物的功能多样性[38]。研究发现土壤水分与微生物数量密切相关。在一定范围内,土壤微生物量随土壤含水量的增加而增加。Garcia等[39]研究结果表明,在潮湿的冬季土壤微生物量最高,在干燥的夏季最低,其中土壤水分是主要的影响因子;土壤微生物量可作为研究土壤生态系统动态变化的一个敏感指标,并及时的预测土壤生态系统功能的变化。SMBN是土壤中全氮的主要组成部分,对平衡土壤养分起关键作用。灌丛对土壤微生物的影响主要是由于其周围土壤含水量分布、枯落物和根系分泌物质量和数量以及灌丛对周围环境中的生理特性所导致的[40]。而本研究采用野外原位矿化,保持了原有土壤的水分、通气性,能较好的反映土壤自然矿化特征。灌丛引入直接影响了土壤水分含量的分布及枯落物的量,从而间接影响土壤微生物生态系统养分输入通量[41]。引入的灌木种为灌丛柠条,属豆科植物,其于根瘤菌的共生固氮作用及根系分泌物的差异,也直接影响了土壤微生物的矿化过程。本研究中细菌含量为灌丛柠条>放牧草地>封育草地,灌丛地细菌数量达到最高,可能是因为引入灌木柠条其根系活跃的根瘤菌的固氮作用为土壤氨化反应提供充足的基质加速土壤矿化,增加土壤中细菌含量的占比,因此影响土壤氮矿化和保持过程的因素均会影响土壤SMBN的含量[42],特别是干旱地区水分变化是影响SMBN的关键因素。有研究提出水分对可利用的土壤碳氮能够进行调控,并且表明沙漠季节性降水变化可以改变微生物群落功能动态和增加土壤真菌群落的丰度[43]。本研究中随着放牧和灌丛引入真菌、细菌数量呈增加趋势,真菌/细菌比均出现在灌丛引入初期和种植密度最大时,但是SMBN仍以封育草地、放牧地高于不同年限和间距引入的灌丛地,说明随着放牧地和灌丛地的土壤生境的变化,微生物活动也发生响应变化,其中本研究表明微生物数量呈增加趋势,加速了硝态氮和铵态氮的释放过程,但放牧地和灌丛地在培养后期底物消耗殆尽,出现负值,反映了草地灌丛引入过程由于微生物群落的变化加速有机氮的矿化过程,且硝态氮的微生物同化作用优先级高于铵态氮的微生物固定作用。
3.2 荒漠草原灌丛引入过程土壤微生物矿化对土壤水分的响应
土壤微生物矿化主要受土壤水分、温度、养分、植被特征和微生物等因素的影响[44]。其中水分是影响矿化作用的主要生态因子,特别是在荒漠草原地区,土壤水分主要来自于降雨,其在微生物在转化过程中发挥着重要作用[45]。Nielsen等[46]研究表明在干旱、半干旱草地生态系统中土壤微生物参与的氮转化过程对降雨格局变化的响应非常敏感。但也有研究认为干旱、半干旱草地生态系统的植物和土壤微生物由于长期的适应和进化,土壤生物化学过程基本保持稳定状态,生长季少量的降雨就可维持植物整个生长季的生长[47],这些研究均表明,在不同的生态系统中微生物对水分的响应具有一定的差异。本研究中放牧地和灌丛地矿化作用显著低于封育草地280.3%和440.2%,且表现为自然降雨处理明显高于浇水饱和与不浇水条件下的微生物量及矿化作用的增加,对水分的变化反映明显,但对于封育草地而言,水分梯度的变化对其影响不显著,3个水分梯度矿化差异不显著也说明封育草地应对干旱具一定的缓冲作用,即使处于长期干旱也能维持矿化的进行。有研究表明由于土壤水分降低限制作物正常生长时,但土壤微生物仍可以利用有限的土壤水分和养分进行矿化过程用于植物吸收[48],但土壤微生物生物量氮含量呈现降低现象。当极度干旱时,土壤微生物的活性必受影响,微生物将开始死亡或休眠[49]。
Yao等[50]发现在生长季中种植豆科灌木柠条可以增加氮素的利用率和净矿化率。而在本研究中在自然降雨状态下随灌丛引入的时间和间距呈现先增加后降低,这可能与不同年限和密度灌丛根系逐年变大深扎对水分的吸收有关。有关氮矿化有相对较强的季节性,一般来说春秋两季的氮转化速率较高,且本研究中灌丛地的前期矿化速率均较快,土壤水的可利用性是植物生长季微生物活动过程中的重要限制因子,氮矿化作用会受到降水格局的影响,有研究得出在干旱及半干旱草原中,降水变化是影响土壤氮素矿化速率的重要驱动因子[51]。本研究中3个不同水分梯度:自然降雨、前期饱和与持续干旱条件下,封育草地在3个水分梯度下的净矿化速率、净硝化速率、净氨化率均呈不显著差异,且均为正值,矿化持续进行,说明干旱增加或雨量减少对封育草地的矿化影响不显著,封育草地具有一定的缓冲能力,而放牧地和不同年限、间距灌丛地矿化速率均呈负值,显著低于封育草地,且对3个水分梯度变化有一定的影响,即净矿化速率、净硝化速率呈显著降低趋势,而净氨化速率呈增加趋势,说明放牧地和灌丛地的转变使得荒漠草原更加敏感,其敏感的可能原因是基于土壤水分的大量消耗,使得土壤长期处于低值使得矿化受限,一旦土壤水分有所改善均会积极响应矿化过程。在矿化试验发现封育草地能够缓冲水分梯度的变化,并持续矿化,而放牧地和灌丛地对水分的响应积极,前期是无机氮大量释放过程,后期由于底物限制和水分条件的变化呈现迅速降低的变化,均可解释培养期内灌丛地显著降低了矿化速率原因。
4 结论
本研究得出放牧地、不同年限/间距灌丛引入过程加速荒漠草原土壤矿化氮的释放,且硝化速率变化趋势大于氨化速率,以硝化为主。封育草地较放牧地和灌丛地具一定缓冲能力,短期干旱加剧对封育草地无显著影响,而放牧地和人工灌丛地的土壤净矿化速率会随着干旱的增加呈显著降低趋势,且人工灌丛地尤为明显,表现为较低的土壤矿化稳定性。研究结果可为不同水分处理下荒漠草原灌丛引入过程中土壤微生物矿化活动特征提供重要数据支撑。

