工业化肠内营养制剂与自制匀浆膳对危重症患者早期肠内营养效果比较
徐慧玲,张予青,李一帆
(新乡市中心医院 临床营养科,河南 新乡 453000)
危重症是临床紧急、难治病症,多是由于严重创伤、感染、手术等造成的器官衰竭,身体耗能增加,且由于吞咽功能、意识认知障碍等因素导致进食困难甚至无法进食,进而造成营养状况恶化,影响康复[1],临床上应在常规治疗基础上给予肠内营养支持,补充能量。肠内营养支持治疗在肠道应激反应中可发挥重要作用,临床应用广泛[2]。强化营养支持治疗可避免蛋白质过度消耗引起的营养不良,维持机体重要器官功能,并促进肠道蠕动,维持其完整稳定性,避免肠道移位发生感染、电解质紊乱等[3]。本研究旨在探讨危重症患者接受工业化肠内营养制剂与自制匀浆膳在早期肠内营养支持治疗的效果。
1 资料和方法
1.1 一般资料
1.1.1研究对象及分组 选取2018年4月至2019年4月新乡市中心医院收治的危重症患者71例,按照治疗方法分为对照组和观察组,对照组34例接受自制匀浆膳营养治疗,观察组37例接受工业化肠内营养制剂营养治疗。对照组男17例,女17例;年龄38~89岁,平均(64.52±10.95)岁;格拉斯哥昏迷量表(Glasgow coma scale,GCS)6~14分,平均(10.21±1.78)分;原发疾病为心脑血管疾病15例、胰腺炎4例、呼吸器官衰竭10例、颅脑外伤5例。观察组男19例,女18例;年龄39~89岁,平均(67.14±10.78)岁;GCS评分6~15分,平均(10.54±1.94)分;原发疾病为心脑血管疾病16例、胰腺炎3例、呼吸器官衰竭13例、颅脑外伤5例。两组患者基线资料(性别、年龄、GCS、原发疾病)比较,差异无统计学意义(P>0.05)。本研究经新乡市中心医院医学伦理委员会审核通过。
1.1.2纳入及排除标准 (1)纳入标准:①出现器官衰竭症状,且体温、呼吸、脉搏等基本生命体征异常;②行胃管置管。(2)排除标准:临床资料不完整。
1.2 治疗方法两组患者均进行积极治疗原发病,纠正酸碱、水、电解质平衡,控制感染。观察组接受工业化肠内营养制剂(西安力邦临床营养股份有限公司生产的纤维全营粉和乳清蛋白粉),主要成分为麦芽糊精、植物油、乳清蛋白水解物、矿物质、维生素、微量元素等。对照组接受自制匀浆膳,主要成分为肉泥、鸡蛋、牛奶、鲜果汁等,保证2种营养液热量和蛋白质供给相当。患者禁食24~48 h后采用肠内营养泵持续性泵入,初始速度为30 mL·h-1,然后增量至50 mL·h-1,共500 mL,必要时给予胃动力药,3~4 d后增量至1 000~1 500 mL,最大泵入速度为80~100 mL·h-1。每4~6 h监测胃残余量,并冲洗胃腔,结束后用温开水冲洗鼻饲管,固定于面颊或鼻部。
1.3 观察指标(1)营养状况评估:治疗后1、14 d抽取静脉血3 mL,采用双缩脲法测定血清总蛋白(total protein,TP)、血红蛋白(haemoglobin,Hb)、白蛋白(albumin,ALB)、前白蛋白(prealbumin,PA)评价两组营养状况。(2)治疗1、14 d后两组淋巴细胞总数(total lymphocyte cells,TLC)、白细胞总数(white blood cells,WBC)。(3)两组内环境变化(血糖、水、电解质)。(4)两组并发症(腹泻、便秘、吸入性肺炎、胃潴留、消化道出血)发生情况。

2 结果
2.1 营养状况治疗后1 d两组患者TP、Hb、ALB、PA水平比较,差异无统计学意义(P>0.05);治疗后14 d观察组患者TP、Hb、ALB、PA水平均高于对照组,差异有统计学意义(P<0.05)。见表1。

表1 两组营养指标比较
2.2 两组TLC、WBC比较治疗后1 d两组患者TLC及治疗后1、14 d两组患者WBC水平差异均无统计学意义(P>0.05);治疗后14 d观察组TLC水平均高于对照组,差异有统计学意义(P<0.05)。见表2。
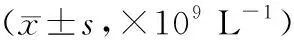
表2 两组患者TLC和WBC比较
2.3 两组机体内环境变化比较观察组发生水、电解质紊乱1例,对照组发生血糖紊乱3例,水、电解质紊乱5例。观察组内环境紊乱发生率为2.70%(1/37),低于对照组[23.53%(8/34)],差异有统计学意义(P<0.05)。
2.4 两组并发症发生率比较观察组出现腹泻1例、消化道出血1例;对照组出现腹泻2例、便秘3例、吸入性肺炎2例、胃潴留1例、消化道出血1例。观察组并发症发生率为5.41%(2/37),低于对照组[26.47%(9/34)],差异有统计学意义(P<0.05)。
3 讨论
危重症患者由于病情、治疗,机体处于应激状态,且患者进食困难,能量消耗明显,代谢率升高,蛋白质分解增加50%,导致免疫功能下降,低蛋白血症,能量供应不足,甚至出现多器官衰竭[4]。肠内营养支持是危重症患者的重要治疗措施,在维持患者营养状态的同时,还可以有效预防肠道黏膜萎缩和肠道菌群异位,预防因静脉营养所导致的静脉炎和肝肾损伤等并发症[5]。
肠内营养支持常采用工业化营养制剂或自制匀浆膳进行营养治疗。本研究所使用的工业化营养制剂是一种整蛋白的营养制剂,具有营养均衡,营养成分明确,渗透压正常,对胃肠道刺激性较小,符合消化道生理功能,且吸收率高等特点[6],同时能够达到无菌要求,耐受性好,应用方便,不良反应少,且由于性状均质,泵注时较为顺畅。自制匀浆膳制作过程比较繁琐,营养成分不均衡,卫生难以保证,且其黏度较高,固体成分易于沉降,导致泵注时不顺畅,消化吸收率低[7]。本研究发现,治疗1 d后两组患者指标无明显差异,这与干预时间较短有关;治疗14 d后,工业化营养制剂组患者TP、Hb、ALB、PA营养指标均优于自制匀浆膳组,差异有统计学意义,也进一步证实了工业化营养制剂的优势。工业化肠内营养制剂通过鼻胃管泵入,既可以保证足够的能量和蛋白质摄入,又可以减少制作和泵入不畅的问题,可有效保证危重症机体获得较多蛋白质与能量,并纠正患者由于蛋白质分解过多引起的负氮平衡[8]。本研究结果还显示,治疗14 d后观察组TLC水平均高于对照组,工业化营养制剂与正常生理状态更加接近,能提供足够营养因子,有助于肠道黏膜屏障结构及功能的恢复,阻止肠源性感染,提高淋巴细胞数量,从而提升免疫功能,避免肠道功能异常。另外,观察组内环境紊乱发生率低于对照组,并发症发生率低于对照组,这与工业化营养制剂在制作过程中会增加膳食纤维有关,有助于促进肠道菌群的生长,维持肠道黏膜的完整性,预防感染等。工业化营养制剂可有效调节机体内环境,提高肠道自主调节功能,减少内环境变化,降低并发症的发生率。
综上所述,工业化肠内营养制剂在危重症患者早期肠内营养支持治疗中优于自制匀浆膳,能改善患者营养指标,提高淋巴细胞总数,减少内环境变化,降低并发症发生率。

