鱼类致病嗜水气单胞菌外膜蛋白TolC的原核表达及抗原性分析
荣 娜,简思杰,孙 薇,康 超,陈 琛,刘 祥
(陕西理工大学 生物科学与工程学院 中德天然产物研究所,陕西 汉中 723001)
嗜水气单胞菌(Aeromonashydrophila,A.hydrophila)属于弧菌科气单胞菌属,是导致水生动物感染细菌性疾病的主要病原菌,主要可诱发鱼类感染败血症,死亡率高[1-3],严重影响了水产养殖业的经济发展。传统上的抗生素防治见效快,但存在抗生素残留及菌株耐药性等副作用[4]。疫苗免疫因其无毒害、安全性高而备受关注,但目前应用于商业养殖的灭活疫苗免疫效果不稳定,且存在二次感染风险[5-6]。因此,有必要研制有效防治嗜水气单胞菌的新型疫苗。而亚单位疫苗以纯化的蛋白质、多糖或核酸等免疫活性片段作为组分,安全稳定且免疫持久[7],成为当今的研究热点。
外膜蛋白(Outer membrane protein,OMP)是嗜水气单胞菌的毒力因子之一[8],作为细菌免疫原具有安全性高、免疫原性强等优点[9]。研究发现,嗜水气单胞菌外膜蛋白OprM、OmpC、OmpF均具有良好的免疫原性,可有效抵抗嗜水气单胞菌感染[10-12],有望作为亚单位疫苗的候选成分。TolC蛋白是革兰氏阴性菌细胞外膜上的通道蛋白,对该蛋白质的研究大多聚焦于其在细菌体内形成的ArcAB-TolC多药外排系统[13-14]。然而,YANG等[15]发现,沙门氏菌的TolC蛋白具有较强的抗原性和免疫原性,可有效抵抗沙门氏菌的感染,张志强等[16]将迟缓爱德华菌外膜蛋白TolC免疫小鼠,发现小鼠对迟缓爱德华菌具有较强的抵抗力,表明TolC是制备疫苗的潜在良好抗原。目前,有关嗜水气单胞菌TolC蛋白免疫学功能研究尚未见报道。为此,选取嗜水气单胞菌外膜蛋白TolC为研究对象,在线预测其理化性质,分析其菌属间同源性与进化关系,原核表达纯化TolC蛋白并探讨其最佳诱导表达条件,将纯化的TolC蛋白免疫小鼠制备抗血清,体外模拟TolC蛋白抗血清与不同鱼类致病菌的识别作用,进一步探究其抗原性,旨在为研制嗜水气单胞菌亚单位疫苗提供理论参考。
1 材料和方法
1.1 材料
嗜水气单胞菌ATCC 7966,Escherichiacoli(E.coli) DH5α、BL21菌株及pET-32a质粒由陕西理工大学中德天然产物研究所保存;DNA聚合酶、T4 DNA连接酶、内切酶BamHⅠ和XhoⅠ购自TaKaRa公司;质粒提取、胶回收试剂盒购自上海生物工程公司;IPTG、TMB显色液购自西安赫特生物科技有限公司;HRP标记山羊抗小鼠IgG购自Sigma公司;引物合成、基因测序由杨凌天润奥科生物公司完成;4~5周龄昆明鼠购自西安交通大学实验动物中心,试验前饲养3 d,每日定量喂食供水。
1.2 方法
1.2.1 生物信息学分析 从NCBI数据库查找获取嗜水气单胞菌以及不同菌株来源的TolC蛋白序列,利用GeneDoc软件进行同源性比对,通过MEGA软件构建TolC蛋白系统发育树;采用ProParam数据库预测TolC蛋白的亲水性、等电点、稳定指数等理化指标,从ProScale Analysis数据库中获取亲水性图谱;采用TMHMM 2.0和SignalP 3.0软件预测TolC蛋白的跨膜结构和信号肽位置,利用SOPMA和SWISS-MODEL软件分别进行二级结构和三维结构预测,通过STRING软件在线获取TolC蛋白与其他蛋白质的相互作用关系网络。
1.2.2 重组菌株的构建 从NCBI数据库中获取嗜水气单胞菌ATCC 7966菌株的全基因组序列,采用Primer Premier 5.0软件设计引物扩增TolC基因。Primer-F:ATAGGATCCGTGCTGGGCTCGGCCCAG;Primer-R:GTTCTCGAGTCATGAATTCACCTCGAT(划线位置为BamHⅠ和XohⅠ的酶切位点)。以提取的嗜水气单胞菌全基因组为模板,利用rTaq聚合酶实现TolC扩增,PCR体系为50 μL,退火温度设为55 ℃。PCR产物经核酸电泳检测并回收,BamH Ⅰ 和XohⅠ 双酶切PCR产物与载体pET-32a,通过T4 DNA连接酶将TolC片段连接至质粒pET-32a中,转化E.coliDH5α,获得重组质粒。通过双酶切和基因测序进一步鉴定重组质粒,将鉴定正确的重组质粒转化至E.coliBL21中,构建TolC蛋白原核表达菌株。
1.2.3 重组蛋白的表达及纯化 挑取表达菌单菌落过夜培养,以1∶100转接新鲜培养基培养至OD600为0.6,加入0.1 mmol/L的IPTG,低温诱导过夜,取1 mL菌液收集菌体,加入300 μL 2×SDS Loading Buffer,沸水浴变性5 min,离心取上清10 μL进行SDS-PAGE电泳,检测TolC表达情况,再通过包涵体洗涤和SDS-PAGE电泳切胶法纯化TolC蛋白[9]。
1.2.4 重组蛋白表达条件的优化 采用L9(34)试验(表1)进行TolC蛋白最佳表达条件研究。简要过程:过夜培养TolC表达菌至饱和,以1∶100转接至600 mL培养液中,37 ℃条件下200 r/min培养至表中不同OD600值,按照组合要求加入不同浓度的IPTG并在设定条件下诱导,每组合进行3组重复。收取1 mL诱导菌液,沉淀加入300 μL 2×SDS Loading Buffer,沸水浴变性TolC蛋白5 min,通过SDS-PAGE电泳获得不同诱导条件下TolC蛋白的表达图谱。使用软件Phoretix 1D和SPSS 13.0分别进行表达图谱光密度和不同因子显著性分析。
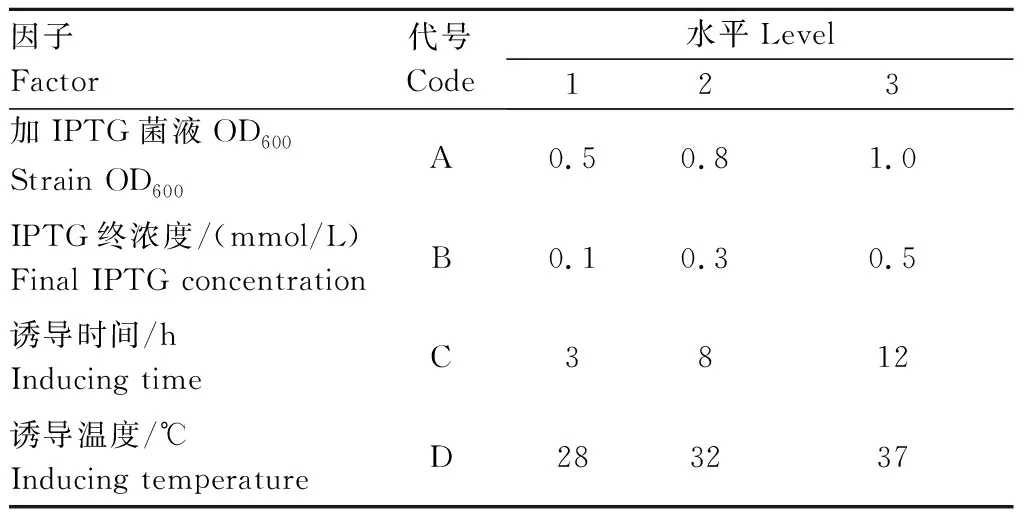
表1 TolC表达条件优化试验的因子与水平
1.2.5 TolC蛋白抗血清的制备及特异性与效价检测 昆明鼠试验组和对照组各10只。取纯化的TolC蛋白100 μg混合100 μL弗氏完全佐剂,腹腔注射免疫小鼠。14 d后,等量蛋白混合100 μL弗氏不完全佐剂,再次免疫小鼠。21 d后,进行第3次免疫,对照组免疫PBS。7 d后小鼠经眼球取血,4 ℃静置待血清析出,3 000 r/min离心10 min,获取抗血清于-80 ℃保存。采用Western blot检测TolC蛋白抗血清特异性与效价,方法如下:SDS-PAGE电泳嗜水气单胞菌全蛋白,200 mA转PVDF膜40 min,PVDF膜充分封闭2 h后与不同稀释倍数(1∶200、1∶400、1∶800、1∶1 600、1∶3 200)的小鼠抗血清于37 ℃轻摇孵育40 min(对照为阴性抗血清),再与1∶3 000倍稀释的二抗于37 ℃轻摇孵育1 h,洗涤后通过DAB显色法确定TolC蛋白抗血清的特异性。
1.2.6 体外模拟TolC蛋白抗血清与细菌的相互作用 采用ELISA[17]检测TolC蛋白抗血清与3种鱼类致病菌的相互作用:分别培养嗜水气单胞菌、荧光假单胞菌和溶藻弧菌至OD600约1.0,菌体用1 %的甲醛生理盐水80 ℃灭活,生理盐水调整菌液OD600=0.2,分装为1 mL/管(菌量108cfu),小管菌分别与100 μL不同稀释倍数的TolC蛋白抗血清(1∶400、1∶800、1∶1 600、1∶3 200、1∶6 400)孵育90 min,对照为阴性血清。菌体洗涤后与200 μL 1∶3 000倍稀释的二抗孵育1 h,洗涤菌体并混合20 μL PBS至酶标板中,加入200 μL TMB显色液,室温避光显色10 min,加入50 μL 2 mol/L H2SO4终止反应,450 nm处读数。
2 结果与分析
2.1 TolC蛋白的生物信息学分析
2.1.1 同源性与系统发育分析 通过GeneDoc软件获取不同菌株TolC氨基酸序列多重比对结果(图1),不同菌属间TolC蛋白同源性较差。利用MEGA软件构建TolC系统发育树(图2),发现不同种类气单胞菌间亲缘关系相对于其他菌株更近,推测TolC蛋白可能为不同种类气单胞菌提供交叉免疫保护作用。
2.1.2 理化性质、结构与功能预测 ProtParam数据库分析结果显示,TolC蛋白含有452个氨基酸,等电点为5.85,半衰期大于10 h,不稳定指数为34.43,属于稳定蛋白;亲水性图谱显示,氨基酸最大分值为2.256,最小为-2.089,亲水性平均值为-0.268,为亲水性蛋白(图3A);跨膜结构预测图谱(图3B)显示,TolC蛋白具有跨膜结构,但可信度较低;信号肽预测结果(图3C)显示,TolC蛋白无信号肽序列;SOPMA软件二级结构预测显示,α-螺旋占全序列61.1%,无规则卷曲占27.4%,延伸链占11.5%(图3D)。SWISS-MODEL软件三级结构预测结果显示,TolC蛋白的三维结构呈孔状(图3E);通过STRING数据库构建蛋白质互作网络,发现有10种蛋白质可与TolC蛋白相互作用,其中来源于嗜水气单胞菌的蛋白AHA_3508、3507、3506与TolC蛋白作用关系最为紧密(图3F)。
2.2 TolC重组质粒的构建及蛋白质表达纯化
利用引物Primer-F、Primer-R扩增TolC基因,电泳检测显示在约1 300 bp处存在单一条带(图4A),大小与NCBI数据库公布的TolC大小为1 359 bp一致。重组质粒pET-32a-TolC经BamHⅠ和XohⅠ 双酶切,获得约1 300 bp的目标条带,大小符合理论值(图4B)。目的基因测序鉴定结果显示与 NCBI 数据库所公布序列一致,证实成功构建重组质粒。将重组质粒转化至E.coliBL21获得TolC蛋白表达菌株,经IPTG诱导后,电泳结果显示,在约70 ku处目标蛋白成功表达;采用包涵体洗涤和SDS-PAGE电泳切胶法获得了较高纯度的TolC蛋白(图4C)。
2.3 TolC蛋白表达条件的优化
收取不同组合条件下的诱导菌体,经SDS-PAGE电泳获得不同诱导条件下TolC蛋白的表达图谱(图5),图谱光密度值分析结果见表2,所得数据极差和方差分析如表3和表4所示。由表3可看出,在诱导TolC蛋白表达时,最佳条件组合为A3B1C2D3,即在菌液OD600为1.0时如入终浓度为0.1 mmol/L的IPTG,37 ℃诱导8 h。表4结果显示,诱导剂IPTG浓度达到显著性,由此可知,诱导剂IPTG浓度对于TolC蛋白的高效表达影响较大。
2.4 TolC蛋白抗血清的特异性与效价检测
Western blot结果显示,TolC蛋白抗血清与TolC特异性结合,呈现出明显的单一条带,阴性对照无条带。表明TolC蛋白具有良好的免疫原性,制备获得特异性较好的TolC蛋白抗血清,抗血清效价达到1∶3 200(图6)。
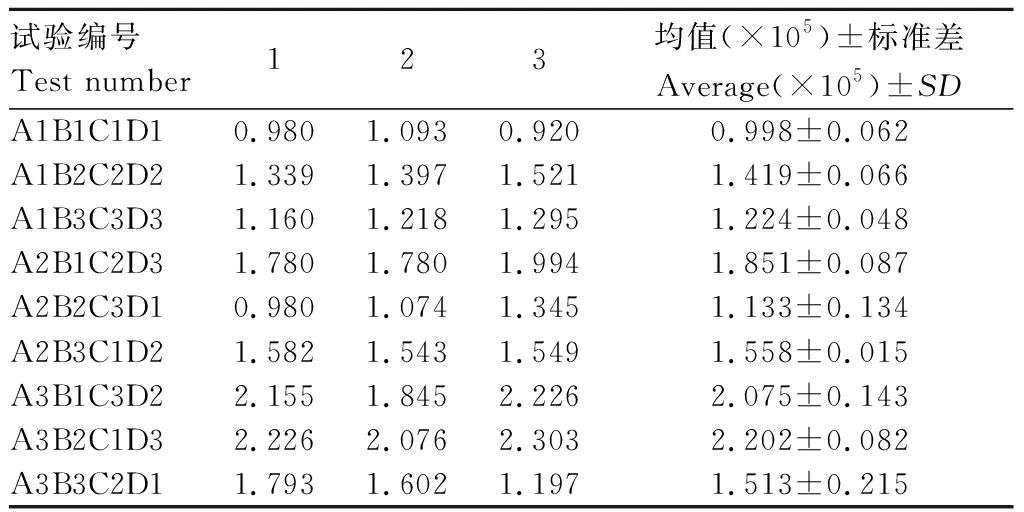
表2 TolC表达图谱光密度分析Tab.2 Optical density analysis of TolC expression map
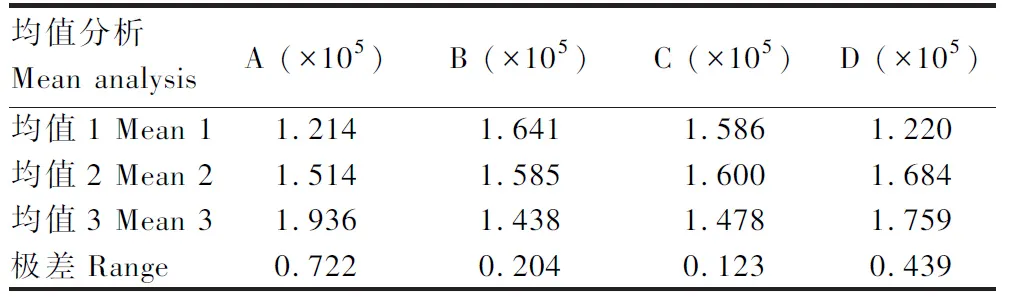
表3 TolC表达图谱光密度数值的极差分析Tab.3 Range analysis of optical density of TolC expression map
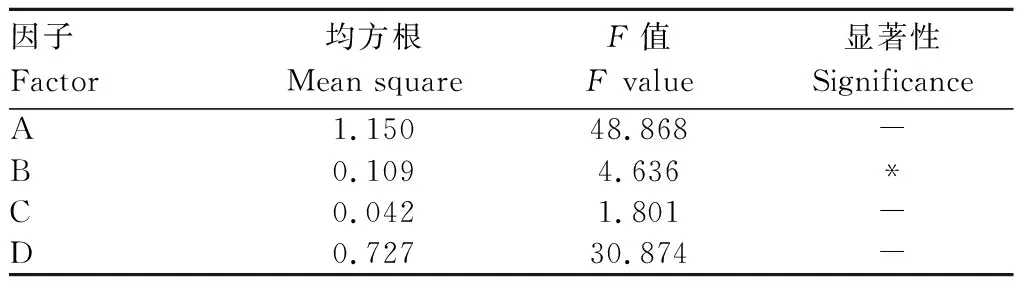
表4 TolC表达图谱光密度数值的方差分析Tab.4 Variance analysis of optical density of TolC expression map
2.5 TolC蛋白抗血清与嗜水气单胞菌的相互作用
采用ELISA检测TolC蛋白抗血清与3种鱼类致病菌的体外相互作用,结果显示,TolC蛋白抗血清与嗜水气单胞菌、荧光假单胞菌以及溶藻弧菌在体外均存在相互作用,且随着抗血清稀释倍数的增大,两者结合能力逐渐减弱(图7)。其中TolC蛋白抗血清与嗜水气单胞菌的相互识别最为紧密,当抗体滴度达到1∶6 400时,仍可检测到两者的相互作用。由此可见,TolC蛋白具有良好的抗原性,TolC蛋白抗血清可通过形成抗原(病原菌)-抗体复合物,再结合抗原呈递作用,实现动物体内病原菌的清除。
3 结论与讨论
生物信息学可准确预测蛋白质理化性质、结构与抗原表位,为蛋白质功能研究提供参考价值[18]。本研究中,同源性和进化关系分析结果显示,不同菌属细菌间TolC蛋白同源性较差,说明不同细菌间TolC蛋白差异较大,而不同种类的气单胞菌间亲缘关系较近。据此推测,TolC蛋白作为免疫原产生的抗体可能在不同种类的气单胞菌间存在交叉免疫保护作用。此外,TolC蛋白二级结构预测发现,无规则卷曲占比达27.4%,该结构易扭曲盘旋,暴露在TolC蛋白外层,成为优势细胞抗原表位的可能性较大,这为抗原表位的预测提供了依据[18]。
多克隆抗体制备简单、可结合靶蛋白的多个抗原表位,而外膜蛋白作为嗜水气单胞菌的主要毒力因子之一,能够激发机体产生高水平保护性抗体[9,19]。因此,利用原核表达纯化的蛋白质免疫动物是制备多克隆抗体的常见方法。李海宾等[20]利用鼠伤寒沙门菌SseB和SseL蛋白免疫小鼠制备了特异性多抗,吕莫然等[21]将纯化的猪细小病毒7型cap蛋白免疫小鼠,制备了高效价的鼠源多克隆抗体。本研究将纯化的嗜水气单胞菌TolC蛋白免疫小鼠,获得了特异性较好的TolC蛋白抗血清,效价达到1∶3 200。体外模拟试验结果显示,TolC抗血清与嗜水气单胞菌、荧光假单胞菌、溶藻弧菌存在相互作用,进一步验证了TolC蛋白具有良好的抗原性,这与YANG等[15]、张志强等[16]关于沙门氏菌和迟缓爱德华氏菌TolC蛋白的研究结果相似,均证实了TolC蛋白具有良好的免疫原性和抗原性。由此推测,嗜水气单胞菌TolC蛋白也可能对一些其他的鱼类致病菌具有良好的免疫原性,发挥交叉免疫保护功能。
蛋白质表达由于受到表达宿主的影响,其往往具有最佳表达条件。本研究中,菌液OD600为1.0、IPTG终浓度为0.1 mmol/L、37 ℃诱导8 h时,TolC蛋白获得最大表达量。ZHAO等[22]研究发现,诱导剂TPTG具有一定毒性,且高浓度的 IPTG会导致大量包涵体产生,降低了可溶性蛋白的表达。伍娜娜等[23]研究发现,长时间诱导会导致蛋白质被细菌蛋白酶降解,不利于蛋白质的高效表达。本研究也发现,低浓度的IPTG、适度的诱导时间更利于TolC蛋白的高效表达,该结果为工业生产上大量制备TolC蛋白提供了理论依据。
综上所述,嗜水气单胞菌外膜蛋白TolC为孔状蛋白,在气单胞菌属间进化保守,具有较强的免疫原性和抗原性,并可能对不同鱼类致病菌存在交叉免疫保护作用,可成为防治嗜水气单胞菌感染的疫苗候选抗原。

