富血小板血浆对人慢性难愈创面肉芽组织成纤维细胞体外增殖和迁移的影响▲
张铁凝 李 全 巴 特 邵天喜 李 芳 王凌峰
(1 内蒙古科技大学包头医学院,包头市 014060,电子邮箱:btyxyztn@163.com;2 内蒙古包钢医院烧伤外科,包头市 014010)
慢性难愈创面是指各种原因形成的经1个月以上治疗未愈合也无明显愈合倾向的创面[1]。随着我国社会经济的发展,人口老龄化以及人民生活方式的改变,慢性疾病谱也发生了变化,慢性难愈创面的发病率逐渐增高。目前,治疗慢性难愈创面的主要方法有手术治疗、换药、负压引流等,但这些方法治疗时间长,治疗费用高,而且效果不佳[2-3]。富血小板血浆(platelet-rich plasma,PRP)作为组织工程研究的热点,为慢性难愈创面的治疗提供了新的思路。本研究从慢性难愈人创面肉芽组织中分离出成纤维细胞,观察并比较不同培养基培养下成纤维细胞的生物学行为,为PRP治疗慢性难愈创面提供理论依据。
1 材料及方法
1.1 标本来源、主要仪器及试剂
1.1.1 标本来源:收集在内蒙古包钢医院慢性创面诊疗管理中心行慢性创面清创术的患者术后废弃的肉芽组织,并抽取患者静脉血50 mL。纳入标准:(1)患者年龄18~65岁;(2)创面超过1个月未愈合,最近2周创面未见明显缩小;(3)创面处于非急性感染期(如创面局部出现明显的红肿热痛,或较多脓性分泌物,或明显异味);(4)各种原因导致的皮肤全层缺损,如Ⅲ度烧伤、严重毁损伤。上述标本取样均获得患者同意并且签署知情同意书。
1.1.2 主要试剂及仪器:医用离心机和PRP制备用套装购自山东威高医疗器械有限公司(鲁威械备20150044);海藻酸钠、Ⅰ型胶原酶、胰蛋白酶-乙二胺四乙酸、无水氯化钙、人胶原酶Ⅰ型酶联免疫分析试剂盒购自Sigma 公司(试剂盒批号分别为:W201502、SCR103、59418C、C1016、CC050);杜氏改良伊格尔培养基(Dulbecco′s modified Eagle medium,DMEM)培养基、胎牛血清购自Gibco公司(试剂盒批号分别为:A4192101、12664025)。
1.1.3 PRP及水凝胶的制备:采用PRP制备用套装制备PRP,采集全血,室温下4 000 r/min离心20 min后弃去最下层红细胞,再进行第2次离心(室温下4 000 r/min离心30 min),中间棕黄色层即为PRP,见图1。水凝胶参考文献[4]制备。

图1 PRP的制备过程
1.2 实验方法和观察指标
1.2.1 成纤维细胞的分离和鉴定:收集患者慢性创面的肉芽组织,无菌条件下用含双抗(青霉素100 U/mL、链霉素100 U/mL)的磷酸盐缓冲液(phosphate buffered saline,PBS)(购自Sigma公司)充分洗涤去污染,剪成约2 mm×2 mm小块,用含双抗的PBS洗涤3次,剪碎至糊状,转移至含0.1% Ⅰ型胶原酶(1 ∶2)离心管中,37℃水浴恒温摇床振荡消化2 h。在显微镜下观察可见细胞后,加入等体积的含胎牛血清的DMEM液终止消化。收集细胞滤液,1 500 r/min离心10 min,弃上清,用含胎牛血清的DMEM重悬,收集细胞,以1×105个/mL的密度接种于T25培养瓶中培养,原代细胞生长融合近100%时,弃培养液,加入胰蛋白酶-乙二胺四乙酸消化,弃消化液,加入-乙二胺四乙酸,轻吹打贴壁细胞成单细胞,以1 ∶2的比例传代接种,20 h后细胞铺满瓶底,继续传代培养细胞至第3代,显微镜观察细胞大体形态,通过免疫组织化学染色检测波形蛋白(波形蛋白抗体购自英国Abcam公司,批号:ab92547)对成纤维细胞进行鉴定。
1.2.2 成纤维细胞生长曲线测定:取第3代成纤维细胞,分为胎牛血清组、水凝胶组和PRP组,分别用含胎牛血清、水凝胶、PRP的DMEM连续培养8 d,每组细胞的浓度均为103个细胞/孔,每天从各组培养基中取少量培养物,分别用结晶紫染色后采用血球计数板计数,每天每组细胞计数3次后取平均值,绘制细胞生长曲线。实验重复5次。
1.2.3 细胞划痕实验:取第3代成纤维细胞,分为胎牛血清组和PRP组,分别接种于12孔板中培养(细胞的浓度为5×105个细胞/孔),细胞长满后,参考文献[5]用200 μL移液管尖端在培养板底层人为划痕,观察细胞在划痕实验24 h、48 h、72 h后的融合情况。实验重复5次。水凝胶组未做细胞迁移试验。
1.3 统计学分析 采用SPSS 17.0软件进行统计学分析。计量资料以(x±s)表示,两组间比较采用成组设计两样本t检验,多组间比较采用单因素方差分析。以P<0.05为差异具有统计学意义。
2 结 果
2.1 成纤维细胞的形态和鉴定结果 分离的细胞刚贴壁时,细胞呈短梭形或不规则形,传代后细胞形态均一,排列规则。细胞密度低时细胞排列疏松;密度高时细胞排列呈平行状或漩涡状。胞体狭长、透亮,胞浆丰富,胞核清晰呈卵圆形,居中,偶见双核。免疫组织化学染色结果显示细胞胞质呈现棕黄色,细胞核呈淡紫色,提示所获得的细胞为成纤维细胞,见图2。
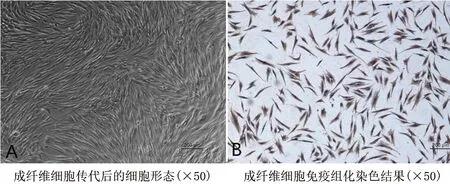
图2 人创面肉芽组织成纤维细胞形态学观察和免疫组化实验结果
2.2 3组成纤维细胞的增殖情况 3组成纤维细胞均生长良好,培养的第2天,细胞生长速度开始增快,第3~5天细胞增殖活跃。胎牛血清组细胞于培养的第5天生长达顶峰,第6~8天生长速度减慢;水凝胶组细胞于培养的第6天生长达顶峰,第7~8天生长速度减慢;PRP组细胞持续增殖,见图3。培养第5、6、7、8天,PRP组细胞数量多于胎牛血清组和水凝胶组,第6、8天水凝胶组细胞数量多于胎牛血清组(均P<0.05),其他培养时间点3组细胞计数差异无统计学意义(均P>0.05),见表1。
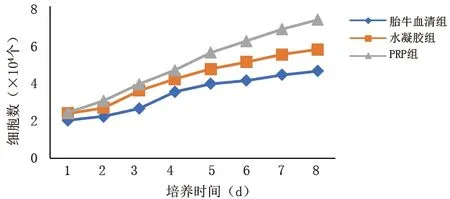
图3 不同培养基成纤维细胞的生长曲线

表1 3组成纤维细胞的增殖情况的比较(x±s,×104个)
2.3 两组成纤维细胞划痕实验迁移面积的比较 划痕实验24 h时,PRP组成纤维细胞迁移面积与胎牛血清组比较,差异无统计学意义(P>0.05);划痕实验第48 h、72 h,PRP组成纤维细胞划痕迁移面积均大于胎牛血清组(均P<0.05),见表2和图4。
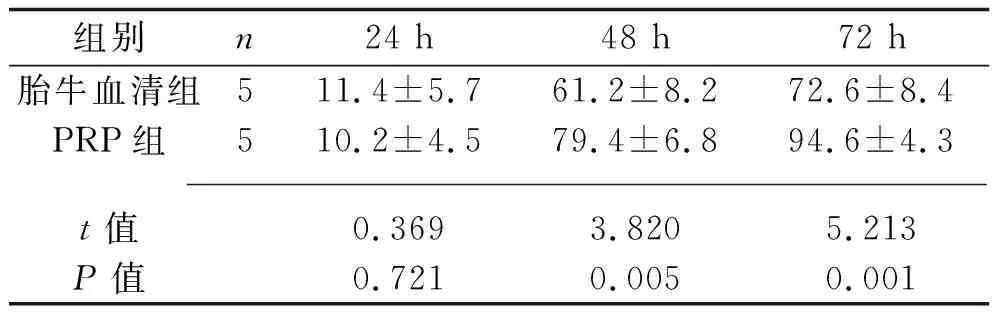
表2 两组成纤维细胞划痕实验迁移面积的比较(x±s,%)

图4 成纤维细胞划痕实验(×50)
3 讨 论
成纤维细胞是创面愈合的主要修复细胞,其生理功能受到抑制后[2-3],可影响创面的正常愈合,甚至导致慢性难愈创面的形成。如何恢复成纤维细胞的正常生理功能成为治疗慢性难愈创面的新思路。以往针对成纤维细胞的研究多采用正常皮肤组织或瘢痕组织作为标本,虽然取材方便,但并不能反映慢性创面皮肤组织的特点。本研究直接收集慢性难愈创面肉芽组织,成功分离出成纤维细胞用于后续实验。
喇文军等[6]发现胎牛血清可以体外促进人皮肤成纤维细胞的增殖,也有研究显示PRP可以促进成纤维细胞的生长和迁移[7-9]。PRP是从血液提取的血小板浓缩物,研究已证明[3,7-11]PRP中含有成纤维细胞生长因子、血小板衍生生长因子、表皮生长因子、血管内皮生长因子、胰岛素样生长因子、转化生长因子等多种生长因子。而PRP中的生长因子均可促进创面愈合[12-14]。目前,PRP已在整形外科、骨科等科室中得到广泛应用[10,15]。为探讨PRP对慢性难愈创面的治疗作用,本研究分别采用含胎牛血清、水凝胶和PRP的培养液培养成纤维细胞,观察细胞生长迁移情况。结果显示,培养第5天起,PRP组的成纤维细胞数量多于其他两组,划痕实验第48 h、72 h,PRP组细胞划痕迁移面积均大于胎牛血清组(均P<0.05),提示与胎牛血清相比,PRP可更好地促进人创面肉芽组织成纤维细胞的增殖和迁移,与Cho等[7-9]的研究结果相似。其原因可能是PRP中的血浆为血小板和成纤维细胞提供了部分营养物质、电解质、激素和生长因子,调节血小板和细胞的生理活动,同时血小板可持续缓慢释放各类生长因子,促进细胞增殖。这表明PRP或可通过影响创面成纤维细胞的生长和迁移,对创面愈合起促进作用,这为PRP治疗慢性难愈创面提供了新的思路。
本研究采用PRP制备用套装二次离心法制备PRP,制备过程无须中途更换离心管,减少了血小板的激活和污染,同时保留了部分的血浆成分。同时,与传统组织工程材料相比,PRP可以采用自体血液制备[11],操作相对简单,同时降低了异体或异种材料潜在的生物风险,也减轻了患者的负担,这为PRP的临床应用提供了方便。但临床上应用PRP治疗创面时还需考虑以下问题:(1)一次制备的PRP数量通常不足以用于整个治疗过程,如何有效地延长PRP体外保存时间,避免多次采血制备,从而减轻患者痛苦;(2)PRP能否联合抗生素应用于创面,如何联合,是否会影响PRP的效应;(3)PRP的使用是否有创面过度增生形成瘢痕的风险。这些问题都需要进一步研究。
综上所述,与胎牛血清相比,采用PRP培养人成纤维细胞能更有效地促进细胞的增殖和迁移,这为PRP临床治疗慢性难愈创面提供新的理论依据。

