Cronkhite-Canada综合征1例
钟雪晶,赵芮,张倩,贾胜男,张传辉,邵雪,金珍婧
Cronkhite-Canada综合征(Cronkhite-Canada syndrome,CCS),又称息肉-色素沉着-脱发-指(趾)甲营养不良综合征。该病最早在1955年由Cronkhite和Canada首先报道[1],1966年命名为Cronkhite-Canada syndrome[2],是临床上一类非遗传性、罕见疾病,无明显家族聚集性,主要分布人群为中老年男性[3]。相关回顾性分析报道其发病率约为1/100万[4],我国相关病例报道仅80余例[5]。目前临床对CCS认知较少,尚未明确发病机制及一致的诊疗意见。为提高对CCS的认识,现将我院收治1例CCS患者分析报道如下。
1 病历资料
患者,男,69岁,因“间断腹痛、腹泻4个月”于2020年4月7日入院。患者4个月前无明显诱因出现腹痛,呈间断性,性质为胀痛,以右上腹、脐周为著,进食后加重,与体位无关,无放散痛;伴腹泻,约4~5次/d,为黏液脓血便;伴乏力;伴味觉减退、反酸、烧心。于当地医院行胃、肠镜检查提示“慢性非萎缩性胃炎、胃颗粒样增生(不排除淋巴滤泡增生或肠上皮化生)、十二指肠球炎、肠道黏膜弥漫性糜烂(炎性肠病?伪膜性肠炎?菌痢?)、肠息肉”;给予抑酸、保护胃黏膜、抗炎、补液等对症及支持治疗,病情稍缓解。患者为进一步明确腹痛及脓血便原因就诊于我院,病程中食欲欠佳,体重减轻约15 kg。既往:“糖尿病”病史10余年,自行间断口服降糖药(具体用药不详),血糖控制尚可,有吸烟史50余年,10支/d,无饮酒史。查体:营养不良,毛发分布稀疏(图1);面部及双手色素沉着,指(趾)甲增厚、卷曲、变黄(图2);腹部凹陷,腹软,右上腹、脐周压痛,无反跳痛,肠鸣音5~6次/d。幽门螺杆菌阳性。自身免疫性肝病检测:52 kDa蛋白抗体(WB)阳性(++)。肝功:谷丙转氨酶5 U/L,谷草转氨酶7 U/L,白蛋白29.9 g/L。离子:钾3.24 mmol/L,钙1.97 mmol/L。便常规+潜血,隐血(胶体金)阳性;便潜血定量检测2 227 ng/mL。全腹CT:右侧升结肠走行区管壁明显增厚,周围见多发淋巴结显示,较大者短径约为5 mm,诊断提示升结肠占位。胃镜示食管距门齿34 cm见一0.5 cm×0.6 cm黏膜粗糙面,色泽减退,胃窦、十二指肠球部及球后黏膜充血、肿胀、色红,呈铺路石样改变(图3);活检病理示食管鳞状上皮增生,伴中度-重度非典型增生,未见确切浸润性病变,胃窦黏膜慢性炎,伴急性炎细胞浸润,腺体增生伴肠上皮化生,十二指肠黏膜慢性炎,伴急性炎细胞浸润,腺体增生,部分腺体扩张。肠镜示全大肠黏膜粗糙,呈密集小铺路石样改变,血管纹理消失,并见多处黏膜充血、肿胀、色红,形状多样,多呈息肉样、条索样,局部密集(图4);病理示回肠末段黏膜慢性炎,回盲部升结肠黏膜慢性炎伴急性炎细胞浸润,间质有水肿变性,内见较多嗜酸性粒细胞浸润,腺体增生,升结肠管状腺瘤,直肠黏膜慢性炎,伴急性炎细胞浸润。诊断:Cronkhite-Canada综合征。治疗上给予口服美沙拉嗪肠溶片(1.0 g/次,3次/d)抗炎治疗,同时结合抑酸、抗感染、补液、纠正电解质紊乱、补充白蛋白等对症支持治疗,1个月后患者无明显腹痛、腹泻症状,乏力较前明显缓解,食欲好转,萎缩指甲脱落,有新指甲生出,患者出院。嘱患者出院后继续口服美沙拉嗪肠溶片(1.0 g/次,3次/d),患者仍在持续随访中。
2 讨论
2.1 发病机制
CCS病例罕见,目前机制尚不明确,有越来越多的证据支持自身免疫机制。首先,既往有研究证实CCS息肉处有IgG4浆细胞浸润或免疫组化染色后IgG4呈阳性[6];其次,CCS患者多合并自身免疫性疾病,如风湿性关节炎、系统性红斑狼疮、硬皮病等或血清抗核抗体检测阳性[7],而本文所报道患者血清52 kDa蛋白抗体检测也呈阳性;同时在CCS疾病的经验性治疗中,激素类药物在诱导CCS缓解中是有效的,1985—2017年我国报道的68例患者中有27例接受激素治疗,其中22例病情好转[8],综合以上证据可考虑CCS与自身免疫反应相关。除此之外,国内外学者考虑感染、炎症、遗传易感、基因突变、砷中毒、精神压力、劳累、应激反应、微量元素缺乏等因素在CCS的发病中起着关键作用[6, 9-10]。
2.2 临床表现
CCS疾病主要有三大类特征表现:
(1)胃肠道弥漫性息肉:主要以胃、结直肠多见,其次为十二指肠及小肠,食管罕见,内镜下息肉多形态、大小不一,无蒂或亚蒂,呈结节状或不规则形状,息肉黏膜充血水肿明显,表面或有糜烂、溃疡,组织学上有显著的腺体增生,囊性扩张,伴炎性细胞浸润,通常以嗜酸性粒细胞为著,息肉的病理类型主要以增生性息肉、腺瘤性息肉和错构瘤性息肉常见[11-14],同时CCS息肉具有一定的恶变倾向,慢性全身黏膜炎症可促进肿瘤转化,增加结肠、直肠癌的发病风险[6,15]。
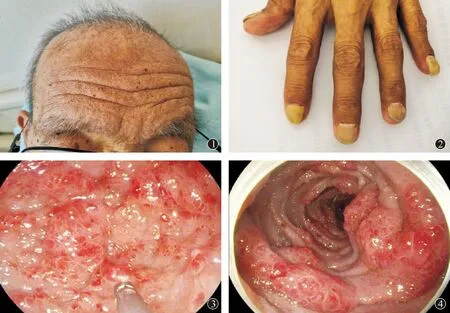
图1 毛发分布稀疏; 图2 双手色素沉着,指(趾)甲增厚、卷曲、变黄; 图3 胃窦黏膜充血、肿胀、色红,呈铺路石样改变; 图4 结肠黏膜粗糙,呈密集小铺路石样改变,血管纹理消失,并见多处黏膜充血、肿胀、色红,形状多样,多呈息肉样、条索样
(2)外胚层改变:有脱发,指(趾)甲营养不良,出现指(趾)甲发黄、萎缩、脱落,皮肤色素沉着等。
(3)胃肠道症状:腹痛、腹泻、味觉障碍等,以及由于摄入不足、吸收不良及胃肠道丢失所致的体重减轻、低蛋白血症、低钾、低钙血症表现。
2.3 临床诊断
针对CCS,目前临床上并没有特定的诊断标准,同时由于病例罕见,临床上对该病认识较少,容易导致漏诊、误诊的发生。CCS诊断主要依据病史、症状、体格检查、内镜表现综合考虑,结合本例患者总结为以下几点:①中老年患者,男性多见,少见家族聚集性发病;②主要胃肠道症状为腹痛、腹泻;③体格检查时可发现患者毛发分布稀疏,指(趾)甲发黄、萎缩、脱落,皮肤色素沉着;④胃肠道多发息肉。
2.4 治疗方案
由于CCS的发病机制尚未明确,现该病的治疗亦无统一的指南及共识出台,仅在个案报道中提供一些经验性治疗方案。有研究者报道激素联合美沙拉嗪治疗CCS,逐渐减量,3年内息肉完全消失,停用激素,用药4年停用美沙拉嗪,随访14年患者持续完全缓解[16]。Langevin等[17]人在CCS病例治疗中加入免疫抑制剂西罗莫司后,患者的临床和内镜表现分别在2周和8周内获得明显效果。Okamoto等报道对CCS合并幽门螺旋杆菌感染的患者应用克拉霉素、阿莫西林和兰索拉唑行根除治疗,3个月后患者临床症状消失,血清白蛋白水平恢复正常,8个月后外胚层改变消失,复查肠镜,息肉情况明显改善[18]。也有相关研究显示,中医中药、抗抑郁类药物等可使CCS患者的症状得到缓解[19-20]。综上,现CCS的治疗手段主要包括皮质类固醇、非甾体类抗炎药、5-氨基水杨酸、免疫调节剂、抗生素、质子泵抑制剂、抗抑郁药物、中药及营养支持等,同时针对胃肠道息肉可考虑行内镜下切除,可改善因息肉所致的吸收不良及肠道营养丢失、腹泻等症状,还可以防止息肉发生恶变。
由于CCS疾病罕见,常常出现漏诊及误诊,使患者无法得到及时有效的诊疗,致病情反复发作,预后较差,甚至出现恶病质、感染、电解质紊乱及息肉恶变等严重并发症而死亡。但相信随着对本病的不断探索及认识水平的提高,以及内镜技术的不断发展,CCS能够被早期有效的筛查诊断,及时治疗,预后进一步改善。

