构建高结晶TiO2@无定形TiO2同质核壳结构及光催化析氢性能应用
王洪丽, 郭昌梁, 李富祥, 蒋保江
(黑龙江大学 化学化工与材料学院,哈尔滨 150080)
0 引 言
科研工作者经过多年的探索,发现可再生、无污染的太阳能可作为化石能源的替代品。为了提高对太阳能的利用效率,通常把太阳能转化成其他能源,如氢能、电能、化学能等。氢能作为一种绿色、高效的能源在替代化石燃料上被人们寄予厚望[1]。光催化制氢技术作为把太阳能转化为氢能(化学能)的一种简便的制氢方法被广泛研究。光催化技术除了应用于分解水制氢外,还广泛地应用于降解污染物、CO2还原、有机物转化等领域[2]。
TiO2作为一个典型的无机半导体光催化剂被广泛地应用于光催化的各个领域。其有廉价、化学稳定性高、催化效率高和应用广泛等优点[3]。但是它同时也具有带隙宽、光生电子-空穴对易复合等缺点。需要提出一些策略对其进行修饰改性来提高其性能[4]。
NH2-MIL-125(Ti-MOF)是一个以Ti为金属位点的典型MOF,在光催化领域被广泛地应用,有着MOF所具备的通用的优点,如大的比表面积、规则的孔隙结构和特殊的形貌等[5-6]。目前对于NH2-MIL-125在催化领域已经被广泛的研究,但对于其衍生物的研究较少。由于Ti-MOF具备的优点对于催化领域有着极强的吸引力[7],设想它所衍生的氧化物(TiO2)能否继承这些优点,表现出优异的催化性能[8-10]。
目前对于TiO2的研究主要集中在锐钛矿相和金红石相上,不同结晶度TiO2的复合结构在催化领域的研究还比较少[11-13]。根据研究发现构建核壳结构能够改善TiO2中光生电子-空穴对的分离效率[14],抑制电子-空穴的复合。煅烧后的NH2-MIL-125(Ti-MOF)具有较稳定的结构,所以拟设计以NH2-MIL-125(Ti-MOF)衍生的高结晶TiO2为前驱体模板,钛酸四丁酯在其表面原位水解形成一层均匀的无定形TiO2纳米片,得到高结晶TiO2@无定形TiO2同质核壳结构(简写为C-TiO2@A-TiO2),煅烧后的NH2-MIL-125以及合成的同质核壳结构的带隙结构较小,能够有效地利用可见光,将其应用于光催化分解水制氢。合成的C-TiO2@A-TiO2具有较好的析氢效率(11.43 mmol·h-1·g-1),归因于其较大的比表面积,为析氢反应提供更多的活性位点。
1 实验部分
1.1 NH2-MIL-125(Ti-MOF)的合成
取0.54 g的2-氨基对苯二甲酸,将其溶解在9 mL四氢呋喃和1 mL甲醇的混合溶剂中,超声10 min,然后搅拌5 min,加入5 mL钛酸四丁酯,继续搅拌30 min,形成均匀混合溶液。随后,将上述溶液转移到25 mL的聚四氟乙烯内衬的高压水热反应釜中,在150 ℃下反应16 h。待冷却至室温后,分别用四氢呋喃和甲醇离心洗涤多次,在80 ℃下彻夜干燥,将干燥后的样品收集用于后续的合成和表征。
1.2 M-TiO2 (源自Ti-MOF)的合成
将上述合成的Ti-MOF在马炉中经过500 ℃的高温处理得到TiO2(derive Ti-MOF),记为M-TiO2。
1.3 高结晶TiO2@无定形TiO2同质核壳结构的合成
取上述合成的M-TiO20.5 g,将其分散在60 mL乙醇和0.1 mL水的混合溶液中,超声分散均匀。然后将5 mL钛酸四丁酯和20 mL无水乙醇的混合溶液加入其中。在室温下持续搅拌反应4 h,将所得的溶液离心,用乙醇洗涤3次,在60 ℃下干燥12 h,得到高结晶TiO2@无定形TiO2(记为C-TiO2@A-TiO2)。
2 实验结果与讨论
2.1 高结晶TiO2@无定形TiO2同质核壳结构的结构表征分析
通过SEM测试来表征制备样品形貌,见图1。合成的NH2-MIL-125(Ti-MOF)的形貌为圆盘状,尺寸大约为1 μm,尺寸和形貌的分布较为均匀(图1(a))。M-TiO2的SEM图见图1(b),它是由Ti-MOF在空气中经过高温煅烧处理所得到的,与Ti-MOF相比,清楚可见M-TiO2的尺寸缩小,大约为500 nm,同时它的表面变得略微粗糙,有小的纳米粒子存在。形貌和尺寸的变化可以归因于MOF在煅烧时金属-有机骨架收缩,部分坍塌所导致。C-TiO2@A-TiO2的SEM图见图1(c),与M-TiO2前驱体相比,它的表面发生了明显的变化,在M-TiO2的表面包覆着一层尺寸较小的纳米片。

图1 SEM测试图Fig.1 SEM images

图2 制备样品M-TiO2和C-TiO2@A-TiO2的XRDFig.2 XRD pattens of M-TiO2 and C-TiO2@A-TiO2
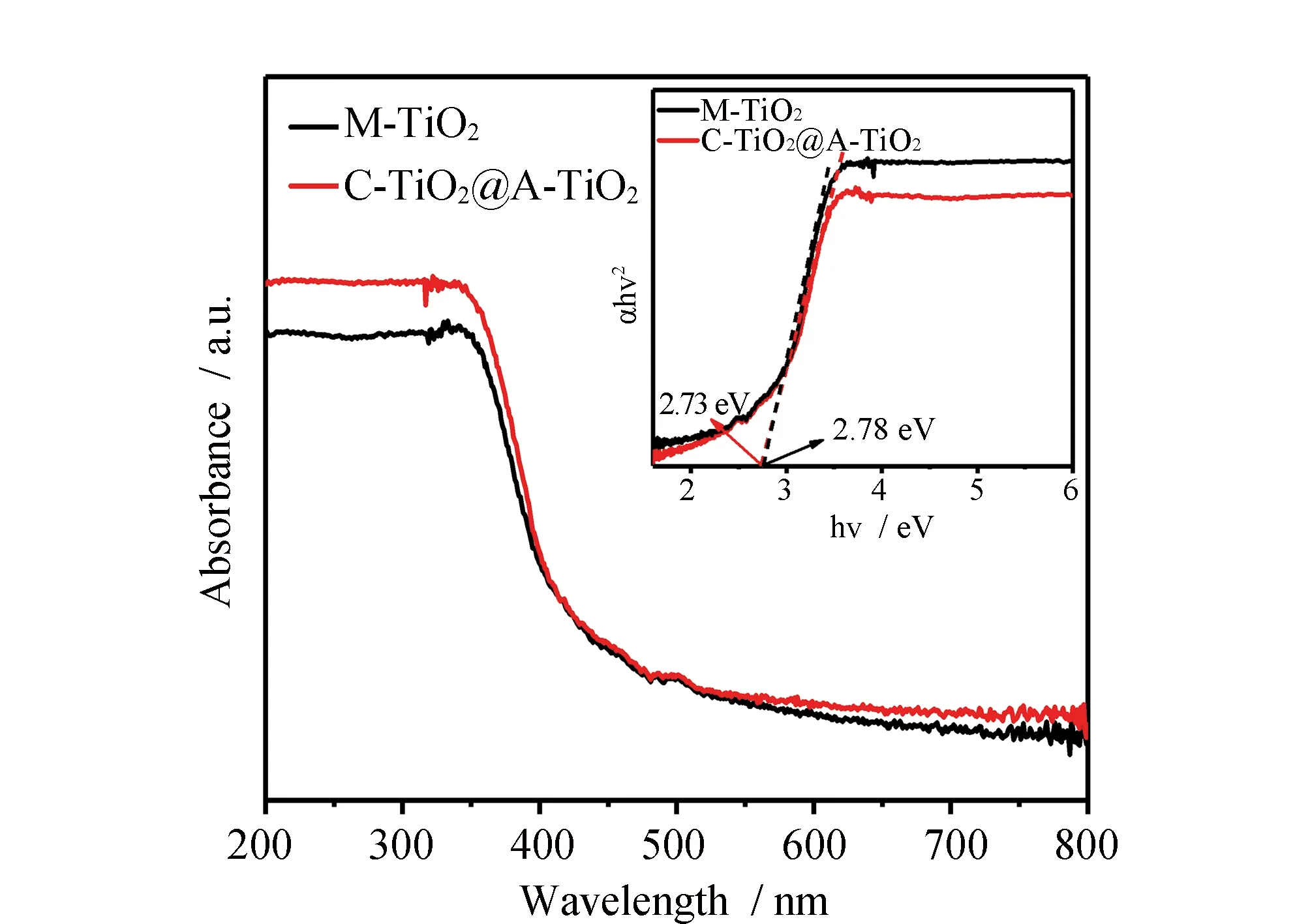
图3 M-TiO2和C-TiO2@A-TiO2的紫外-可见漫反射光谱Fig.3 UV-vis reflectance spectra of M-TiO2 and C-TiO2@A-TiO2
为了研究样品的晶体结构和组成,对所制备的样品进行了XRD测试,见图2。由图2可见,M-TiO2表现出锐钛矿相TiO2的晶体结构,这说明Ti-MOF经过高温煅烧转变为高结晶的TiO2,这与TiO2的PDF标准卡片一致(JCPDS 21-1272)。与M-TiO2相比较,C-TiO2@A-TiO2也表现出锐钛矿相TiO2的晶体结构,但是它的结晶度明显下降。是由于在M-TiO2表面生长了一层非结晶的无定形TiO2纳米片,所以它的衍生峰的位置没有发生变化,只是结晶度发生了变化,从侧面证实C-TiO2@A-TiO2的合成。
为了探究合成样品的光谱响应能力和带隙,对其进行了紫外-可见漫反射光谱测试,见图3。由图3可见,M-TiO2和C-TiO2@A-TiO2的光谱响应范围主要集中在紫外区,在200~400 nm具有较强的光谱响应能力。插图为Kubelka-Munk函数确定的带隙图,由图可见M-TiO2和C-TiO2@A-TiO2的带隙分别为2.78和 2.73 eV,这表明两种材料的带隙几乎相同。上述的结果表明合成的样品确实是C-TiO2@A-TiO2。由于材料的组成里面只有锐钛矿相和非结晶的TiO2,没有引入其它的成分,形成的是C-TiO2@A-TiO2的同质核壳结构,而非异质结构,所以M-TiO2和C-TiO2@A-TiO2的带隙几乎相同。
为了研究样品的比表面积和孔隙结构,进行了N2吸附-脱附测试。M-TiO2和C-TiO2@M-TiO2的氮吸附-脱附等温线见图4,样品中都可以观察到典型的IV等温线存在,还发现了H3型回滞环,这表明样品的表面存在狭缝状的介孔。与C-TiO2@M-TiO2相比,M-TiO2的比表面积较小,仅为32.03 m2·g-1。值得注意的是,合成的C-TiO2@M-TiO2核壳结构具有58.75 m2·g-1的高比表面积。比表面积的提高是由于在高结晶的TiO2核表面负载的无定形TiO2纳米片所导致。较大的比表面积和孔结构能够促进载流子迁移并且为表面催化反应的底物传输提供了便捷的通道,有利于提高光催化性能。
2.2 高结晶TiO2@无定形TiO2同质核壳结构的光催化性能测试
对所合成的样品进行光催化分解水析氢测试来研究所制备催化剂的催化析氢效率见图5。经过测试,发现在紫外光的照射下,M-TiO2和C-TiO2@A-TiO2的光催化析氢速率分别为7.87和11.43 mmol·h-1·g-1。与Ti-MOF衍生的纯锐钛矿相的TiO2相比,构建的不同结晶度的C-TiO2@A-TiO2的光催化析氢效率得到了一定的提升,析氢效率的提升可能归结于所合成的样品具有较大的比表面积和核壳结构的同质界面,同质界面可以促进光生载流子的迁移,分离并抑制电子-空穴对的复合。
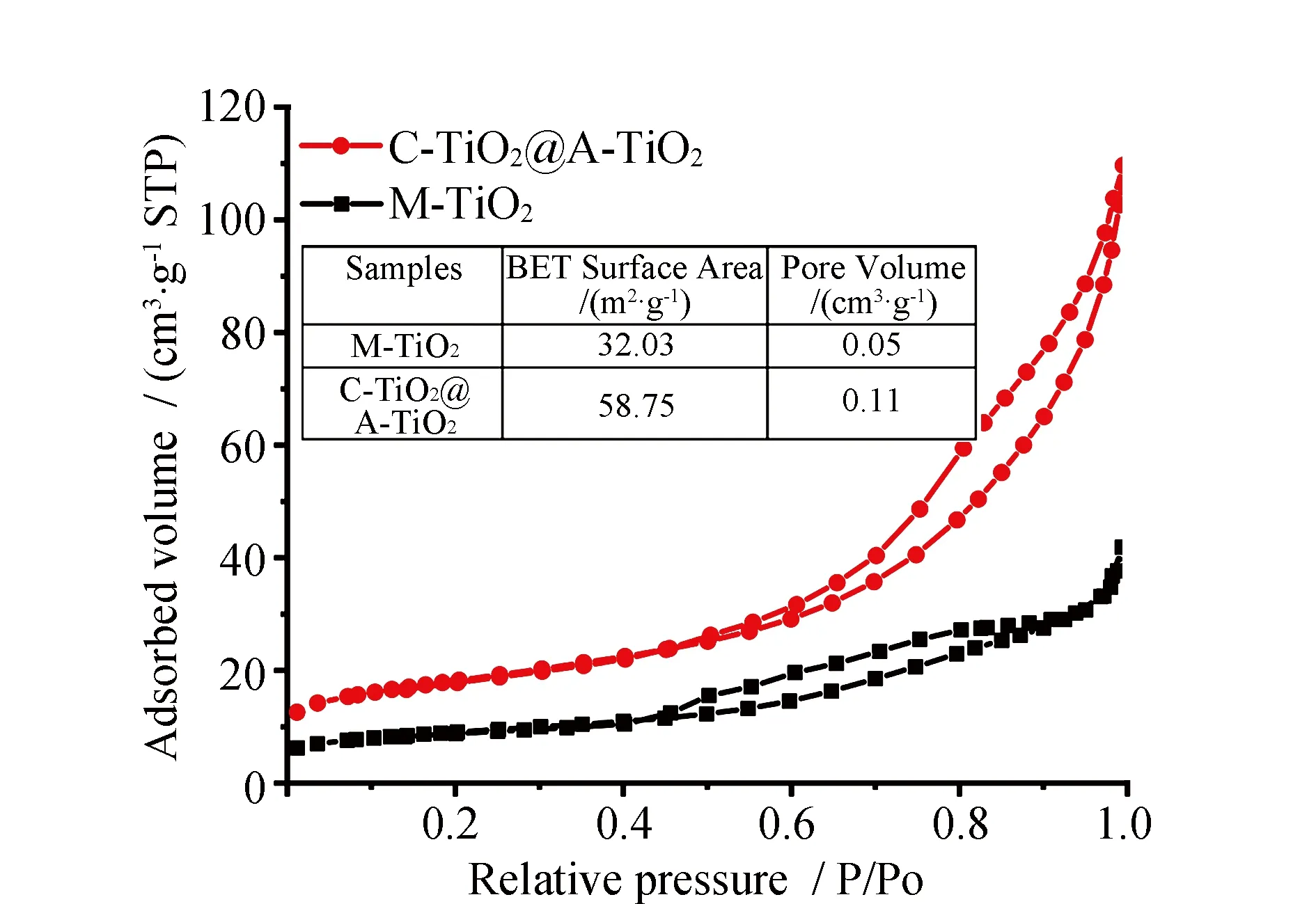
图4 M-TiO2和C-TiO2@M-TiO2的氮吸附-脱附等温线Fig.4 Nitrogen adsorption-desorption curves of M-TiO2 and C-TiO2@M-TiO2
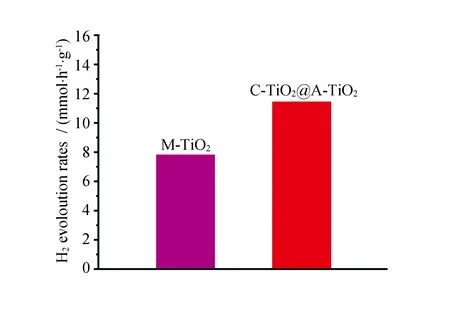
图5 M-TiO2和C-TiO2@A-TiO2在紫外光下的光催化分解水性能Fig.5 Photocatalytic water decomposition performance of C-TiO2@A-TiO2
3 结 论
通过制备NH2-MIL-125(Ti-MOF),将其经过煅烧处理得继承MOF特性的高结晶TiO2(M-TiO2),以其为模板,使钛酸四丁酯在其表面原位水解,得到高结晶TiO2@无定形TiO2(C-TiO2@A-TiO2)同质核壳结构。C-TiO2@A-TiO2的带隙与M-TiO2的几乎一样。但是,与M-TiO2相比较,C-TiO2@A-TiO2在紫外光下具有较好的析氢速率,可归因于较大比表面积和同质核壳结构的界面,此结果能够为表面催化反应提供较大的反应空间,提高载流子的迁移速率。

