棉花根际土壤古菌实时荧光定量PCR技术的建立及时空分布特征
管力慧,刘 萍,党文芳,杨红梅,牛新湘,楚 敏,李 萍,高 雁,曾 军,霍向东,张 涛,林 青,欧提库尔·马合木提,李玉国,娄 恺,史应武,3,5
(1.新疆大学生命科学与技术学院,乌鲁木齐 830052;2. 新疆农业科学院微生物应用研究所,乌鲁木齐 830091;3. 新疆特殊环境微生物实验室,乌鲁木齐 830091;4. 新疆农业科学院土壤肥料与农业节水研究所,乌鲁木齐 830091;5. 农业农村部西北绿洲农业环境重点实验室,乌鲁木齐 830091;6. 新疆库尔勒市农业技术推广站,新疆库尔勒 841000)
0 引 言
【研究意义】古菌(Archaea)作为生物领域的一类具有特殊性质,其细胞核无核膜包裹,细胞核和细胞质难区分,和细菌都属于原核生物,但是在进化树上与其有亲缘关系的却是真核生物。古菌不仅耐高温、高盐、低氧、强酸、强碱,还广泛存在湖泊、土壤等普通环境中而且含量非常高[1]。棉花连作导致棉花黄萎病等土传病害发生,影响棉花产量及品质。实时荧光定量PCR技术检测不同生育时期与地区棉花根际土壤古菌数量,有利于探索根际土壤古菌与黄萎病之间的联系以及防治棉花黄萎病。【前人研究进展】顾美英等[2]用平板计数法研究棉花的根际土壤,分析根际土壤微生物生态特征的变化情况以及根际土壤微生物特征变化与黄萎病病原菌的关系。Tellenbach等[3]建立了植物内生真菌实时荧光定量的方法。王晶等[4]运用荧光定量PCR技术和16S rDNA多态性分析对玉米不同生长时期土壤古菌多样性变化进行研究。高峰等[5]用PCR定性测定土壤病原菌,没有定量研究。2011年,肖蕊等[6]运用SYBR Green I PCR技术快速检测棉花根际病原菌数量。PCR技术的发展,该方法也可用于古菌数量的检测[7-8]。实时荧光定量PCR技术常用的检测方法有SYBR Green I法和TaqMan探针法,TaqMan探针法原理是把含荧光素的TaqMan探针加入到反应体系中,通过变性、复性和延伸TaqMan探针被切断,导致反应体系中荧光信号强度发生变化后通过标准曲线分析未知样品[9-11]。【本研究切入点】目前有关荧光定量的检测方法广泛应用于细菌和真菌的检测,在古菌上的应用较少,且国内外对棉田古菌TaqMan探针实时荧光定量的相关研究还未见报道。【拟解决的关键问题】运用TaqMan探针法检测新疆不同地区及生育时期棉花根际土壤古菌数量,研究其根际土壤古菌的数量分布特征。对根际土壤古菌群落进行测序,分析其群落组成并进行风度比较。
1 材料与方法
1.1 材 料
1.1.1 供试土样
在棉花苗期、棉花蕾期、棉花花铃期以及吐絮期对新疆北疆地区的石河子、乌苏和精河;南疆的库尔勒、图木舒克和阿拉尔以及东疆的哈密共7个地区的棉花病株根际土壤(10~15 cm)进行采样,用10目筛网将土壤过筛,混匀后装入密封袋中于4℃冰箱中保存,待测[12]。
1.1.2 主要试剂
Ezup柱式土壤基因组DNA抽提试剂盒、SanPrep 柱式DNA胶回收试剂盒、 SanPrep柱式质粒 DNA小量抽提试剂盒均来自生工生物工程(上海)股份有限公司。
1.1.3 主要仪器
德国艾本德Centeifuge 5418R型离心机(北京东南仪诚实验室设备有限公司) ;DW-40L188 型医用低温保存箱(杭州艾普仪器设备有限公司) ; TPersonal型PCR仪(杭州博日科技有限公司) ;DYCP-31E型电泳仪(北京六一仪器厂) ;WD-9413B型凝胶成像分析仪(北京市六一仪器厂) ;OSE-260型超微量分光光度计(济南利科医疗器械有限公司) ;Roche Light Cycle 480Ⅱ型实时荧光定量PCR仪(罗氏医学仪器公司) 。
1.2 方 法
1.2.1 土壤微生物基因组总DNA的提取
在每个棉区随机选取4个生育期的土样,按照Ezup柱式土壤基因组DNA抽提试剂盒上的操作步骤提取土壤基因组总DNA,将提取到的DNA样品进行标记并放入-20℃的冰箱保存[13]。
1.2.2 RT-PCR反应体系的建立及优化
以土壤基因组总DNA为模板,采用古菌16S rDNA基因特异引物524F(5’-TGYCAGCCGCCGCGGTAA-3’)和806R (5’-GGACTACHVGGGTWTCTAAT-3’)[14]对不同时期的根际土壤基因组DNA进行PCR扩增,探针两端用FAM和BHQ1进行标记,把不加模板的作为阴性对照,每个操作重复3次。反应体系为: 模板5 μL,引物各0.8 μL,FS Essential DNA Probes Master 10.0 μL,探针0.4 μL,ddH2O 3 μL,总体系为20 μL,反应条件:95℃预变性10 min;95℃变性25 s,56℃退火120 s,72℃延伸90 s,共进行45个循环[15]。用1.8%琼脂凝胶电泳检测产物,Illumina MiSeq测序平台对扩增的基因序列进行高通量测序(生工生物工程(上海)股份有限公司)。
1.2.3 重组质粒的构建与鉴定
用DNA胶回收试剂盒纯化扩增产物,然后进行质粒的构建并转化到大肠杆菌感受态细胞中,在含氨苄青霉素平板上进行蓝白斑试验筛选出阳性转化菌[16]。
1.2.4 标准曲线的建立
以拷贝数1.145×108copies/g (FRW)的质粒为基础,获得6个拷贝数分别为1.145×107、1.145×106、1.145×105、1.145×104、1.145×103、 1.145×102copies/g (FRW)质粒标准品。将7个不同浓度的标准品进行荧光定量检测。
用质粒DNA抽提试剂盒提取阳性转化菌DNA,再用超微量分光光度计测定OD600值,计算得出质粒浓度并按梯度进行稀释,检测已稀释的不同浓度质粒标准品,在Roche Light Cycle 480软件内拷贝数据,用Origin 8.5软件作图并生成方程,建立Ct值与棉花根际土壤古菌浓度之间的线性关系。
1.2.5 样品的荧光定量PCR检测
对提取的DNA进行扩增,后进行荧光定量PCR检测,将得到的样品Ct值带入上述重组质粒DNA构建的标准曲线方程中,计算棉花根际土壤古菌的含量(copies/g FRW)。
1.3 数据处理
运用Origin8.5和Excel软件对数据作图。用Flash软件对测序得到的双端序列数据根据overlap关系进行拼接,用Uchime软件去除嵌合体,获得高质量序列。在Usearch(version 7.0)平台上将相似性不小于97%的序列为同一操作分类单元(operation taxonomic unit, OTU),为了得到每个OTU对应的物种分类信息,与Silva数据库中基因序列数据库进行比对,采用RDP classifier算法对97%相似水平的OTU代表序列分析在分类学水平上根际土壤古菌群落组成[17,18]。
2 结果与分析
2.1 标准曲线绘制
研究表明,标准曲线的相关系数R2=0.999 5,标准品的浓度与循环数Ct存在极强的相关性。曲线的截距为45.5,斜率为-3.546 9。出棉花根际土壤古菌x(DNA起始浓度对数值)与y(Ct值)之间的关系为y=-3.546 9x+45.5 。图1,图2
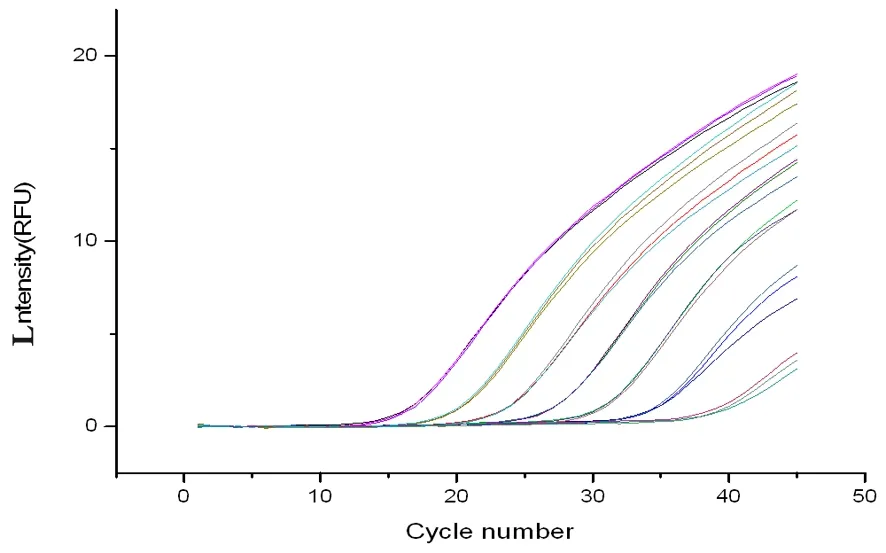
图1 10倍梯度稀释阳性质粒的荧光定量PCR扩增曲线Fig.1 Real-time PCR amplification curve of serial 10 fold dilutions of positive recombinant plasmids
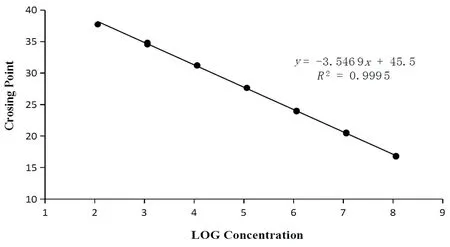
图2 10倍梯度稀释阳性质粒的荧光定量PCR标准曲线Fig.2 RT-qPCR standard curve of serial 10 fold dilutions of positive recombinant plasmids
2.2 不同生育时期新疆棉田根际土壤古菌数量变化及群落丰度
研究表明,哈密、石河子、图木舒克和乌苏变化趋势在苗期至絮期呈相似状态,从苗期后一直在减少,花铃期达到最低随后开始增加,在吐絮期数量最大,其中哈密根际古菌数量吐絮期达到最大值1.75×106copies/g (FRW);精河和库尔勒的变化都是从苗期缓慢增加,蕾期后又减少,花期又增加,在吐絮期两地根际古菌数量达到生育期最大值1.0×106copies/g (FRW);而在阿拉尔地区苗期为5.4×105copies/g (FRW),从苗期开始一直在降低,吐絮期降到最低1.1×104copies/g (FRW)。 Soil_Crenarchaeotic_Group_SCG在4个生育时期丰度最高是在蕾期达79.94%,苗期最低为75.5%。Unclassified_p_Thaumarchaeota在生育时期丰度差异最大,吐絮期最高达7.12%,苗期为1.06%。Halobacteria的丰度极低在蕾期仅为0.01%,苗期最高只有0.4%。图3,图4
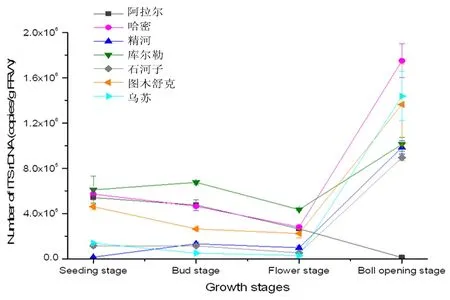
图3 不同生育时期棉花根际土壤古菌数量变化Fig.3 Variation of number of Archaea in rhizosphere soil of cotton in different growth stages
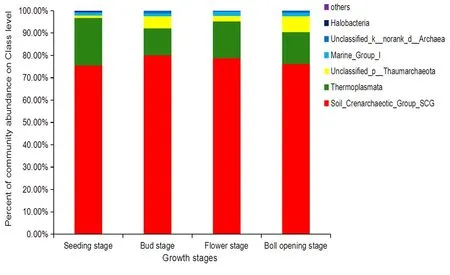
图4 不同生育时期棉花根际土壤古菌群落丰度Fig.4 Abundance of Archaea community in cotton rhizosphere soil in different growth stages
2.3 不同地区根际土壤古菌的数量变化及群落丰度
研究表明,在北疆地区,乌苏土壤古菌数量高于石河子和精河;南疆地区库尔勒土壤古菌数量在棉花苗期、蕾期和花铃期均比阿拉尔与图木舒克高,但在吐絮期比图木舒克低、比阿拉尔高。除阿拉尔外不同采样点的棉花病株根际土壤古菌在吐絮期数量较高,其中显著较高的地区依次为哈密、乌苏、图木舒克;苗期精河棉花病株根际土壤古菌的数量同其他几个地区相比最少仅有1.4×104copies/g(FRW),此外精河、石河子和乌苏3个地区除在吐絮期外的生育时期的土壤古菌数量都很少;库尔勒地区的根际土壤古菌的数量在整个生育期变化不大呈现稳定趋势。棉花根际土壤古菌群落中SCG纲丰度最高在哈密地区为88.84%,最低是在阿拉尔为58.24%;相反热原体纲(Thermoplasmata)丰度最高是在阿拉尔地区为26.19%,哈密最低是9.66%;Marine_Group_I丰度最高是在阿拉尔为7.13%,哈密和石河子仅有0.01%;Halobacteria纲在精河地区丰度最高为0.43%,阿拉尔为0.03%,在哈密和石河子却不存在这一类群。图5,图6
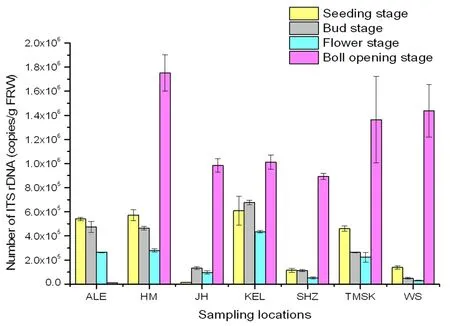
图5 不同地区棉花根际土壤古菌数量变化Fig.5 Variation of number of Archaea in rhizosphere soil of cotton in different locations
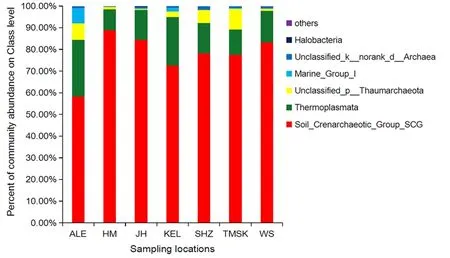
图6 不同地区棉花根际土壤古菌群落丰度Fig.6 Abundance of Archaea community in cotton rhizosphere soil in different locations
3 讨 论
近年来,我国关于土壤微生物的研究越来越多,古菌作为一类耐高温、高盐、低氧、强酸、强碱的生物,在生态环境中具有不容忽视的作用。陈金全等[19]通过构建克隆文库和实时荧光定量PCR的方法,对珠江口海岸带沉积物氨氧化细菌和古菌组成及定量进行研究。王晶等[4]运用荧光定量PCR技术和16S rDNA多态性分析对玉米不同生长时期土壤古菌多样性变化进行研究,发现提高土壤古菌的多样性对生态环境大有好处并促进植物生长。研究对棉花不同生育时期以及不同地区的土壤古菌数量进行研究,但土壤古菌的多样性以及是否对棉花生长有促进作用有待进一步研究。棉花根际微生物对棉花健康有很重要的影响,因此,探究土壤微生物对棉花黄萎病的影响对棉花黄萎病的防治有十分重要的意义。目前已经有很多学者对棉花土壤中的微生物进行了定量研究,但对于棉花根际土壤古菌的研究还较少,张涛等[12]运用实时荧光定量PCR技术对新疆棉花根际土壤细菌数量进行时空动态分析,党文芳等[13]采用荧光定量PCR方法研究新疆不同地区以及不同生育时期棉花根际土壤真菌数量变化并探讨真菌与病原菌之间关系。研究首先建立了土壤古菌的实时荧光标准曲线,并对新疆棉花根际土壤古菌进行实时荧光定量PCR检测。刘珊珊等[20]对棉花不同发育时期根际微生物的动态变化进行了研究,但尚未发现针对不同地区土壤古菌的研究。采用荧光定量PCR技术对不同地区及不同生育时期的棉花土壤古菌数量进行动态变化研究。研究了棉花黄萎病病株根际土壤古菌数量变化趋势,对于古菌在不同土壤环境中的适应能力还需进一步的研究。
4 结 论
建立快速检测棉花根际古菌数量的实时荧光定量PCR技术发现新疆棉花根际土壤古菌数量在不同地区以及不同生育时期的变化较为明显,哈密、石河子、图木舒克和乌苏根际古菌数量均呈现先减少后增加的变化趋势,其中哈密的病株土壤古菌的数量与其余几个地区相比是最高的,在棉花的4个生育时期内,土壤古菌的数量在吐絮期最高达1.75×106copies/g (FRW),SCG纲丰度最高是在蕾期为79.94%。精河和库尔勒根际古菌数量变化趋势为先升后降再升,精河地区土壤古菌数量在苗期最低为1.4×104copies/g(FRW)。阿拉尔根际古菌数量一直在减少,吐絮期最低1.1×104copies/g (FRW)。SCG纲在阿拉尔地区丰度最高为88.84%。

