血清游离脂肪酸与急性心力衰竭患者心功能的相关性
柏 莲,郭 鹏,栾 波,白 浩,江 珊
(1.锦州医科大学 研究生学院,辽宁 锦州 121000;2.辽阳市中心医院 心内科,辽宁 辽阳 111000;3.辽宁省肿瘤医院 心内科,辽宁 沈阳 110001;4.天津市第四中心医院 心内科,天津 300000;5.锦州市中心医院 心内科,辽宁 锦州 121000)
急性心力衰竭(AHF)是指各种病因导致的心室收缩和(或)舒张功能急剧恶化,引起以肺循环和体循环淤血为主要特征的临床综合征,具有高发病率、致残率及病死率的特点[1-2]。其6个月再住院率约50%,5年病死率达60%约等同于癌症[3]。作为心血管领域的研究热点,近年来其诊治取得了突破性进展,重组人脑利钠肽等药物的应用极大程度上改善了AHF的临床预后降低了疾病的病死率[4]。但对与其发病密切相关的心肌能量代谢研究甚少。血清游离脂肪酸(FFA)作为心肌能量供应的重要底物,高效参与心脏的机械做功,当AHF发生时能量代谢底物由FFA转变为葡萄糖,致使心肌细胞内不能被利用的FFA蓄积,产生一系列负性生物学效应加重原有心肌损伤、加重心功能的病变[5]。而心功能的改变使得心肌的能量需求进一步增多,导致了病理状态下的能量供需失衡[6]。研究表明AHF患者FFA水平显著高于非心力衰竭患者,提示其在AHF发生发展的病理生理过程中占有重要地位[7]。本研究观察AHF患者的相关生化、物理检查指标,力求探究FFA与AHF患者心功能的相关性,报道如下。
1 资料与方法
1.1病例选择 2019年10月至2020年3月于我院住院AHF患者163例。根据患者心脏彩色超声左心室射血分数(LVEF)分组。LVEFF<40%组,男53例,女28例,平均年龄(69.1±4.7)岁;LVEF≥50%组,男42例,女38例,平均年龄(68.8±4.4)岁。两组年龄、性别等一般资料差异无统计学意义(P>0.05),具有可比性。
1.2入选及排除标准 纳入标准:①患者符合《中国心力衰竭诊断和治疗指南2018》诊断标准,年龄50~75岁;②患者临床资料完整;③同意参与本研究并签署知情同意书。排除标准:①患者合并急性冠脉综合征、严重心脏瓣膜病变、先天性心脏病;②患者患有全身重大脏器衰竭及系统疾病(如血液病、免疫系统疾病、恶性肿瘤、休克);③患者近期有外伤、手术病史;④不能配合完善相关检查及信息不全者。⑤排除40%≤LVEFF<50%患者。
1.3观察指标 收集患者性别、年龄、体重指数(BMI)、吸烟、饮酒史以及既往病史。患者入院当天检测血肌酐(Scr)、三酰甘油(TG)、心肌肌钙蛋白I(cTnI)、N末端前体脑利钠肽(NT-proBNP)。同时段抽取肘静脉血5 ml,3 000 r/min离心10分钟,静置取上清备用。FFA检测采用ELLISA试剂盒检测,试剂盒由上海酶联技术有限公司提供,所有操作均严格按照试剂盒说明书进行。待患者血流动力学稳定后行心脏彩色超声检查, 记录LVEF、左心室短轴缩短率(FS)、左心室舒张末内径(LVEDD)、左心室收缩末内径(LVESD)、心肌做功指数(TEi指数)等指标评估心功能。
2 结 果
2.1两组一般资料比较 两组性别、年龄、BMI、高血压、糖尿病、心房颤动、心肌梗死等既往病史、吸烟饮酒史等资料进行比较差异无统计学意义(P>0.05),见表1。

表1 两组一般资料比较
2.2两组生化指标比较 LVEFF<40%组cTnI、FFA及NT-proBNP明显大于LVEF≥50%组(P<0.05),两组Scr、TG比较差异无统计学意义(P>0.05),见表2。
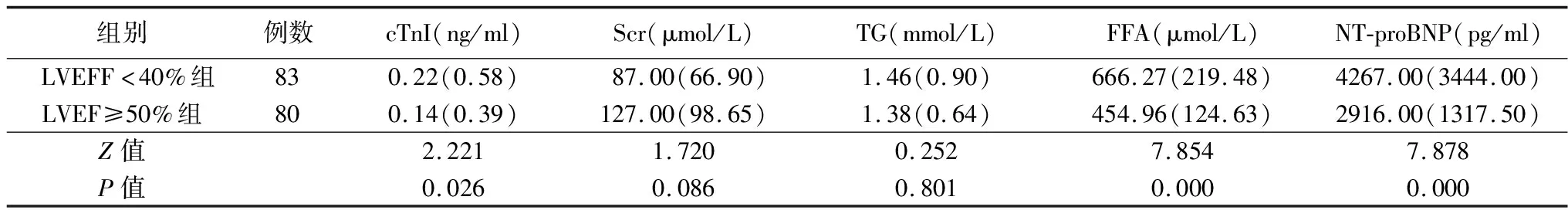
表2 两组生化指标比较[M(IQ)]
2.3AHF患者LVEF<40%发生的危险因素分析 以LVEF<40%为应变量,以FFA、NT-proBNP、cTnI为自变量行多因素Logistic回归分析,结果显示:cTnI、NT-proBNP、FFA是AHF患者LVEF<40%发生的独立危险因素,见表3。
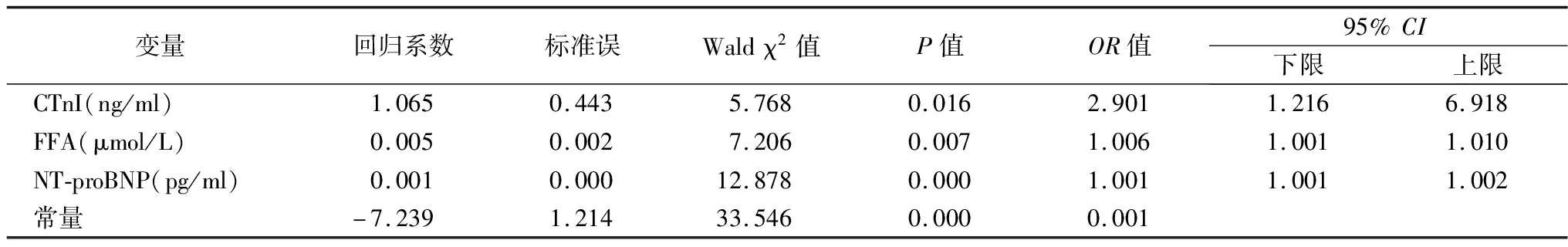
表3 AHF患者LVEF<40%发生的危险因素分析
2.4FFA、NT-proBNP对于AHF患者LVEF<40%的预测价值 FFA在预测AHF患者LVEF<40%的CUT-OFF值为562.81 μmol/L。FFA的ROC曲线下面积为0.856明显高于NT-proBNP的曲线下面积0.810,见图1。
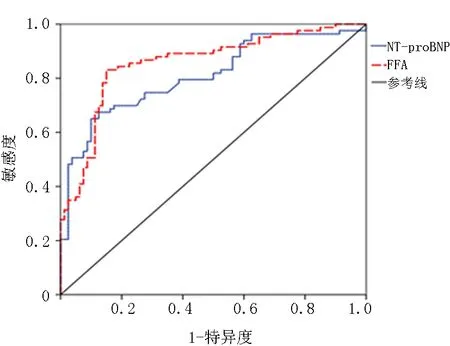
图1 FFA、NT-proBNP对于AHF患者LVEF<40%的预测价值
2.5根据FFA的CUT-OFF值行亚组分析 根据所得FFA的CUT-OFF值将AHF患者进行重新分组,分为高FFA组(FFA≥562.81 μmol/L)及低FFA组(FFA<562.81 μmol/L),两组进行心脏彩色超声相关指标比较,显示与低FFA组比较,高FFA组LVESD、TEi指数增高,而FS降低(P<0.05),见表4。
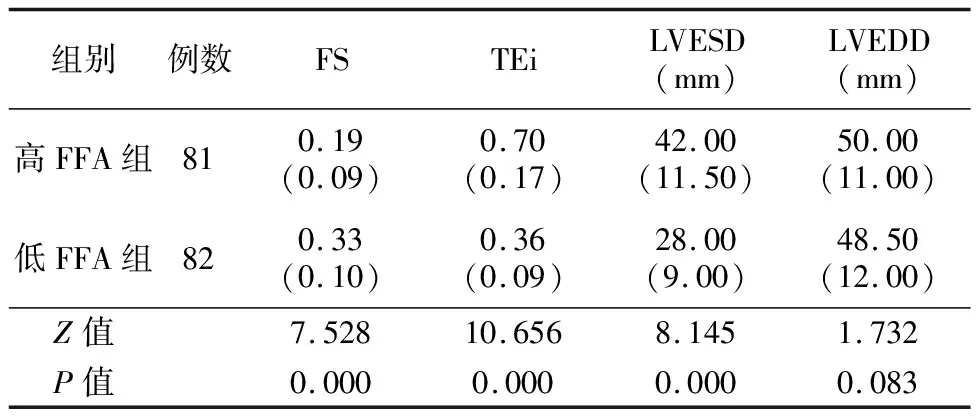
表4 亚组分析心脏彩色超声相关指标[M(IQ)]
3 讨 论
心力衰竭是心脏相关疾病发展的终末阶段,主要体现在内环境紊乱、神经内分泌调节紊乱以及能量供需失衡等方面[8]。NT-proBNP作为评估心力衰竭严重程度的生化指标,因生物稳定性高、不易受药物的干预影响被广泛应用于AHF的筛查、诊断及病情评估[9],但由于其受心力衰竭病程长短及肾功不全的客观影响临床应用受限。因此,寻求一种更为敏感、特异的生物标志物用以评估AHF心功能成为现阶段临床的迫切所需。
本研究结果显示,LVEFF<40%组的FFA、NT-proBNP、cTnI明显高于LVEF≥50%组,FFA、NT-proBNP、cTnI是AHF患者LVEF<40%发生的危险因素。且AHF患者中高FFA组较低FFA组患者的心功能明显降低。FFA是脂肪在脂解酶的水解下生成的产物,作为心脏的主要供能物质维持心脏的有效收缩。而心脏作为机体耗能最大的脏器,每日跳动10万余次,向外周泵血10 kg,其能量供应2/3来源于FFA氧化[10]。当心力衰竭发生时机体激活肾素-血管紧张素-醛固酮系统等神经内分泌系统增加心脏做功进而保证血流动力学稳定。此时心肌能量需求增高,代谢底物由FFA转为葡萄糖,这使得机体已合成的FFA入血且不能被及时有效清除,进而发生心肌细胞内堆积的现象[11-12]。能量替代性底物葡萄糖由于氧供不足有氧化被抑制,代之以糖酵解的方式供能生成大量乳酸,与心肌内蓄积的FFA产生双酸叠加效应,导致严重的细胞酸中毒,加剧原有心功能恶化[13-14]。从能量代谢角度,心力衰竭作为一种代谢紊乱性疾病,能量供需失衡是其发生发展的重要机制,而机体为纠正能量供需失衡所激发的神经内分泌机制会进一步加重能量代谢的负效应,推动原有疾病的恶化演变[15-16]。与此同时,AHF患者高水平的FFA还会引发炎症反应和氧化应激产生脂毒性,形成脂质代谢紊乱的恶性循环,致使心脏结构功能进一步受损、产能效率低下,做功效率也随之锐减[17]。大量FFA蓄积可以使心脏的做功效率降低高达30%以上[18]。研究显示,cTnⅠ增高是随访1年发生心脏性事件的危险因素, 是死亡的预测因子。血清cTnⅠ>0.10 μg/L的充血性心力衰竭患者为高危人群[19]。本研究显示cTnI是AHF患者LVEF<40%发生的危险因素,与以往研究结果一致。
本研究发现,FFA对于预测AHF患者LVEF<40%的价值高于NT-proBNP。而根据FFA界值进行重新分组后,显示高FFA组较低FFA组患者的心功能明显降低,提示FFA对于预测患者心功能的恶化具有一定的临床价值。
综上,FFA、NT-proBNP、cTnI是AHF患者LVEF<40%发生的危险因素。其中FFA对于AHF患者LVEF<40%发生的预测价值高于NT-proBNP,可以为临床治疗提供参考,具有一定的临床价值。

