豌豆根际土壤中细菌的鉴定及其对黄豆幼苗促生作用研究
张伟 王加顺 郭文涛 梁福平 周晓伦
(甘肃医学院,甘肃 平凉 744000)
植物促生菌是一类自由生活在土壤或根系周围的有益微生物,植物促生菌能通过产生植物生长激素如IAA,促进植物根系中侧根和不定根的生长,从而促进植物对环境中矿物元素和营养的吸收[1];通过产生ACC 脱氨酶能降低乙烯的前体物质ACC 的浓度,从而降低植物逆境胁迫(旱涝、重金属胁迫、高盐环境等) 下乙烯的浓度水平[2]。从污染的土壤中原位分离土著植物促生菌强化植物修复,不仅使本土物种能够更好地适应当地特定环境,而且能够尽量避免非本土化的生态风险[3]。通过测定菌株的促生特性(IAA、ACC 脱氨酶活性),进一步挑选具有较好促生能力的菌株,结合16S rDNA 序列分析和生理生化试验结果鉴定细菌种属,以期得到一批优良的土著植物促生菌。
1 材料和方法
1.1 材料
1.1.1 土壤采集
样品采集于甘肃省平凉市曹湾村(E106.90281°、N35.486647°) 大田农作物豌豆根际土壤。
1.1.2 主要材料化学药品等级均为分析纯,由西安姚北生物科技有限公司提供。黄豆种子为农家精选优良品种。
1.2 试验方法
1.2.1 根际土壤细菌的分离
准确称取3 份土壤各10g,分别加入盛有90mL 无菌水(含有20~30 个玻璃珠) 的锥形瓶中,置振荡器上振荡15min,得到10-1浓度的土壤稀释液,连续稀释至10-11,将10-1~10-11梯度的土壤稀释液均匀地涂布于含有50mg·L-1Cr6+的LB 培养基中,35±2℃倒置培养3~5d。挑取形态特征不同的菌落划线在LB 培养基中继续培养,每种菌株连续纯化分离3 代以上,最终使平板上的菌落形态和镜检的菌体形态一样,将纯化的菌落划线至牛肉膏蛋白胨琼脂斜面,4℃保藏,以备后续研究。
1.2.2 菌株的鉴定
菌株的形态观察及生理生化试验参照《常见细菌系统鉴定手册》 方法[4]进行。
1.2.3 菌株16S rDNA 序列测定及系统发育树的构建
将S70 菌株的16S rDNA 序列,通过NCBI 网站录入,与已知的序列对比并分析同源性,利用DNASTAR (MegAlign) 将序列进行对位排列,利用MEGA5.1 分子进化遗传分析软件分析碱基组成、GC含量,利用Kimura2 参数计算遗传距离,采用NJ 邻近法构建系统发育树。
1.2.4 菌株ACC 脱氨酶测定
ACC 脱氨酶分解ACC 产生的α-酮丁酸用来测定ACC 脱氨酶活性,参照Penrose 等的方法测定α-酮丁酸含量[5]。根据Bradford 方法测定菌体蛋白含量[6]。根据α-酮丁酸和蛋白质的标准曲线确定ACC 脱氨酶活性。
1.2.5 菌株IAA 的测定
将S70 菌株挑1 环到含有20mL 微量蔗糖盐液体(SMS) 培养基的锥形瓶中28℃、140r·min-1培养96h,液体培养基中加入0.5mg·mL-1的色氨酸。取1.5mL 悬浮液到2mL 离心管中5000g 离心15min,取上清液1mL 到5mL 比色管中,加入2mL Salkowski's溶液,振荡混匀室温静置20min,比色管中溶液会出现粉红色,在530nm 检测粉红色物质的吸光度[7]。1个菌株做3 个重复,根据IAA 的标准曲线确定菌株产IAA 能力大小。
1.2.6 菌株对黄豆幼苗生长的影响
采用改良的Belimov 等的方法确定根际细菌的植物促生根长活性[8]。接种18 株菌株至6mL LB 液体培养基中28℃、180r·min-1培养24h,用无菌水悬浮菌体数为5×107CFU·mL-1。1mL 细菌悬浮液或无菌水(未处理的对照组) 加入到含有40mL Hoagland 半固体培养基试管中(内径30mm)[9]。用3%H2O2和95%乙醇(体积比为1:1) 对黄豆幼苗表面灭菌2min,无菌水冲洗数次至种子表面无气泡产生,挑选优良种子到Hoagland 半固体培养基,所有的试验处理组做3次重复。在光照培养箱中28℃黑暗培养21d,培养后测量黄豆幼苗的根长、茎长、叶面积、鲜质量。
2 结果与分析
2.1 菌株鉴定
2.1.1 菌体形态和革兰氏染色
分离出的18 种菌株中,有8 种菌株革兰氏染色为阴性,其余11 种菌株革兰氏染色为阳性,见表1。菌体细胞形态有杆状和球状2 种,有8 种菌株菌体形态为杆状,其余11 种菌株菌体形态为球状。
2.1.2 生理生化特性
生理生化试验结果表明,见表2,18 株都具有甲基红试验阳性,V.P 试验全部阴性,表现一定的相似性,其余14 项生理生化反应结果各有所不同,菌株间表现差异较大。根据菌体的形态特征和生理生化,菌株S3为Acinetobacter sp.;菌株S5 为Exiguobacterium sp.;菌株W6 为Eromonas sp.;菌株D3 为Sireptococcussp.;菌株W9 为 Syntrophococcussp.;菌株S70 为Exiguobacterium sp.;菌株W3 为Bradyrhizobiumsp.;菌株D2 为Megasphaerasp.;菌株W1 为Enterobacteriaceaesp.;菌株D7 为Brachybacteriumsp.;菌株W7 为Lactobacillussp.;菌株S7 为Micrococcussp.;菌株W5 为Enterococcussp.;菌株D4-1 为Enterococcussp.;菌株D6为Megasphaerasp.;菌株W4 为Beijerinckiasp.;菌株S8 为Corynebacteriumsp.;菌株S4 为Megasphaerasp.。

表1 菌株革兰氏染色及菌体形态特征
2.1.3 S70 菌株系统发育树的构建
根据菌体形态特征和生理生化,菌株S70 为Exiguobacterium sp.,为了证实这一点,菌株的分子鉴定通过16S rDNA 基因测序和基因Blast 比对。由图1 可知,菌株S70 与Exiguobacterium 具有密切的同源性。为了确定菌株的系统发育位置,使用NCBI 获得的序列及MEGA5.10 软件构建了系统发育树。

表2 18 株菌的生理生化特性
2.1.4 S70 菌株产IAA 能力测定和ACC 脱氨酶活性
通过ACC 脱氨酶降解乙烯的直接前体ACC 来降低植物体内乙烯的含量,从而促进植物的生长和发育[10]。植物促生菌也通过合成IAA 的方式促进植物的生长,IAA 直接刺激植物细胞的延生和分裂或者提高植物自身的防御系统[11]。S70 具有较高的产IAA 能力和ACC 脱氨酶活性,如表3 所示。
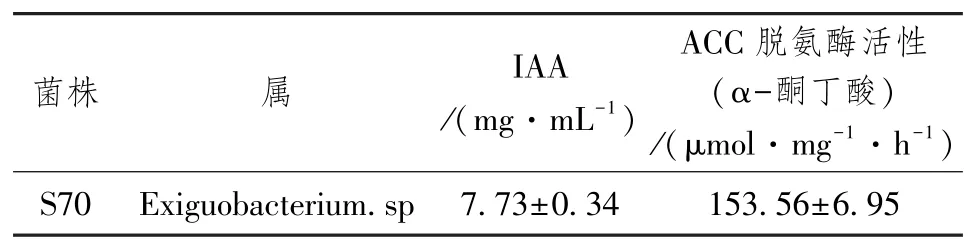
表3 菌株S70 的植物促生物质
2.1.5 18 种菌株对黄豆幼苗生长的影响
接种18 株菌株的黄豆幼苗的根长、叶面积结果表明,相对于未接种菌株的对照组,接种18 株菌株都有利于植物根和叶面积的生长;而接种S70 菌株的玉米幼苗根长、叶面积、茎长、鲜重量与对照组相比更加显著,如表4 所示。

表4 18 株菌株对黄豆幼苗生长的影响
3 讨论与结论
本研究主要利用16S rDNA 序列分析和生理生化实验培养体系,从豌豆根际土壤中分离、纯化出18株细菌,进一步说明植物根际土壤中细菌分布的广泛性,对现有理论关于细菌种群结构分析的研究和对豆科农作物的增产具有重要作用。通过对这18 株菌的菌体形态描述和生理生化试验,初步鉴定其分属于不动杆菌属(Acinetobacter)、微小杆菌属(Exiguobacterium)、单胞菌属 (Eromonas)、链球菌属 (Sireptococcus)、互营球菌属 (Syntrophococcus)、微球菌属(Micrococcus)、慢生根瘤菌属(Bradyrhizobium)、巨球型菌属 (Megasphaera)、肠杆菌属 (Enterobacteriaceae)、短状杆菌属 (Brachybacterium)、乳杆菌属(Lactobacillus)、肠球菌属(Enterococcus)、拜叶林克氏菌属 (Beijerinckia)、棒状杆菌属 (Corynebacterium)。
豌豆根际土壤中分离筛选的18 株菌大多能表现出良好的促植物生长特性,与对照组相比,促进根长的菌株有S5、S70、D7、W6、S7、D6、W4、S4,分别增加51.24%、56.81%、54.89%、19.76%、58.15%、13.05%、20.72%、26.29%;促进茎长的菌株有W9、S5、S70、W3、D2、W1、D7、W7、W6、S7、W5、D4-1、D6、S4,分别增加25.46%、22.98%、48.44%、31.05%、23.60%、8.69%、3.10%、4.96%、30.43%、4.34%、15.52%、24.84%、22.36%、4.96%;促进叶面积的菌株有W9、S5、S70、S3、D7、W6、S4,分别增加2.22%、11.55%、33.33%、30.66%、6.00%、25.77%、53.55%;促进鲜重量的菌株有D3、S70、W3、D2、W1、S3、D7、W6、S7、W5、D4-1、D6、W4,分别增加38.51%、51.11%、65.18%、10.37%、76.29%、34.07%、30.37%、47.40%、8.14%、85.18%、11.11%、7.40%、55.55%。还有具有ACC 脱氨酶、产生IAA 等。对其进行促生特性测定,筛选出了菌株S70,能够显著促进黄豆幼苗期高生长和生物量的积累。Bharti 等研究了2 种耐盐PGPR,Bacillus pumilus STR2 和深海细菌(Exiguobacteriumoxidotolerans) STR36,其中从盐碱土植物根际分离到的E.oxidotoleransSTR36菌株能够分泌丰富的胞外多糖,缓解高盐对植物体的胁迫,在原生盐碱土、次生盐碱土中接种Exiguobacteriumoxidotolerans STR36 的婆罗米植株生物量比未接菌分别高出109%、138%;植物体中活性物质三萜皂苷假马齿苋皂苷含量比未接菌植株分别高出36%、76%[12]。周晓伦等研究了在不同Cr6+浓度下接种了Exiguobacteriumsp S2 的玉米幼苗与对照组相比根长、叶面积、茎长都有显著提高,其显著提高了玉米幼苗对Cr6+的耐受性[13]。当存在微小杆菌时,能够维持黄豆幼苗根长、叶面积、茎长的生长,微小杆菌可以推荐用来增加植物的生物量。Exiguobacteriumsp.分布广泛,生存环境多样,对植物促生作用极具实用价值。

