基于网络药理学和分子对接分析苦参碱抗PRRSV的作用机制
郝江花,孙 娜,孙盼盼,孙耀贵,范阔海,尹 伟,李宏全*
(1. 山西农业大学动物医学学院,太谷 030801;2. 山西农业大学实验动物管理中心,太谷 030801)
苦参碱是一类生物碱,广泛存在于多种植物的根茎中,包括北豆根、槐角、苦参、山豆根、菟丝子等[1-2]。苦参碱具有多种药理作用,包括抗病毒[3-4]、抗炎[5-7]、抗癌[8]等。本实验室前期研究表明,苦参碱具有抗猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus,PRRSV)的作用,对其典型病变间质性肺炎有明显的治疗作用。PRRS是一种急性、接触性、高度传染性的疾病[9],给全球养猪业造成了巨大的经济损失[10]。PRRS的主要临床症状是严重的呼吸道症状,通过组织切片观察可见严重的间质性肺炎[11]。在苦参碱抗PRRSV/PCV2共感染昆明小鼠的研究中,发现苦参碱各剂量处理组均能不同程度地减轻病毒感染诱发的肺间隔增宽等肺病变[9];在PRRSV/LPS共刺激小鼠建立的间质性肺炎模型中,苦参碱通过抑制白细胞的变化以及IL-1β和TNF-α的表达来改善 PRRSV/LPS共刺激诱导的间质性肺炎[12]。目前,苦参碱抗PRRSV作用机制尚未完全阐明。基于苦参碱的抗炎作用,对苦参碱抗炎作用靶点、机制的挖掘将有助于对抗PRRSV机制的深入研究。
在中国几千年的历史中,中药在疾病预防和治疗方面发挥着举足轻重的作用,但由于人们在其发挥疗效的作用靶点及机制方面认识有限,严重限制了中药的重新定位及作为新兽药的开发利用[13-14]。网络药理学这一新兴分支学科的兴起,为中药机制研究提供了新的技术和方法。网络药理学是一种以系统生物学和多向药理学为理论基础,利用生物分子网络分析方法,在网络数据库查找、计算机虚拟计算以及高通量组学数据分析的基础上构建生物信息网络并进行网络拓扑分析的科学研究方法[15-16]。
利用网络药理学,通过数据库及在线分析平台,构建PPI网络,通过Degree等属性值筛选核心靶点,并通过分子对接技术进行验证;通过GO分析和KEGG分析寻找苦参碱潜在作用靶点的代谢通路,最终构建“药物-靶点-通路”网络,从整体的角度探索苦参碱的抗炎机制。通过网络药理学对作用靶点进行预测,为后续苦参碱抗病毒、抗炎的机制研究提供参考。
1 材料与方法
1.1 苦参碱靶点筛选
登录Pubchem数据库(https://pubchem.ncbi.nlm.nih.gov/),通过搜索“Matrine”获取苦参碱的化学结构,保存为sdf格式。然后将苦参碱的sdf格式文件上传到反向药效团匹配数据库PharmMapper(http://www.lilab-ecust.cn/pharmmapper/),选择“Druggable Pharmacophore Models ”,设置匹配的靶点数目为300,点击submit,即可得到苦参碱对应得分排名前300的靶点。得到靶点后,使用UniProt数据库中UniProtKB搜索功能,输入蛋白名称,经上述数据库检索和转化操作,将检索得到的蛋白校正为其官方名称,即Official Symbol。
1.2 抗炎靶点筛选
登录GeneCards数据库(https://www.genecards.org/),以“Anti-inflammation”为关键词进行检索,获取并筛选与抗炎相关的靶点数据。
1.3 苦参碱抗炎靶点可视化分析
通过生物信息在线作图平台(http://www.bioinformatics.com.cn/)绘制韦恩图,对苦参碱抗炎靶点进行可视化处理。
1.4 蛋白相互作用网络的构建
登录String数据库(https://string-db.org/),导入苦参碱发挥抗炎作用的潜在靶点并选择“homo sapiens”物种,获取靶点蛋白相互作用关系;minimum required interaction score选择medium confidence(0.400)并导出PPI互作图和tsv文件;将tsv文件导入Cytoscape 3.7.2软件绘制蛋白相互作用网络,利用Network Analyzer工具对网络进行拓扑学分析,节点大小和颜色深浅用于反映degree的大小,边的粗细用于反映combine score的大小。利用Network Analyzer工具对网络进行拓扑学分析,选取节点连接度(degree)的两倍中位数为筛选标准,以节点连接度(betweeness)、节点紧密度(closeness)的中位数作为筛选依据绘制Hithubs网络,筛选核心靶点。
1.5 GO功能分析和KEGG通路分析
登录DAVID数据库(https://david.ncifcrf.gov/),导入苦参碱发挥抗炎作用的潜在靶点并选择“homo sapiens”物种,select identifier设置为official gene symbol,list type设置为gene list,对苦参碱抗炎靶点进行GO分析和KEGG通路分析,导出txt文件。将靶点数目进行降序排列,对GO的3个 分支Biological Process、Molecular Function及Cellular Component靶点数排列前20的生物过程绘制柱状图;利用Bioconductor中的R包对靶点数排列前20的KEGG Pathway绘制气泡图。
1.6 药物-靶点-通路网络构建
登录Cytoscape 3.7.2软件(https://cytoscape.org/),导入苦参碱抗炎靶点及通路信息,构建“药物-靶点-通路”网络图。
1.7 苦参碱与靶点分子对接验证
登录Pubchem数据库,下载配体苦参碱结构并保存为sdf格式,利用openbabel转为mol2格式,利用AutodockTools1.5.6打开配体小分子,并加氢、加电荷、检测配体的root、进行可旋转键的搜寻与定义,并保存为pdbqt文件。登录RCSB Protein Data Bank,下载核心靶点蛋白IGFⅠ、MAPK8、CASP3、NR3C1的3D结构,在AutodockTools1.5.6中打开,通过添加所有的氢原子、计算Gasteiger电荷、合并非极性氢后,将其定义为受体并保存成pdbqt文件。根据配体的位置,最终确定Vina分子对接的坐标和盒子大小,为了增加计算的准确度,将参数exhaustiveness设置为20。除了特别说明,其他参数均采用默认值。采用Autodock vina 1.1.2进行半柔性对接,选取affinity最佳的构象,作为最终的对接构象。选取对接结合能量最低的构象用于对接结合模式分析,并使用PyMol进行作图。
2 结 果
2.1 苦参碱抗炎靶点的筛选
通过PharmMapper数据库收集到118个苦参碱潜在作用靶点,通过GeneCards数据库收集到263个抗炎靶点,将上述苦参碱靶点和抗炎靶点取交集,获得23个苦参碱发挥抗炎作用的潜在靶点(表1)。
2.2 苦参碱抗炎靶点可视化分析
登录生物信息在线作图平台,在成比例文氏图(Venn diagram)的疾病靶点和药物靶点中分别输入抗炎靶点和苦参碱作用靶点,通过韦恩图对苦参碱抗炎靶点进行可视化(图1)。
2.3 构建蛋白互作网络
将筛选出的23个苦参碱抗炎潜在靶点输入String数据库,限制物种为人,获取蛋白互作网络(图2),节点数为23,边数为52,预期的边数为14,平均节点度值为4.52,平均局部聚类系数为0.524,PPI富集P值为4.44×10-15,保存为tsv文件。将文件导入Cytoscape 3.7.2软件,根据其度值绘制柱状图(图3),由图可见度值排名前5的靶点包括IGFⅠ、MAPK8、CASP3、NR3C1及MAPK14;游离靶点包括PPARD、CYP2C9及LTA4H。利用Network Analyzer工具对网络进行拓扑学分析,选取节点连接度(Degree)的两倍中位数(10.4)为筛选标准,以节点连接度(betweeness)中位数(0.007 761 435)和节点紧密度(closeness)中位数(0.567 297)作为筛选依据绘制Hithubs网络,筛选核心靶点,结果见图4。由图4可知苦参碱抗炎核心靶点为IGFⅠ、MAPK8、CASP3、NR3C1。
2.4 GO功能分析和KEGG通路分析
将筛选出的23个苦参碱抗炎靶点输入DAVID 数据库,物种限定为人,进行GO功能分析,共获得116个富集结果。获得生物过程(biological process)81个,细胞组分(cellular component)8个,分子功能(molecular function)27个。其中,生物过程涉及RNA聚合酶Ⅱ启动子转录的正调控、信号转导、类固醇激素介导的信号通路、凋亡过程的负调节、蛋白质磷酸化等。细胞组分涉及核质、RNA聚合酶Ⅱ转录因子复合物、细胞质、细胞核、受体复合物等。分子功能涉及蛋白质结合、锌离子结合、类固醇激素受体活性、序列特异性DNA结合、蛋白激酶活性等。将GO功能分析中生物过程、细胞组分、分子功能的degree值排列前20的过程绘制柱状图(图5~7)。KEGG 通路分析共获得47个通路,利用Bioconductor中的R包对靶点数排列前20的KEGG Pathway绘制气泡图(图8)。

表1 苦参碱抗炎靶点
2.5 苦参碱-靶点-通路网络构建
将DAVID通路注释得到的数据,通过Cytoscape3.7.2软件构建苦参碱靶点-代谢通路-疾病网络模型(图9)。Network Analyzer结果显示,网络节点数为71,网络边数为217,网络密度为0.087,网络直径为4,网络半径为2,网络中心度为0.483、网络异质性为1.217,最短路径为4 970,特征路径长度为2.378,平均网络度为6.113。
2.6 苦参碱的分子对接验证
选取Hithubs网络中的4个核心靶点(IGFⅠ、MAPK8、CASP3、NR3C1),利用AutoDock Vina软件分别与苦参碱进行分子对接(表2)。为了从分子水平阐明蛋白与化合物的作用模式,将苦参碱对接至核心蛋白的活性口袋,理论结合模式如图10~13所示。由图可以看出,苦参碱与CASP3蛋白氨基酸LYS53形成键长为3.4 Å的氢键作用;与IGFⅠ蛋白氨基酸TYR60形成键长为3.4 Å的氢键作用;与MAPK8蛋白氨基酸ASN156形成键长为3.4 Å的氢键作用;与NR3C1蛋白氨基酸ARG558形成键长为3.4 Å的氢键作用,这些相互作用使得蛋白与化合物形成复合物,由于IGFⅠ蛋白较小,对接结合自由能较高,因此,可能不是很稳定,而蛋白MAPK8与苦参碱对接结合能较低,可形成稳定的复合物。因此,MAPK8为苦参碱的最佳结合靶点。

图1 苦参碱靶点和抗炎靶点交集Fig.1 Intersection of matrine and anti-inflammatory targets
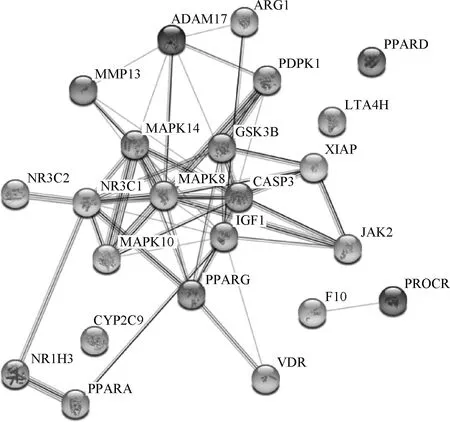
图2 苦参碱抗炎潜在靶点蛋白相互作用网络Fig.2 Potential target protein interaction network of matrine
3 讨 论
目前,利用网络药理学技术在药物作用靶点的预测和机制的研究方面已取得良好的成效。沈汶等[17]在研究银黄药对的抗病毒作用机制时,运用PharmMapper网络服务器、DAVID数据库、String数据库等预测关键蛋白,发现银黄药对抗病毒作用的靶点主要有CDK2、CDK7、SRC、DHFR、CHEK1、CCNA2等,可能通过抑制DNA前体合成来发挥抗病毒作用。崔琳琳等[18]在陈皮干预COVID-19机制研究中,利用TCMSP数据库、GeneCards数据库及分子对接技术等获得MAPK、MAPK8、CASP3、MAPK1、PTGS2、CAT、PPARG、NOS2等核心靶蛋白,提示陈皮可能通过抗病毒、抗炎、调控细胞凋亡、调节免疫等途径,发挥抑制肺纤维化的作用。
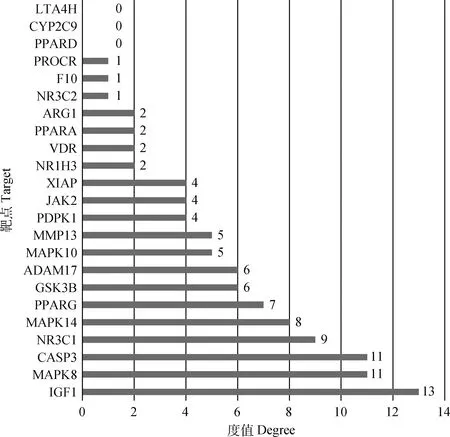
图3 苦参碱抗炎潜在靶点度值排序Fig.3 Order of anti-inflammatory potential target values of matrine
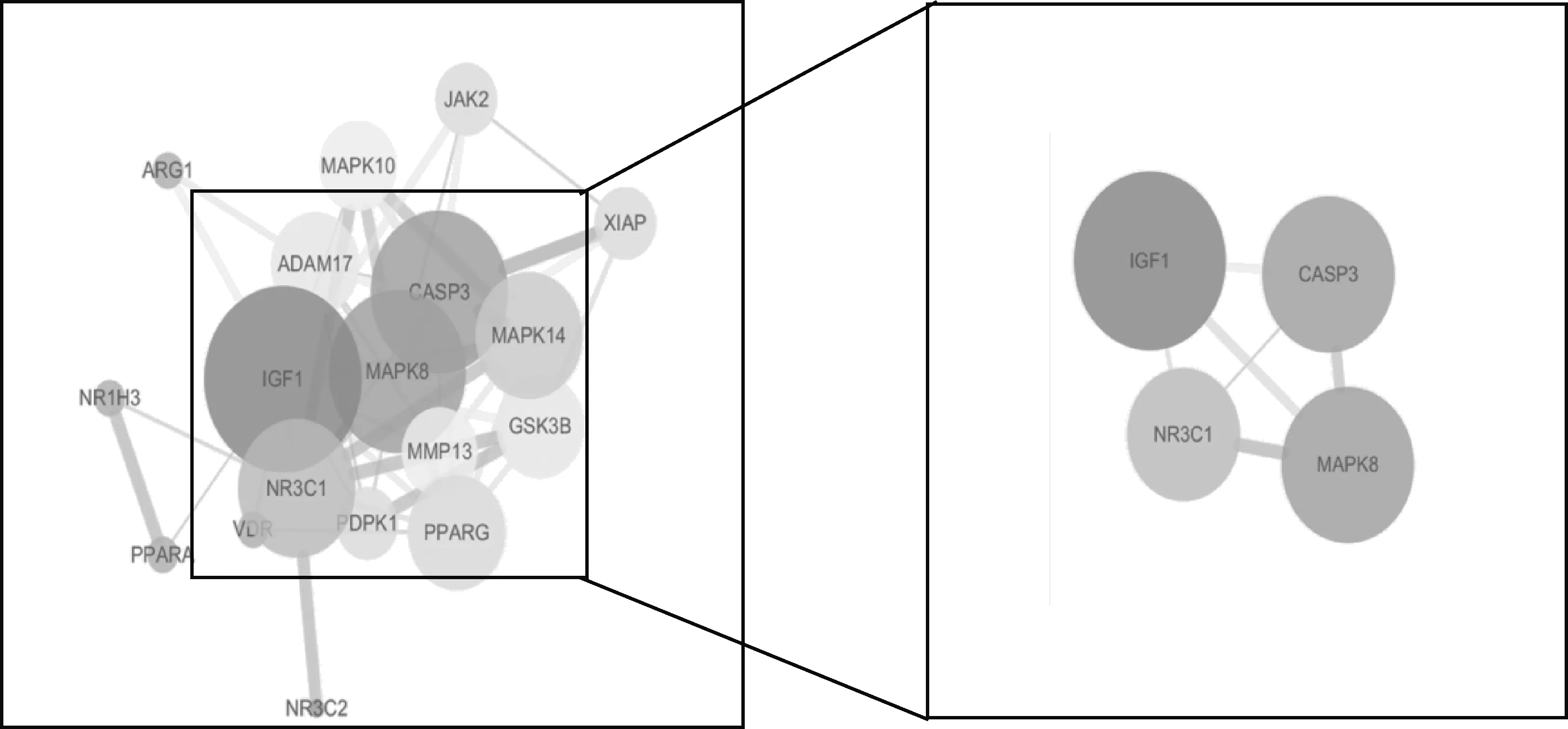
图4 苦参碱抗炎靶点蛋白Hithubs网络Fig.4 Hithubs network of matrine anti-inflammatory target proteins

图5 苦参碱抗炎靶点的生物过程Fig.5 Biological process of matrine anti-inflammatory target
利用PharmMapper和Genecards数据库挖掘到23个苦参碱抗炎靶点。利用String和Cytoscape数据库构建蛋白互作网络,通过连接度(degree)、节点连接度(betweeness)、节点紧密度(closeness)筛选出4个核心靶点,即IGFⅠ、MAPK8、CASP3和NR3C1。IGFⅠ又被称为胰岛素样生长因子Ⅰ(insulin-like growth factorⅠ,IGFⅠ),是胰岛素样生长因子家族重要的一员。研究发现,IGFⅠ在免疫系统炎症调节方面发挥着重要作用。小鼠感染流感病毒后IGFⅠ表达上调,IGFⅠ R磷酸化水平升高,促进下游PI3K/AKT和MAPK8中的P38信号通路的激活进而促进炎症反应[19-20]。半胱天冬酶(caspase)是一类天冬氨酸特异性半胱氨酸蛋白酶家族,caspase-3是其最主要的成员之一[21],被称为细胞凋亡的代表性效应CASP,最近也被称为焦亡的炎性介质。Suzuki等[22]在caspase-3缺陷小鼠免疫相关肾病研究中,发现caspase-3缺陷小鼠表现出肾炎症、轻度脾肿大和炎性基因表达上调,表明caspase-3在炎症反应中起重要作用。NR3C1是糖皮质激素受体基因(nuclear receptor subfamily 3, group C, member 1),糖皮质激素(glucocorticoids,GC)是肾上腺皮质细胞分泌的一种类固醇激素,具有强大的抗炎和对组织细胞的免疫抑制作用[23],广泛用于治疗包括类风湿性关节炎和哮喘在内的不同炎症性疾病[24]。糖皮质激素受体(glucocorticoid reccptor,GR)是介导GC发挥作用的重要转录调控因子,GC作用于NR3C1进而抑制炎症基因表达是抗炎有效性的核心[25]。MAPK8又被称为c-Jun氨基末端激酶1(c-Jun N-terminal kinase 1,JNK1),是MAPKs 家族的重要成员之一,在炎症等病理过程中起着重要的调控作用[26-27]。研究表明,PRRSV感染能够激活MAPK信号通路,促进MAPK信号通路中JNK、p38和ERK1/2的磷酸化[28]。雷莹莹[28]在亲和蛋白A对PRRSV增殖的影响及其作用机制的研究中,发现在亲和蛋白A作用后,不影响PRRSV感Marc-145细胞中的JNK的表达,但明显抑制其磷酸化过程。余志彬[29]在PRRSV诱导白介素-12产生的分子机制研究中,发现PRRSV感染可以诱导IL-12p40和IL-12p35的表达,且PRRSV对IL-12p40的诱导依赖于JNK-AP-1和NF-κB的信号途径。Liu等[30]研究表明PRRSV可能通过TAK-1/JNK/AP-1途径诱导IL-8的产生。运用分子对接技术计算4个核心蛋白与苦参碱分子的结合能,结果可知MAPK8与苦参碱分子的结合能最低,形成的复合物最稳定,因此,MAPK8可能是苦参碱发挥抗PRRSV作用的主要靶点。通过苦参碱抗炎作用靶点、通路的挖掘,为苦参碱抗PRRSV作用机制的深入研究奠定基础。

图6 苦参碱抗炎靶点的细胞组分Fig.6 Cellular components of matrine anti-inflammatory target
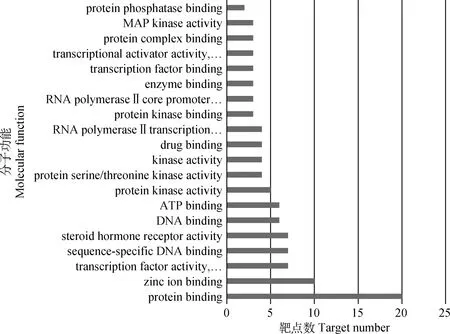
图7 苦参碱抗炎靶点的分子功能Fig.7 Molecular function of anti-inflammatory matrine target
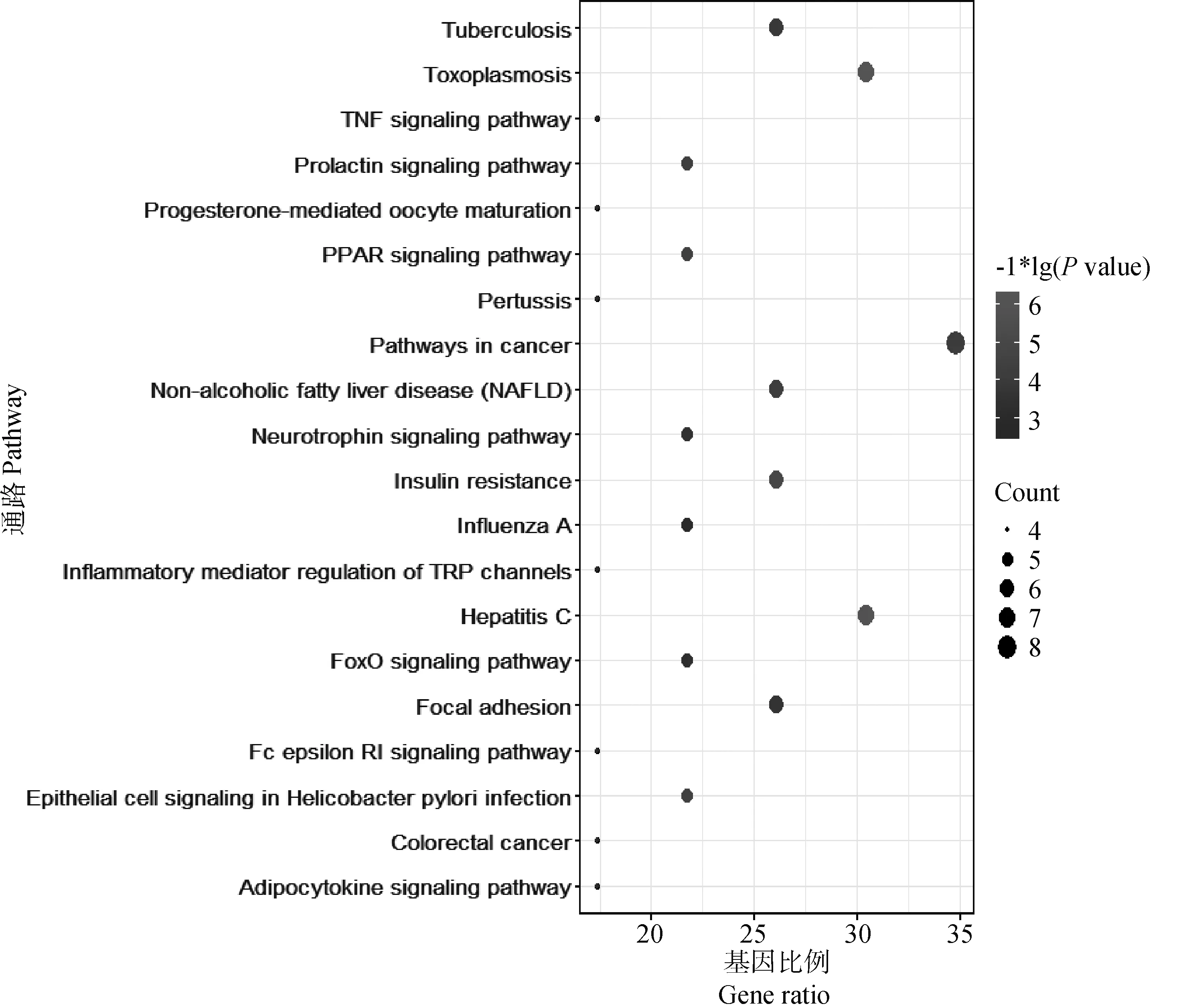
图8 苦参碱抗炎靶点的KEGG分析Fig.8 KEGG analysis of matrine anti-inflammatory targets

图9 苦参碱-靶点-通路的网络模型Fig.9 Network model of matrine-target-pathway

表2 核心靶蛋白与苦参碱对接结果

a. 苦参碱与IGFI对接的整体图; b. 苦参碱与IGFI对接的局部作用图 a. Overall diagram of matrine docking to IGFI; b. Local action diagram of matrine docking to IGFI图10 苦参碱与IGFI对接的最佳构象相互作用示意图Fig.10 Schematic diagram of the optimal conformational interaction of matrine docked to IGFⅠ

a.苦参碱与MAPK8对接的整体图;b. 苦参碱与MAPK8对接的局部作用图 a. Overall diagram of matrine docking to MAPK8; b. Local action diagram of matrine docking to MAPK8图11 苦参碱与MAPK8对接的最佳构象相互作用示意图Fig.11 Schematic diagram of the optimal conformational interaction of matrine docked to MAPK8
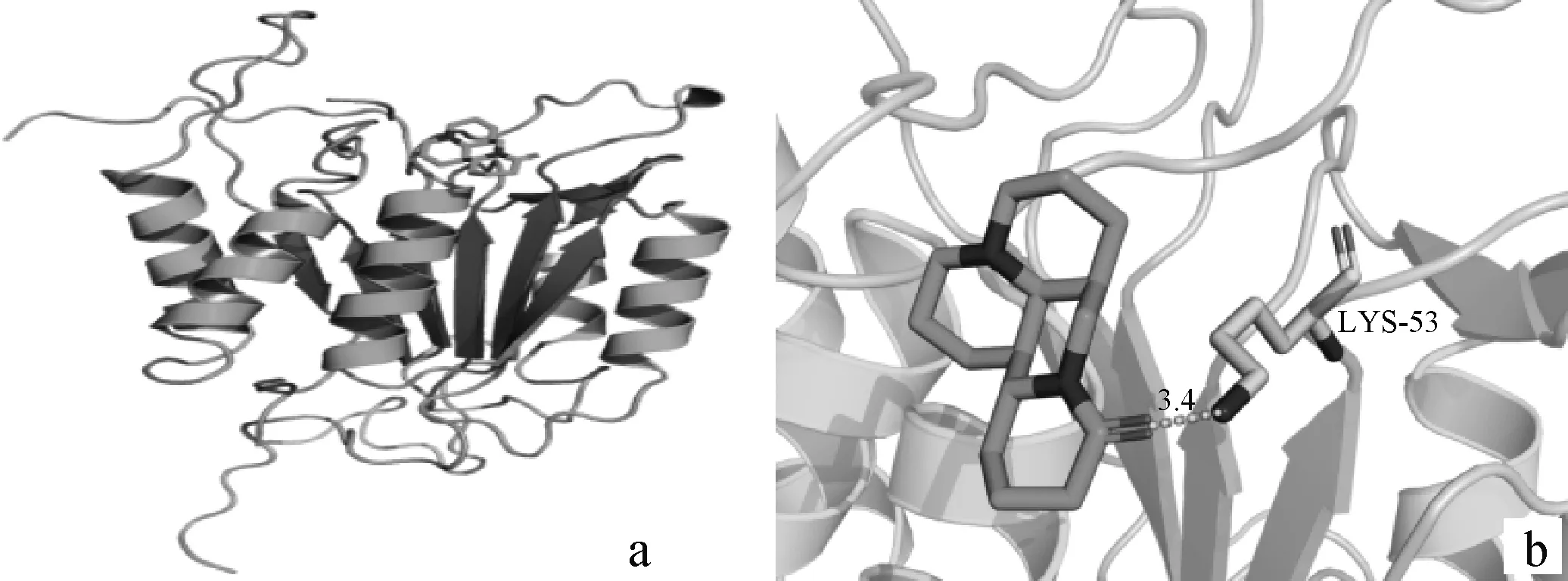
a.苦参碱与CASP3对接的整体图;b. 苦参碱与CASP3对接的局部作用图 a. Overall diagram of matrine docking to CASP3; b. Local action diagram of matrine docking to CASP3图12 苦参碱与CASP3对接的最佳构象相互作用示意图Fig.12 Schematic diagram of the optimal conformational interaction of matrine docked to CASP3

a. 苦参碱与NR3C1对接的整体图;b. 苦参碱与NR3C1对接的局部作用图 a. Overall diagram of matrine docking to NR3C1; b. Local action diagram of matrine docking to NR3C1图13 苦参碱与NR3C1对接的最佳构象相互作用示意图Fig.13 Schematic representation of the optimal conformational interaction of matrine docked to NR3C1
4 结 论
MAPK8是苦参碱发挥抗炎作用的主要靶点,苦参碱可能通过作用于MAPK8这一关键蛋白发挥抗炎作用,进而达到抗PRRSV的作用。

