联合血肌酐及抗肾小球基底膜抗体水平变化作为疗效监测指标1例报道
尹德明,张会敏,陈小三,李纪阳,郑玲玲△
首都医科大学附属北京潞河医院:1.皮肤性病中心;2.肾内科,北京 101100;3.江苏省免疫诊断工程技术研究中心,江苏苏州 215123
抗肾小球基底膜病是一种罕见的以影响肾脏和肺部基底膜毛细血管为主的小血管炎症疾病,该病的特征为咯血、肺部浸润、肾小球肾炎,以及体内可检测到抗肾小球基底膜抗体(anti-GBM)。采用血浆置换、糖皮质激素和环磷酰胺等联合治疗,可有效清除或降低体内anti-GBM水平,从而减轻和改善肾脏和肺部的病变。临床实践中,如何有效监测患者治疗效果并适时调整治疗方案是一种挑战。现报道1例通过连续观测血肌酐和anti-GBM水平变化,从而实现患者治疗效果监测的临床病例。
1 临床资料
患者,女,58岁,退休工人。因“不明原因肉眼血尿20余天,伴尿中泡沫增多”,于2018年9月12日入院。患者发育正常,神志清楚,饮食欠佳,睡眠尚可,近半个月体质量下降4 kg,否认高血压、糖尿病、冠状动脉粥样硬化性心脏病及心脑血管疾病。尿常规检查:潜血3+,蛋白3+,白细胞1+,红细胞3 596/μL,白细胞243/μL;生化检查:清蛋白36.7 g/L,血肌酐299 μmol/L,尿素氮11 mmol/L,尿酸428 μmol/L,C反应蛋白58.31 mg/L。尿微量清蛋白/尿肌酐检查:尿微量清蛋白1 004.81 mg/L,尿微量清蛋白/尿肌酐比值2 014.18。抗核抗体筛查和自身抗体谱检查(间接免疫荧光法):抗核抗体弱阳性。自身抗体谱定量检测(化学发光法):anti-GBM强阳性(>400 RU/mL)。泌尿系超声:双肾实质回声增强,右肾多发囊肿。结合患者自述、肾功能检查及相关实验室辅助检查,临床诊断为急进型抗肾小球基底膜病。入院后,生化复查显示1周内血肌酐由299 μmol/L上升至460 μmol/L,患者病情进展较快。
患者自9月15日至10月4日,连续接受激素冲击、免疫球蛋白输注和血浆置换等治疗措施。期间,激素0.5 g,每天1次,共3 d,冲击逐渐减量,同时隔天开展血浆置换,合计10次。治疗期间,以血肌酐和anti-GBM等指标水平改变作为患者肾功能改善及免疫治疗和血浆置换疗效监测的重要依据。9月21日,经过激素冲击和4次血浆置换后,患者血肌酐和anti-GBM水平明显下降至398 μmol/L和104.79 RU/mL。9月28日,在完成第3天甲泼尼龙0.5 g冲击治疗及另外4次血浆置换后,患者血肌酐和anti-GBM水平再次下降至374 μmol/L和62.59 RU/mL。10月10日,经过激素冲击和8次血浆置换强化治疗后,患者血肌酐和anti-GBM水平明显下降至290 μmol/L和43.39 RU/mL,尿量正常,无肉眼血尿等,其临床症状明显改善,按医嘱准予出院,但需规律随诊。患者出院后,按照医嘱要求每两周到医院随诊直至2019年2月。期间,通过每天1次强的松60 mg口服和环磷酰胺静脉滴注的方式继续开展免疫抑制治疗,同时辅以补钙和利尿治疗。在随诊治疗期间,患者每隔两周接受血肌酐和anti-GBM水平的监测,直至2019年2月11日结束治疗。12月4日,患者anti-GBM水平已经明显转阴且低于检测范围最低限(>2 RU/mL),而血肌酐也下降到正常范围以内(153 μmol/L)。患者的各项指征明显改善。患者整个治疗期间,血肌酐及anti-GBM水平变化见图1。
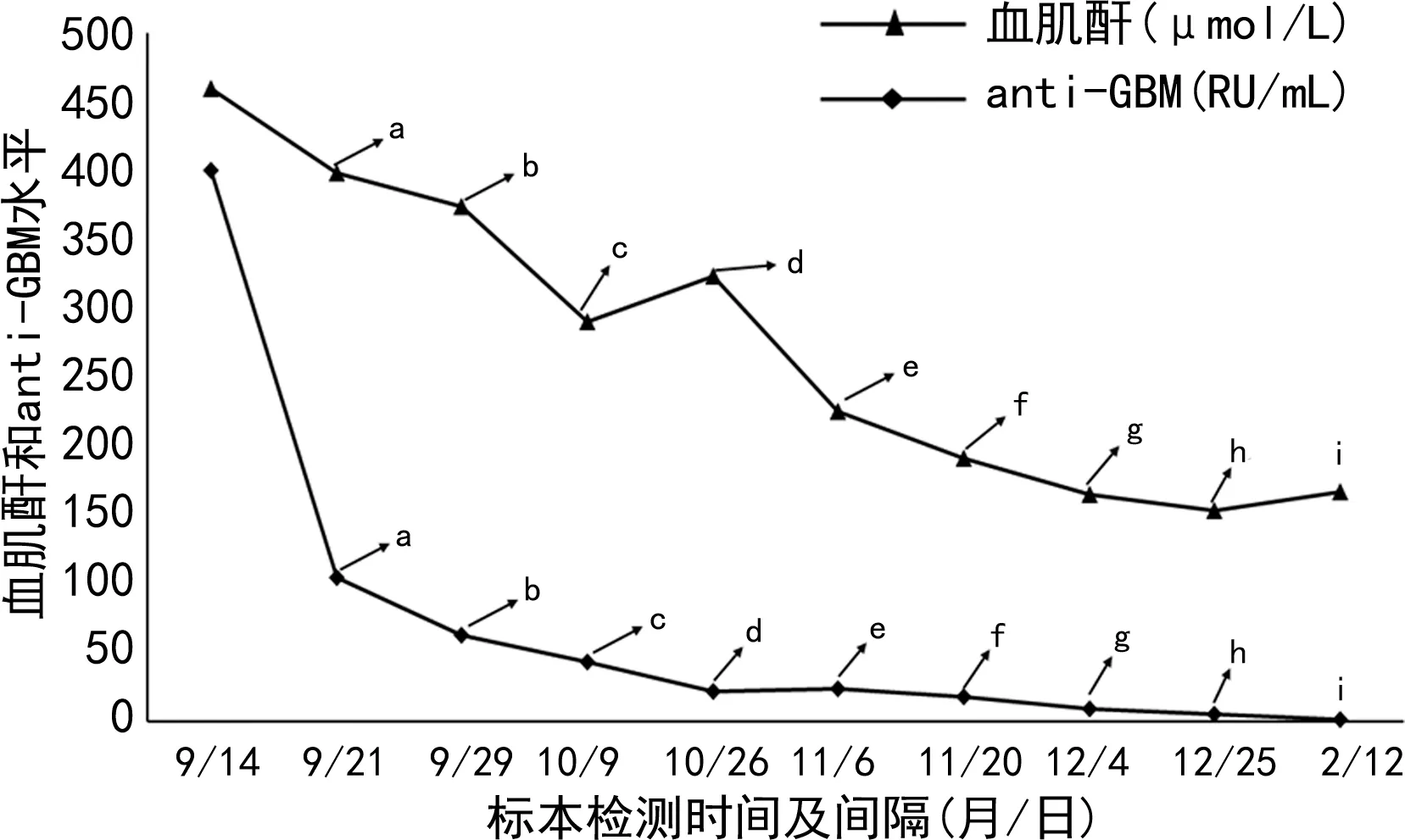
注:a为激素冲击、免疫球蛋白输注及血浆置换(共计4次)治疗后测值;b为激素减量及血浆置换(共计8次)治疗后测值;c为强的松口服、环磷酰胺静脉点滴及血浆置换(共计10次)治疗后测值;d~g为强的松口服及环磷酰胺静脉点滴治疗后测值;h~i为口服激素、补钙和利尿治疗后测值。
2 讨 论
抗肾小球基底膜病是一类疾病进程发展迅速的自身免疫性疾病,该病每年发病率为1/1 000 000~2/1 000 000[1]。尽管该病发病率不高,但由于其主要受累肾小球和肺部毛细血管,可引起急性肾小球肾炎和肺泡出血等严重临床表现,若不及时采取有效的治疗措施,往往可能危及患者生命[2]。抗肾小球基底膜病的临床诊断主要依靠肾功能检查、肾脏病理活检及自身抗体检测等多个方面综合判断。患者一经诊断后往往需要采取强化治疗方案,包括以快速清除致病性抗体为治疗目的的血浆置换,同时辅以环磷酰胺和激素结合的免疫抑制治疗,从而进一步抑制致病性抗体的持续产生和改善受累器官的炎症[3]。正确的诊断和及时有效的治疗措施对抗肾小球基底膜病患者的肾功能改善及良好的预后结果极其重要[4]。
由于抗肾小球基底膜病患者体内可以检测到anti-GBM,因此该抗体已经成为抗肾小球基底膜病与其他肾脏疾病鉴别诊断的特征性指标[5]。目前,国内大部分临床实验室针对anti-GBM的实验室检测方法主要包括间接免疫荧光法(IFA)、免疫印迹法(IB)、酶联免疫吸附试验(ELISA)和磁微粒化学发光法(CLIA)等。IFA以灵长类肾组织切片为基质,存在操作繁琐、结果判读主观性强及报告结果无法定量等明显局限性。而IB和ELISA等方法采用传统免疫检测,同样存在灵敏度低、检测结果以定性为主和无法开展急诊快速检测等问题[6]。与上述方法学比较,采用重组抗原的磁微粒化学发光法在检测anti-GBM时可实现全自动、定量及快速急诊检测,能够更好地满足临床检测的需求。本案例中,在疾病诊断时通过CLIA开展anti-GBM的定量检测,结果显示患者体内存在高水平的anti-GBM,抗体检测结果为患者的明确诊断提供了重要的依据。在患者接受强化治疗(包括血浆置换、激素冲击及免疫抑制治疗等)期间,对患者定期开展anti-GBM定量检测,借助血肌酐和anti-GBM水平的改变情况,为临床诊疗方案的调整提供重要依据。9月21日,患者经过第1轮激素冲击和4次血浆置换后,anti-GBM水平出现了大幅度下降,但血肌酐仍显示处于较高水平。为了尽快降低具有致病性的anti-GBM水平并改善肾功能,患者仍然需要维持激素冲击和血浆置换的强化治疗。10月9日,经过激素冲击和8次血浆置换强化治疗后,患者血肌酐水平明显下降的同时,anti-GBM水平继续呈下降趋势。结合上述两项指标的改善,针对患者的治疗方案适时调整为口服激素和环磷酰胺免疫抑制治疗。12月4日,患者血肌酐水平下降至正常值上限范围,anti-GBM则由阳性转为阴性,提示患者肾功能改善,且免疫治疗效果良好。后续仅需定期开展激素口服、利尿和补钙治疗即可实现肾功能的维持。
综上所述,本文报道了1例联合血肌酐和anti-GBM水平作为治疗效果监测的案例。患者为急进型抗肾小球基底膜病,在持续半年的诊疗过程中,血肌酐和anti-GBM水平随着患者临床症状的改善而呈现下降趋势。目前,国内大部分临床实验室在开展anti-GBM检测时仍然停留在传统的定性方法学上,而定性检测结果无法对患者治疗效果持续监测,因此作者建议肾科医生在针对抗肾小球基底膜病患者的诊断和治疗过程中,应高度重视anti-GBM定量检测的临床意义和价值。

