m6A去甲基化酶ALKBH5与弱精症的相关性研究*
夏 维,胡 玲,刘 东,刘 琴,胡红兵△
华中科技大学同济医学院附属武汉儿童医院/武汉市妇幼保健院 1.血液肿瘤科;2.急诊科;3.手术室;4.输血科,湖北武汉 430015
不孕不育影响着全世界大约15%的育龄期夫妇,超过50%的不孕病例是由男性不育造成。男性不育与诸多因素有关,如遗传因素、环境因素、生殖道感染、精索静脉曲张等[1-2]。精子活力降低,也被称为弱精症,是一种常见的导致不孕的原因,约占男性不育症病例的18%[3]。目前,临床实验室的精液检测报告仍以精子数量、形态、动力学内容为主,远远不能满足临床诊断和治疗的需求,更不可能为预防不孕不育提供指导。
RNA修饰是生物体内普遍存在的一种现象,极大地影响着RNA的生理功能。N6-甲基腺嘌呤(m6A)是mRNA上最为常见的修饰[4]。与DNA中胞嘧啶甲基化(5mC)的去甲基化类似,两种m6A的去甲基化酶FTO和ALKBH5相继被发现,表明m6A修饰是动态的,且在调控基因表达中起重要作用[5-6]。在对ALKBH5催化m6A去甲基化的研究中,ZHENG等[7]发现ALKBH5的去甲基化作用与小鼠的生殖能力相关。由此,本研究通过检测弱精症患者m6A水平和ALKBH5的相对表达水平,探究m6A和ALKBH5对男性不育的影响。现报道如下。
1 资料与方法
1.1一般资料 收集武汉儿童医院15例弱精症患者(弱精症组)和15例健康者(对照组)的30份精液标本,所有标本均为禁欲2~7 d,手淫方式获得。新鲜精液标本在37 ℃液化30 min后进一步处理。分组标准:前向运动精子数(PR)+非前向运动精子数(NP)<40%为弱精症组,PR+NP≥40%或者PR≥32%为对照组。弱精症组年龄(32.67±4.59)岁,对照组年龄(32.33±6.00)岁,两组年龄比较差异无统计学意义(P>0.05),具有可比性。笔者利用以往临床诊疗中获得的病历或生物标本进行实验室研究,经武汉儿童医院伦理委员会批准,并免除受试者知情同意。
1.2仪器与试剂 Percoll分离液(美国Pharmacia公司),逆转录试剂盒(FSQ-301,日本TOYOBO公司),TRIzol(美国Invitrogen),2×iTaq SYBR GREEN Supermixes(美国Bio-Rad公司),标准品(rA、rU、rC、rG、dA、T、dC、dG,中国西格玛奥尔德里奇公司),标准品(m6A,中国汉虹化工公司),S1核酸酶(中国宝生生物公司),碱性磷酸酶(中国宝生生物公司)、磷酸二酯酶(中国西格玛奥尔德里奇公司),氯仿(国药集团化学试剂有限公司),无水乙醇(国药集团化学试剂有限公司);NanoDrop(ND2000)超微量分光光度计(美国Thermo公司),实时荧光定量PCR仪(qPCR美国Bio-Rad公司),低温离心机(美国Beckman公司),LC-20AD高效液相色谱仪(日本Shimadzu公司),AB 3200 QTRAP质谱仪(美国Life Technologie公司),Hisep C18-T色谱柱(150.0 mm×2.1 mm×5.0 μm,中国韦泰公司)。
1.3精子的纯化 参照第五版世界卫生组织(WHO)人类精液处理与实验室手册[8],采用密度梯度法纯化精子。取2 mL精液加入6 mL磷酸盐缓冲溶液(PBS),颠倒混匀数次后4 ℃ 300×g离心15 min,弃上清液,1 mL PBS重悬精子沉淀,缓慢加入密度梯度液[下层为1 mL 80%(v/v)Percoll分离液、上层为1 mL 40%(v/v)Percoll分离液]上方,避免打破密度梯度液的分层界面,4 ℃ 400×g离心20 min,弃上清液,2 mL PBS重悬沉淀,取1滴精子重悬液滴于载玻片上,显微镜400倍视野下观察,比较纯化前后精子中的上皮细胞的数量,确认精子的纯度。
1.4RNA提取 将2 mL精子重悬液,400×g离心5 min,弃上清液,加入1 mL TRIzol,0.2 mL氯仿,大力摇管15 s,室温孵育2~3 min,4 ℃,12 000×g离心15 min。将上层水相转移到一个新管,1∶1加入异丙醇,室温孵育2~3 min,4 ℃,12 000×g离心10 min。弃上清液,加入1 mL 75%的乙醇洗涤RNA沉淀,涡旋混合。4 ℃,7 500×g离心5 min。40 μL RNase-Free ddH2O溶解沉淀,用NanoDrop检测RNA的浓度与纯度。
1.5LC-MS/MS检测m6A水平 利用核酸酶S1、碱性磷酸酶、磷酸二酯酶酶解精子RNA。液相色谱与质谱联用系统,检测方式为多反应监测(MRM)模式,监测离子对(母离子→子离子)分别为:m6A(282.2→150.1)、rA(268.4→136.2)、rU(245.4→113.1)、rC(244.4→112.2)、rG(284.5→152.2)、dA(252.4→136.2)、T(243.3→127.2)、dC(228.4→112.2)、dG(268.4→152.4)。
1.6qPCR法检测ALKBH5相对表达水平 反转录试剂盒将精子RNA反转录为cDNA,qPCR仪检测ALKBH5的相对表达水平,利用内参基因β-ACTIN和GAPDH标化,引物如下(5′→3′):ALKBH5上游引物5′-AGGGGAAGCGTGACTGTGC-3′,下游引物5′-GGGTGCATCTAATCTTGTCTTCC-3′;GAPDH上游引物5′-TCTATAAATTGAGCCCGCAGC-3′,下游引物5′-CCAATACGACCAAATCCGTTG-3′;β-ACTIN上游引物5′-CCAGCTCCTCCCTGGAGA-AG-3′,下游引物5′-ACAGGACTCCATGCCCAG-G-3′。
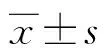
2 结 果
2.1两组精液常规参数比较 弱精症组的精子浓度、PR、NP和正常形态精子数均明显低于对照组,不动精子数(IM)和精子畸形指数(SDI)明显高于对照组,差异均有统计学意义(P<0.05)。两组间精子pH值和畸形精子指数(TZI)比较,差异无统计学意义(P>0.05)。见表1。

表1 两组精液常规参数比较
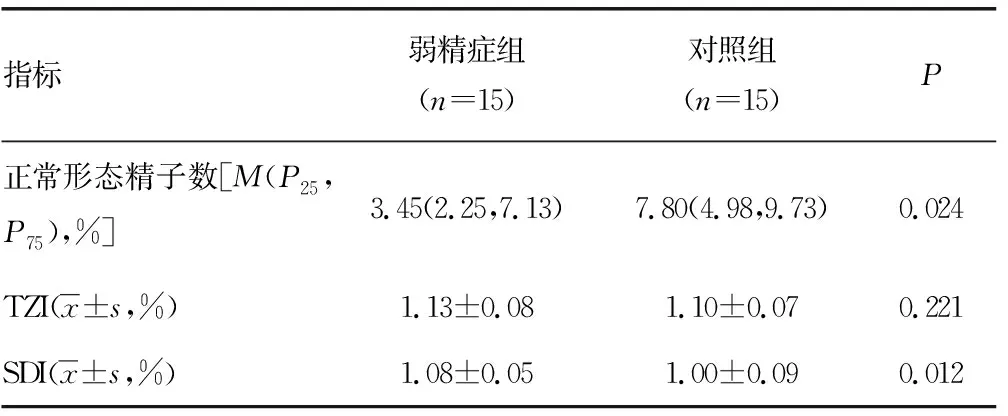
续表1 两组精液常规参数比较
2.2两组m6A水平比较 弱精症组精子m6A水平为0.21±0.02,明显高于对照组的(0.14±0.01),差异有统计学意义(P=0.005)。
2.3两组ALKBH5相对表达水平比较 弱精症组精子ALKBH5的相对表达水平为0.76±0.08,低于对照组的(1.00±0.08),差异有统计学意义(P=0.047)。
2.4ALKBH5、m6A与精子活动度相关性分析 ALKBH5与PR和NP呈正相关(r=0.512、0.377,P<0.05),与IM呈负相关性(r=-0.497,P<0.05),与pH值、精子浓度、正常形态精子数、TZI、SDI无相关性(P>0.05)。见图1。此外,m6A与RP和NP呈负相关(r=-0.422、-0.425,P<0.05),与IM呈正相关(r=0.528,P<0.05),与pH值、精子浓度、正常形态精子数、TZI、SDI无相关性(P>0.05)。见图2。

注:A为ALKBH5与PR的相关性散点图;B为ALKBH5与NP的相关性散点图;C为ALKBH5与IM的相关性散点图。
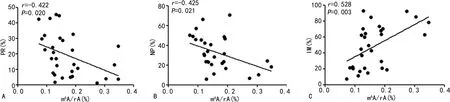
注:A为m6A与PR的相关性散点图;B为m6A与NP的相关性散点图;C为m6A与IM的相关性散点图。
3 讨 论
弱精症是男性不育的重要表征之一,精子活动度降低是弱精症的主要临床表现[9]。本研究通过检测弱精症患者m6A水平和去甲基化酶ALKBH5的相对表达水平,发现弱精症患者较健康者ALKBH5相对表达水平降低,m6A水平升高。ALKBH5是已知的m6A去甲基化酶[10],因此,笔者认为弱精症患者m6A水平升高的原因可能是由去甲基化酶ALKBH5相对表达水平降低引起的。
m6A与生殖的相关研究可以追溯至1997年,BOKAR等[11]首次证实,m6A甲基转移酶METTL3(MT-A70)的mRNA表达在睾丸中最高。此后又有研究证实,m6A甲基转移酶在配子的生成、胚胎的形成和干细胞的自我更新等过程中均发挥重要作用[12]。METTL3与配子生成和发育相关,在酵母[13]、果蝇[14]、植物[15]中敲除METTL3的同系物,会出现配子生成障碍。此外,ALKBH5的去甲基化作用与小鼠的生殖能力相关。小鼠所有器官中,精巢中的Alkbh5基因的表达最高,并且Alkbh5基因的缺失会导致小鼠精巢萎缩,精子数目减少,形态异常,运动性降低[7]。这些结果表明ALKBH5可能通过使mRNA中m6A去甲基化调控精子的生成和功能。本研究结果显示,ALKBH5的相对表达水平与精子活动度指标(RP、NP、IM)具有相关性,且m6A也与这些指标相关,进一步证实ALKBH5可能通过使m6A去甲基化与精子活动功能具有相关性。成熟的精子核中含有多种RNA[16],其中精子mRNA的表达与精子活动度及男性生殖密切相关。由此笔者猜想精子RNA的m6A 水平改变可能会影响与精子活动度相关基因的mRNA稳定表达,但到底是哪些基因受到影响仍有待于进一步研究。
综上所述,在弱精症患者中,m6A及其去甲基化酶ALKBH5与弱精症具有相关性,检测男性不育患者精液的ALKBH5相对表达水平,对临床诊断治疗可能具有一定的指导意义。

