超声辅助低共熔溶剂提取芹菜叶中的芹菜素及其抗氧化性分析
刘琴,周游,陈轩,沈汪洋,,庄坤,吕庆云,
(1.武汉轻工大学食品科学与工程学院,湖北武汉 430023)
(2.武汉轻工大学湖北省稻谷加工工程技术中心,大宗粮油精深加工教育部重点实验室,湖北武汉 430023)
芹菜素(4",5,7-三羟基黄酮)是黄酮类化合物之一,属于黄酮亚类[1]。大部分来源伞形和菊科植物,如欧芹属、蒿属和蓍属的植物[2,3]。芹菜素具有多种生物活性,如抗炎,抗癌,抗氧化剂和抗过敏活性[4-7],还对高血压、自身免疫病和抗动脉粥样硬化等具有保护作用[8,9]。芹菜素的各种生物活性引起了广泛的兴趣,从而研究出一种绿色环保有效的提取方法也非常重要。
芹菜素的提取方法一般能耗大、提取率不高、成本较大、并且产生大量对人体健康和环境有害的物质[10]。为了克服这些缺点,在过去几十年中已经做了许多努力,如简化样品提取程序,并且还根据绿色化学原理减少或消除有害物质的使用或产生。在这个特定领域,低共熔溶剂(Deep Eutectic Solvent,DES)是一种非常有前景的新型环保高效的溶剂,主要是由氢键受体和氢键供体组成的[10]。Huang 等[11]研究了用十三种不同的DES 提取苦荞壳中芦丁,发现氯化胆碱-甘油对芦丁的提取效率最高,达到9.50 mg/g,且具有较好的生物降解性。Bajkacz 等[12]研究用17 种DES萃取豆类中的异黄酮,发现含有30%氯化胆碱-柠檬酸水溶液的DES 提取效果最好,且可回收利用。与传统的有机溶剂相比,DES 不仅环保、无毒、可生物降解,而且还具有生产成本低、可回收和易于生产的特点[10]。关于用DES 提取总黄酮和总多酚的报道已有一些,但是用DES 提取芹菜叶中芹菜素的研究还未见报道。
本研究通过对比不同种类的DES 和传统溶剂芹菜素提取含量,筛选适合的DES,通过单因素和响应面法优化提取条件。利用AB-8 型大孔树脂初步纯化芹菜素提取液,并采用紫外-可见光谱和液质联用验证和分析芹菜素,最后研究了初步纯化的芹菜素体外抗氧化活性,为芹菜素的综合利用与开发提供参考。
1 材料与方法
1.1 材料与仪器
新鲜芹菜由武汉市强鑫蔬菜产销专业合作社提供;摘叶→洗净→沥干→50 ℃低温烘干→粉碎→过60 目筛→芹菜叶粉末。芹菜素标准品(纯度≥98%),北京索莱宝科技有限公司;氯化胆碱和AB-8 型大孔树脂,上海源叶生物科技有限公司;乙醇、1,2-丙二醇、乙二醇、丙三醇、1,3-丁二醇、柠檬酸、葡萄糖均为分析纯,中国医药集团上海化学试剂公司。
MB99-1 自动液相色谱分离层析仪,上海青浦沪西仪器厂;U3000 超高效液相色谱仪-Exactive Q 质谱仪,赛默飞世尔科技公司;TU 双束紫外可见分光光度计,北京普析仪器有限公司;SC3612 低速离心机,安徽中科中佳科学仪器有限公司;XMTD-204 恒温磁力搅拌水浴锅,金坛区水北科普公司;KQ250DE 超声波清洗器,昆山市超声仪器有限公司。
1.2 实验方法
1.2.1 芹菜素标准曲线[13]
用无水乙醇配置10 μg/mL 的芹菜素标准品溶液,在200~700 nm 波长下,用紫外分光光度计完成样品波长扫描,发现在336 处吸光值最大,因此选336 nm为测量波长。用无水乙醇配制一定浓度梯度的芹菜素标准品溶液,在最大吸收波长下测得其溶液的吸光值为纵坐标Y,溶液的浓度(μg/mL)为X,得到的回归方程:Y=0.0743X+0.0018(R²=0.9994)。
1.2.2 低共熔溶剂的制备与筛选
根据表1 制备7 种DES。将氯化胆碱与乙醇、1,2-丙二醇、乙二醇、丙三醇、1,3-丁二醇、柠檬酸和葡萄糖按照一定的摩尔比混合置于带盖锥形瓶中,在恒温水浴锅中,保持温度70 ℃,磁力搅拌30 min,再加入25%的蒸馏水,磁力搅拌15 min,备用。准确称取芹菜叶粉于带盖的三角瓶中,各加入7 种DES 和80%(V/V)乙醇,使液料比为40:1。混匀后,先置于40 ℃超声清洗器中超声20 min,然后在恒温水浴锅中40 ℃水浴30 min。

表1 不同低共熔溶剂类型Table 1 Different types of DESs
1.2.3 芹菜素含量测定
提取液在3000 r/min 离心30 min,取上清液稀释,在336 nm 波长下测其吸光值,计算其芹菜素含量:

式中,N:稀释倍数;C:测得的芹菜素浓度,μg/mL;V:提取液体积,mL;M:芹菜素粉末质量,g。
1.2.4 单因素试验
准确称取芹菜叶粉末置于带盖的100 mL 三角瓶中,加入20%(V/V)含水量的DES(氯化胆碱/乙醇),使料液比为40:1(mL/g),先放入超声清洗器中40 ℃超声20 min,然后在恒温水浴锅中30 ℃水浴30 min。分别考察不同含水量(0、20、40、60、80%V/V)、料液比(10:1、20:1、30:1、40:1、50:1 mL/g)、超声时间(5、15、25、35、40、45 min)、提取温度(30、40、50、60、70 ℃)对芹菜素含量的影响。
1.2.5 响应面试验设计
在单因素试验的基础上,选出影响芹菜素含量比较大的单因素为变量(含水量、提取温度、超声时间),芹菜素含量为响应值,利用Box-Behnken(BBD)设计三因素三水平响应面,响应面试验因素与水平如表2 所示。

表2 响应面试验因素与水平Table 2 Coded values and corresponding actual values of factors in BBD design
1.2.6 大孔树脂纯化芹菜素提取液
大孔树脂预处理:3 BV 无水乙醇浸泡AB-8 大孔树脂24 h,然后用蒸馏水洗至无乙醇味。3 BV 的2%HCl 浸泡树脂4 h,用蒸馏水洗至中性。3 BV 的4%NaOH 浸泡树脂4 h,用蒸馏水洗至中性。将大孔树脂用无水乙醇湿法装柱,静置1 h 使树脂压实,备用。
用0.1% HCl 将芹菜素粗提液的pH 调至5,再以1 BV/h 流速上样1 BV。用蒸馏水1 BV/h 速度洗脱直至大孔树脂上层液为无色,再用80%乙醇1 BV/h 速度洗脱,收集前20 min乙醇的洗脱液,一部分溶液4 ℃储存,另一部分溶液旋转蒸发、冷冻干燥,备用。
1.2.7 紫外-可见吸收光谱分析
在大孔树脂纯化芹菜素的过程中,流出液收集频率10 min/次,在336 nm 波长下测其吸光值,然后在200~600 nm 范围内进行紫外可见吸收光谱扫描。
1.2.8 液质联用分析
色谱条件:色谱柱Agilent ZORBAX Eclipse XDB-C18(2.1×50 mm,1.8 µm);柱温20 ℃;流速0.2 mL/min;流动相:A:0.1%甲酸-甲醇溶液,B:0.1%甲酸水溶液;洗脱梯度:0~10 min,10%~40% A;10~18 min,40%~95% A;18~22 min,95%~95% A;22~22.1 min,95%~10% A;22.1~30 min,10%~10% A。
质谱条件:ESI离子源;鞘气40 arb;辅助气15 arb;喷雾电压3.2 kV;毛细管温度300 ℃;最大喷射电流100 μA;探头加热器温度350 ℃。
1.2.9 体外抗氧化性
1.2.9.1 芹菜素纯化物清除DPPH 自由基能力测定[16]
在3 mL 不同浓度的样品中分别添加100 μL 0.2 mmol/L DPPH-乙醇溶液,摇匀,避光反应30 min,在517 nm 波长下测其吸光度A1。在3 mL 不同浓度的样品中分别添加100 μL 无水乙醇,测其吸光度A2。在3 mL 无水乙醇中分别添加100 μL DPPH,测其吸光度A0。所有样品均用无水乙醇为参比。DPPH 自由基清除率计算公式如下:

1.2.9.2 芹菜素纯化物清除OH 自由基能力测定[17]

表3 羟基自由基清除试验加样表Table 3 Experimental procedures for the determination of hydroxyl radical scavenging ability
先用蒸馏水分别配制6 mmol/L FeSO4和6 mmol/L H2O2溶液,再用无水乙醇配制6 mmol/L 水杨酸溶液,备用。按照表3 加样,摇匀。样品在37 ℃下水浴1 h 后,在510 nm 波长下测其吸光度,按照以下公式计算OH 自由基清除率:

1.2.9.3 芹菜素纯化物清除ABTS 自由基能力测定[18]
先配制7 mmol/LABTS 和2.5 mmol/L K2S2O8溶液,两种溶液等体积混合,摇匀,在黑暗条件下常温反应16 h,待用。使用无水乙醇稀释反应溶液,使其溶液在734 nm 波长下的吸光值为0.7±0.02,得到工作液备用。将3 mL 的工作液与0.4 mL 的不同浓度样品溶液一起搅拌,然后将混合物在25 ℃的黑暗中反应30 min,在在734 nm 波长下测量的吸光值A1。将用无水乙醇替换样品溶液,得到的吸光值为A0。ABTS自由基清除率计算公式如下:

1.2.10 数据处理
采用SPSS v19.0 版软件进行方差显著性分析(p<0.05),Origin v8.1 版软件绘制图,Design-Expert 8.0.6 软件完成响应面分析。
2 结果与分析
2.1 低共熔溶剂体系优化
低共熔溶剂的性能(溶解度,物理化学相互作用,极性,表面张力和粘度)很大程度上是由氢键受体和氢键供体种类决定的[19]。在提取过程中,选择一种合适的DES 至关重要。乙醇常作为芹菜素的提取溶剂,且80%乙醇提取效率最高。因此,在本实验中选了7种不同的DES 和80%乙醇对比。在室温下,所有25%水含量的DES 一周之后都是无色透明澄清液体状态。DES 的提取效果如表4 所示,多元醇的DES 比基于有机酸和糖的DES 表现了更好的提取效果。可能是多元醇和有机酸的DES 对芹菜素具有更强的氢键作用力[20]。因此,可以表明不同类型的DES 具有不同的效果。DES-1 的提取效果优于其他溶剂,而且DES-1(16.48 mg/g)和DES-3(14.16 mg/g)相对于80%乙醇(13.99 mg/g)溶液分别提高了17.78%和1.15%。DES-7(6.24 mg/g)提取效果最差。可以看出,DES-1可以更好地穿透基质中的孔隙从芹菜素粉末中提取芹菜素。

表4 不同溶剂对芹菜素含量的影响Table 4 Influence of different solventson the content of apigenin
2.2 芹菜素提取单因素实验结果

图1 含水量(a)、液料比(b)、超声时间(c)和提取温度(d)对芹菜素含量的影响Fig.1 Influence of concentration of water (a), solvent to solid ratio (b), ultrasonic time (c) and extraction temperature (d) on the extraction yield of apigenin
2.2.1 含水量对芹菜素含量的影响
DES 的粘度通常高于常规溶剂的粘度,因此传质效率低而阻碍了萃取的效率。考虑到DES 的粘度,扩散系数,极性和表面张力问题,添加一定比例的水来可以有效改善[21]。通过混合不同比例的水和DES 作为提取溶剂,研究了含水量对芹菜素提取效果的影响。如图1a 所示,含水量对芹菜素提取效率有显著影响。当水含量从0%增加到20%时,芹菜素的提取效率显着增加。当水分含量为20%时,芹菜素的含量达到最大值15.29 mg/g。水分含量的不断增加会降低DES 的粘度,加速目标组分溶解,并提高提取效率[22]。但是,当水分含量过高时(>20%),芹菜素含量开始下降。可能是芹菜素和DES 之间的氢键相互作用降低了[23]。
2.2.2 液料比对芹菜素含量的影响
原料和溶剂接触面积与液料比有关,这会影响芹菜素的提取效果。如图1b 所示,当液料比从10:1 增长到40:1 时,芹菜素含量由14.29 mg/g 增加15.74 mg/g。此外,当液料比超过40:1 时,出现了缓慢下降的趋势。这些结果表明,当芹菜叶粉末以高的液料比完全分散在溶液中,获得了更大的接触面积,增强了传质。然而,随着溶剂体积的不断增加,接触面积达到饱和,然而溶剂体积变大,升温速率变慢,降低提取效率[24,25]。
2.2.3 超声时间对芹菜素含量的影响
超声辅助提取提高提取效率主要是由于超声波通道产生的溶剂中的空化气泡破裂引发微喷射冲击,冲击波使植物细胞壁损伤,导致细胞内容物释放到溶剂中[3],而且产生的湍动效应也会加快传质速率,从而提高提取效率。然而过长的超声时间可能会导致乙醇的挥发和芹菜素的部分降解,降低芹菜素提取效率[26-28]。如图1c 所示,随着超声时间的延长,芹菜素含量逐渐增加,超声15 min 时,芹菜素含量最大为15.93 mg/g。再随着超声时间增加,芹菜素含量又会减少。因此,超声15 min 提取效果最佳。
2.2.4 提取温度对芹菜素含量的影响
确定最佳提取温度很重要,在合适温度下,溶剂的粘度降低,扩散性增加,这对于DES 的提取效果非常重要。温度的适当升高会导致表面张力降低,而且芹菜素与样品基质之间相互作用也减少,从而增强芹菜素在溶剂中的解吸和溶解[29]。然而过高温度可能导致热敏感物质降解和溶剂的挥发[30]。如图1d 所示,提取温度由30 ℃升高到40 ℃时,芹菜素含量逐渐升高,在40 ℃达到最大15.39 mg/g。再随着温度的升高,芹菜素含量则显著下降。所以40 ℃为最佳提取温度。
2.3 响应面分析
2.3.1 回归方程的构建与分析
试验设计方案与结果见表5,通过Design-Expert 8.0.6 软件中的BBD 模型,对表5 中的数据进行多元拟合分析,得到回归方程的方程分析结果(表6)。该模型的F值为230.34,p值<0.0001,表明该模型非常具有统计学意义,一次项和二次项都显著(p<0.05),失拟项检验不显著(p=0.1294>0.05),这都表明了该回归方程能很好的反映真实值对实验结果进行分析。以芹菜素含量为指标Y,对各个因素(A含水量、B提取温度、C超声时间)二次项多元统计分析的二次多项式回归方程为:

式中:各因素系数的绝对值大小表示该因素对芹菜素含量的影响大小,正号和负号表示影响方向[31]。

表5 BBD 试验设计方案与结果Table 5 The BBD design of experiment and results
此外还可以用其他系数反映该模型的拟合性和可靠性。模型的决定系数(R2)反映该方程预测值(芹菜素含量)与实验值的一致程度,R2为0.9966 说明可以用此模型预测实验值。模型的调整系数(Rpred2=0.9596)说明在4.04%的响应值变化不可以由该模型解释。信噪比(Adeq Precisior=41.089>4)和变异系数(CV=2.82%<10%)说明该模型置信度好。由回归方程的系数绝对值大小(|ka=2.69|>|kc=-0.81|>|kb=0.50|)可得到影响芹菜素提取得率的主次因素的顺序:A>C>B。这与表6 中由p值得出的主次影响因素一致。

表6 回归方程的方差分析Table 6 Analysis of variance for a fitted regression equation
2.3.2 各因素交互作用分析
利用3D 响应面图和2D 等高线图,可以直观地观察到各因素和各因素之间的交互作用对响应值的影响。响应面的弯曲程度能反映各因素对响应值的影响程度。椭圆的等高线形状表明两个因素之间的交互作用显著;圆形的等高线形状表明两个因素之间的交互作用不是很显著[32]。如图2 所示,随着提取温度、含水量和超声时间增加时,芹菜素含量先增加后减少。超声时间和含水量交互作用的响应面比提取温度和含水量、超声时间和提取温度的响应面更陡峭,说明超声时间和含水量的交互作用最显著,这与表6 中方差分析结果相吻合(pac=0.0009<pab=0.0034<pbc=0.0144<0.05)。
2.3.3 最佳提取工艺与验证
利用Design-Expert 8.0.6 软件对芹菜素提取工艺条件进行优化,得到预测芹菜素含量为16.94 mg/g,考虑试验的可操作性,最优工艺条件组合为:液料比为40:1;含水量为24%;超声时间14 min;提取温度为42 ℃。在此最佳条件下,做3 次平行试验验证,得芹菜素含量为的平均值为16.87 mg/g,误差为0.07 mg/g,该值与回归方程模型预测值接近,证明该模型拟合比较准确和有效。
2.4 紫外-可见光谱分析
黄酮化合物在紫外全扫光谱中会出现两个典型的基本峰带(峰带I:300~400 nm;峰带II:220~280 nm)[16],所以可以用紫外图谱初步鉴定黄酮化合物的存在。由图3a 可知,上样50 min 没有黄酮化合物流出,50~60 min 会有少量黄酮物质被带出。在图3b 中,蒸馏水冲洗的前50 min 会出现了许多杂峰,可能是大量水溶性杂质流出,仅在50~60 min 出现了黄酮化合物的特征峰,但是在200~280 nm 区间杂峰太多。在图3c 中,前20 min 出现两个黄酮化合物的特征峰,适合在这个时间段收集流出液。


图2 各因素交互作用的响应面和等高线Fig.2 Response surface and contour plots for the interaction of various factors
2.5 液质联用分析
图4 是经大孔树脂纯化的芹菜素离子流图,图5a为提取保留时间14.19 min 的单组分离子流图。一级质谱图可知该组分的分子量,二级图谱可知该组分的分子离子峰打碎后的一些离子碎片信息[33]。在图5b和5c 中该物质的分子离子峰为269.05,分子离子峰丢失C3O2、CO2和C2H2O 后的碎片离子分别为m/z 201.06、225.06 和227.03。m/z 225.06 碎片离子再次被打碎生成m/z 151.00、117.03 和107.01 碎片离子。在图谱库中匹配的该物质的分子式C15H10O5;相对分子量270.05;相对分子量偏差-0.81×10-6,可以鉴定该物质为芹菜素。

图3 大孔树脂不同时段流出液的紫外可见全扫光谱Fig.3 Ultraviolet-visible absorption spectra of macroporous resin effluent at different periods
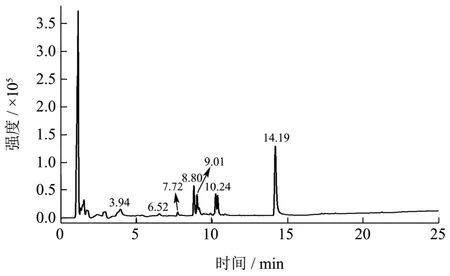
图4 芹菜素纯化物的离子流图Fig.4 Ion chromatograms of purified apigenin

图5 芹菜素组分的提取离子流图(a)、一级图谱(b)和二级图谱(c)Fig.5 Selected ion chromatogram (a), primary (b) and secondary spectrum (c) of apigenin
2.6 芹菜素纯化物体外抗氧化性
2.6.1 DPPH 自由基清除活性

图6 不同样品清除DPPH 自由基能力Fig.6 DPPH free radical scavenging ability of different samples
如图6 所示,随着样品浓度的增加,芹菜素标品和芹菜素纯化物清除自由基的能力增强,且清除能力没有明显差异,但是明显低于抗坏血酸的清除能力。当浓度从10 μg/mL 增加到100 μg/mL 时,芹菜素粗提物、标准品和抗坏血酸的清除率分别从3.66%、4.88%、88.21%增加到52.44%、57.72%、94.71%。其中芹菜素粗提物的IC50值为82.44 μg/mL。
2.6.2 羟基自由基清除活性

图7 不同样品清除OH 自由基能力Fig.7 Hydroxyl free radical scavenging ability of different samples
由图7 可知,芹菜素纯化物具有一定强度清除羟基自由基的能力。随着样品的浓度增加,各个样品清除率均增大。当浓度在12 μg/mL 时,芹菜素纯化物、芹菜素标准品、抗坏血酸对羟基自由基的清除率分别为43.32%、44.92%和59.77%,且各物质的IC50值由小到大:抗坏血酸(6.41)<芹菜素标品(8.41)<芹菜素纯化物(8.69)。当浓度为12 μg/mL 时,芹菜素纯化物和标品分别为抗坏血酸的0.72 和0.75 倍。
2.6.3 ABTS 自由基清除活性
在浓度范围20~60 μg/mL 内,随抗坏血酸浓度增加,清除能力增强。浓度到达60 μg/mL 以后,抗坏血酸的清除率接近100%。芹菜素纯化物和标品随浓度的增加接近线性变化,当浓度在160 μg/mL 时,芹菜素纯化物和标品的清除率分别为53.33%和56.07%。经线性拟合,芹菜素纯化物对ABTS 自由基清除率的IC50值为148.92 μg/mL。

图8 不同样品清除ABTS 自由基能力Fig.8 ABTS free radical scavenging ability of different samples
3 结论
本实验首先比较7种DES和80%乙醇提取芹菜素的效果,得出DES-1的提取效果最优,且DES-1比80%乙醇提取效率高17.78%,可能是因为相似相容原理和DES与芹菜素存在相互作用。其次通过单因素试验发现每个因素在一定范围内均呈现先增加后减少的趋势。最后由响应面优化实验获得了超声辅助DES提取芹菜叶中芹菜素的最优工艺条件:液料比40:1;含水量24%;超声时间14 min;提取温度42 ℃。在此条件下测得的芹菜素含量为16.87 mg/g,与预测值(16.94 mg/g)基本一致。经过大孔树脂初步纯化的芹菜素对羟基自由基、DPPH和ABTS自由基的IC50值分别为8.69、82.44和148.92 μg/mL,故清除各自由基的能力由强到弱依次为OH自由基>DPPH自由基>ABTS自由基,具有比较好的抗氧化特性。为开发芹菜叶中芹菜素工业化生产和利用提供理论依据。

