sB7-H3、LDH、TGF-β1在肺炎支原体肺炎患儿中的表述水平及其与病情严重程度的相关性研究
彭敏 魏婷婷
【关键词】 肺炎支原体肺炎 可溶性B7-H3 乳酸脱氢酶 转化生长因子-β1
[Abstract] Objective: To investigate the levels of soluble B7-H3 (sB7-H3), lactate dehydrogenase (LDH) and transforming growth factor-β1 (TGF-β1) in children with mycoplasma pneumoniae pneumonia and their correlation with the severity of the disease. Method: A total of 120 children with mycoplasma pneumoniae pneumonia admitted to our hospital from April 2019 to October 2020 were selected as the mycoplasma pneumoniae pneumonia group, and 80 healthy children who underwent physical examination in our hospital during the same period were selected as the healthy control group. The venous blood of all subjects were extracted and the levels of sB7-H3, LDH and TGF-β1 were determined. The expression levels of sB7-H3, LDH and TGF-β1 in children with mycoplasma pneumoniae pneumonia and their correlation with disease severity were analyzed. Result: The levels of sB7-H3, LDH and TGF-β1 in mycoplasma pneumoniae pneumonia group were higher than those in healthy control group, the differences were statistically significant (P<0.05). The levels of sB7-H3, LDH and TGF-β1 in children with acute mycoplasma pneumoniae pneumonia were higher than those in the remission stage, the differences were statistically significant (P<0.05). The levels of sB7-H3, LDH and TGF-β1 in children with severe mycoplasma pneumoniae pneumonia were higher than those in children with mild cases, the differences were statistically significant (P<0.05). Spearman correlation analysis showed that sB7-H3, LDH and TGF-β1 were positively correlated with disease severity (P<0.05). Conclusion: sB7-H3, LDH and TGF-β1 are all highly expressed in mycoplasma pneumoniae pneumonia, and are positively correlated with the severity of the disease, which are involved in the progression of the disease.
[Key words] Mycoplasma pneumoniae pneumonia Soluble B7-H3 Lactate dehydrogenase Transforming growth factor-β1
First-author’s address: Hunan Maternal and Child Health Hospital, Changsha 410000, China
doi:10.3969/j.issn.1674-4985.2021.18.008
肺炎支原体属于在儿童社区获得性肺炎中较为常见的病原菌,研究发现,当肺炎支原体进入患儿机体内,会吸附在患儿呼吸道上皮细胞表层,与局部组织形成免疫复合物,进而诱发呼吸道病变,影响患儿生长发育[1]。肺炎支原体肺炎多发于儿童,与成年患者相比,此类患者多表现为肺外脏器受累,较易转变为难治性毛细支气管肺炎、慢性支气管肺炎,严重威胁着患儿的身心健康[2]。虽然目前已有研究显示,肺炎支原体肺炎的发生是多种因素共同作用的结果[3],但关于此病发生发展的具体机制尚不完全明确,多数研究认为,多种细胞因子表达异常与肺炎支原体肺炎的发生发展相关。基于上述研究,本文分析了可溶性B7-H3(sB7-H3)、乳酸脱氢酶(LDH)、转化生长因子-β1(TGF-β1)在肺炎支原体肺炎患者中的水平,并进一步观察上述因子表达水平与患者病情严重程度的相关性,以明确sB7-H3、LDH、TGF-β1与肺炎支原体肺炎的关系,为临床上此病的诊治提供参考。现报道如下。
1 资料与方法
1.1 一般资料 选取2019年4月-2020年10月本院收治的肺炎支原体肺炎患儿120例为肺炎支原体肺炎组,同期选取于本院行健康体检的健康儿童80例为健康对照组。(1)纳入标准:肺炎支原体肺炎组患儿符合第7版《诸福棠实用儿科学》中对肺炎支原体肺炎的诊断标准[4]。急性期诊断标准为患儿病程在10 d内,CRP、白细胞总数轻度升高,血清MP-IgM抗体阳性,影像学显示患儿肺门影增大、双肺纹理粗;恢复期诊断标准为患儿胸部影像学检查异常症状消失或者减轻,咳痰、咳嗽、肺部体征消失或者减轻,体温正常2周以上。轻症标准为①持续剧烈咳嗽,X线所见远较体征为显著;②白细胞数大多正常或稍增高,血沉多增快;③血清支原体抗体检测阳性:肺炎支原体抗体IgM、IgG抗体阳性;④支原体半定量检测1︰160及以上。重症符合以下至少一条,①影像学检查显示患儿存在双侧或者单侧大片状、高密度实变影、存在大量积液、甚至出现坏死性肺炎、弥漫性肺炎表现;②使用大环内酯类抗生素连续治疗1周后仍存在发热、咳嗽、症状加重;③出现较为严重的中枢神经系统症状、低氧血症、肾衰竭、消化道出血、心肌炎等症状。健康对照组儿童无呼吸道急慢性疾病、肺部疾病史,身体健康。(2)排除标准:合并支气管扩张、肺结核等其他肺部疾病;急性感染病史;近两周使用糖皮质激素;心、肝、肾功能不全;先天性疾病;癫痫、脑部疾病。患儿家属均知情,且签署了知情同意书,研究经医院伦理学委员会批准。
1.2 方法
1.2.1 样本采集 清晨抽取所有患儿空腹静脉血3 mL,以离心半径5 cm、转速3 000 r/min离心处理10 min,分离上层血清,-80 ℃保存待检。
1.2.2 sB7-H3、LDH、TGF-β1水平检测 使用全自动生化分析仪(博万达生物科技有限公司)对所有研究对象的LDH水平进行检测,参考值为80~245 IU/L。采用ELISA法检测血清sB7-H3、TGF-β1水平,将上层血清样本置于室温后,取出试剂盒,标记酶标板,制作标准品,以1︰2的稀释液稀释样品;在反应孔上依次加入稀释好的待测血清及标准品100 μL/孔,放置37 ℃恒温孵育箱中湿育2 h;用专用洗涤液将反应板清洗3次后,加入抗体工作液(1︰100倍稀释后)100 μL/孔,置于37 ℃恒温孵育箱中湿育45 min;继续清洗反应板4次后,在反应孔内加入TMB溶液100 μL/孔,置于37 ℃恒温孵育箱中湿育45 min后将终止液100 μL加入每反应孔内,在450 nm波长测定吸光度,颜色反应深浅与sB7-H3、TGF-β1水平成正比,经绘制标准曲线计算sB7-H3、TGF-β1水平。
1.3 观察指标 比较健康对照组与肺炎支原体肺炎组sB7-H3、LDH、TGF-β1水平;比较不同发病期及不同疾病严重程度肺炎支原体肺炎患儿sB7-H3、LDH、TGF-β1水平。分析sB7-H3、LDH、TGF-β1与肺炎支原体肺炎患儿疾病严重程度的相关性。
1.4 统计学处理 采用SPSS 19.0软件对所得数据进行统计分析,计量资料用(x±s)表示,比较采用t检验;计数资料以率(%)表示,比较采用字2检验。相关性采用Spearman相关性分析,以P<0.05为差异有统计学意义。
2 结果
2.1 两组一般资料比较 肺炎支原体肺炎组男68例,女52例;年龄3~8岁,平均(5.5±2.0)岁;缓解期74例,急性期46例;轻症95例,重症25例。健康對照组男45例,女35例;年龄3~8.5岁,平均(5.8±2.2)岁。两组性别、年龄比较,差异均无统计学意义(P>0.05),具有可比性。
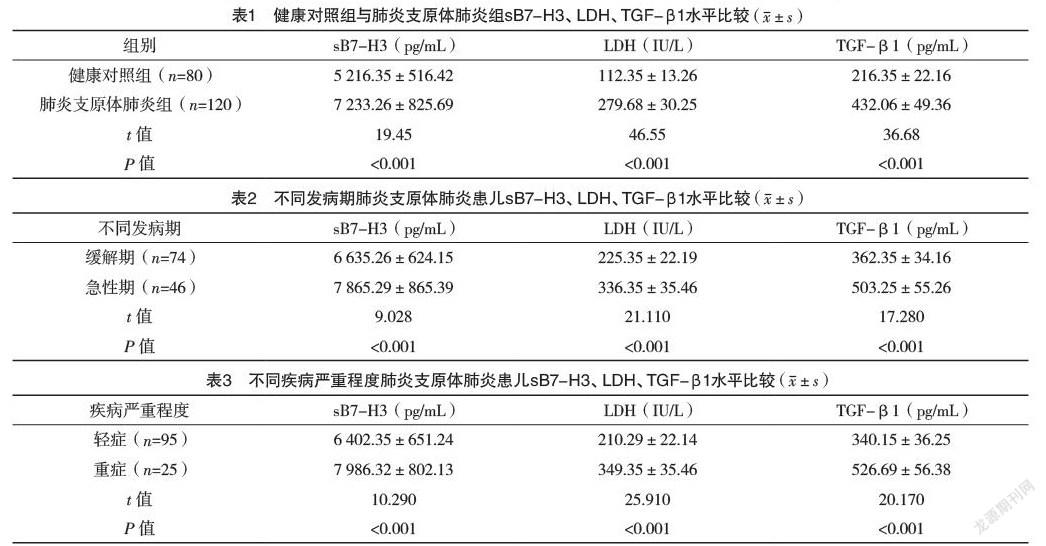
2.2 健康对照组与肺炎支原体肺炎组sB7-H3、LDH、TGF-β1水平比较 肺炎支原体肺炎组患儿sB7-H3、LDH、TGF-β1水平均高于健康对照组,差异均有统计学意义(P<0.05),见表1。
2.3 不同发病期肺炎支原体肺炎患儿sB7-H3、LDH、TGF-β1水平比较 急性期肺炎支原体肺炎患儿sB7-H3、LDH、TGF-β1水平均高于缓解期患儿,差异均有统计学意义(P<0.05),见表2。
2.4 不同疾病严重程度肺炎支原体肺炎患儿sB7-H3、LDH、TGF-β1水平比较 重症肺炎支原体肺炎患儿sB7-H3、LDH、TGF-β1水平均高于轻症患儿,差异均有统计学意义(P<0.05),见表3。
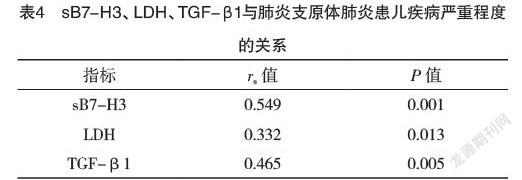
2.5 sB7-H3、LDH、TGF-β1与肺炎支原体肺炎患儿疾病严重程度的关系 Spearman相关性分析结果显示,sB7-H3、LDH、TGF-β1均与患儿疾病严重程度呈正相关(P<0.05),见表4。
3 讨论
肺炎支原体肺炎属于比较常见的呼吸内科疾病之一,其临床特征是剧烈咳嗽、发热、血沉增快、CRP升高、胸片显示单侧实变等,虽然肺炎支原体感染多属于良性自限性疾病,但若不诊治则会发展为难治性或者重症疾病,严重威胁着患儿的生命安全[5-6]。目前对于肺炎支原体肺炎的发病机制还未完全明确,因此探究此病的发病机制对临床诊治具有重要意义。
B7-H3为B7共刺激分子家族的成员之一,具有调节T细胞功能的作用,一方面可诱导T细胞在静息期分泌,另一方面可抑制活化T细胞的分泌和机体免疫应答反应[7]。随着对B7-H3的研究,发现其存在两种表达形式,即膜型(mB7-H3)和可溶性(sB7-H3)两种,其中mB7-H3表达形式均在活化的T细胞、单核细胞、树突状细胞、多种肿瘤细胞中存在,而sB7-H3主要来源于活化的T细胞、单核细胞、树突状细胞上的mB7-H3,与机体免疫调控相关[8-9]。临床研究发现,sB7-H3正性调节T细胞,表现为抑制Th1/Th2细胞分化,抑制IFN-γ等多种细胞因子分泌[10]。当机体被肺炎支原体感染后,sB7-H3水平异常升高,经治疗后其水平明显降低,与疾病严重程度正相关[11]。本研究分析了sB7-H3在肺炎支原体肺炎患儿中的表达,结果显示,sB7-H3在肺炎支原体肺炎患儿中呈高表达,且处于急性期、重症患儿sB7-H3水平均显著升高,提示sB7-H3在肺炎支原体肺炎中高表达,且与患儿疾病严重程度相关。
氧自由基、炎性因子等会在肺炎支原体肺炎疾病发生发展中刺激患儿,损伤肺细胞,进而诱导一系列的心肌酶产生,最终损伤心肌细胞,另一方面,心肌细胞会受到支原体自身毒素的刺激,进而诱导心肌酶的产生[12]。LDH属于糖酵解酶,能够促进乳酸分泌,心肌细胞损伤后,LDH释放至血液中,进而增加其浓度[13]。临床上多应用LDH水平高低评价疾病严重程度和预后情况,研究发现,肺炎支原体肺炎的发生发展同时多伴随着较为剧烈的免疫反应,并且机体多种器官和肺炎支原体间均存在相同的抗原,肺炎支原体感染机体后,机体会形成与之相应的自身抗体,进而产生免疫复合物,激发免疫反应,引发组织损伤,导致LDH浓度升高[14-15]。邓黎明等[16]研究发现,重症支原体肺炎患儿血清LDH水平显著升高,且经治疗后其水平降低,其研究结果提示LDH水平高低与重症支原体肺炎患儿疾病严重程度相关,随着疾病加重,其表达水平升高。本研究分析了LDH在肺炎支原体肺炎患儿中的表达,结果显示,LDH在肺炎支原体肺炎患儿中高表达,且处于急性期、重症患儿LDH水平均显著升高,提示LDH在肺炎支原体肺炎中高表达,且与患儿疾病严重程度相关。
TGF-β1是生物学功能较多的细胞因子之一,同时拥有较强的免疫调节功能[17]。临床研究发现,TGF-β1在激发炎症反应、组织修复、细胞生长、分化、免疫功能调节等方面具有重要作用,可刺激间充质起源细胞,抑制上皮或者神经外胚层来源细胞[18]。局部TGF-β1可聚集并激活白细胞,从而推动炎症反应进展,而全身TGF-β1可抑制初始T细胞分化为Th1/Th2过程,起到免疫抑制作用,影响机体免疫功能[19]。目前TGF-β1已经被证实为免疫细胞因子,一方面可诱导Treg细胞产生,另一方面可抑制效应T细胞功能,不仅具有抑制免疫炎症反应的作用,还可与炎症反应相关[20]。当机体被肺炎支原体感染后,TGF-β1表达显著升高,可调节过敏性气道炎症和胶原蛋白在气道的沉积,进而导致气道纤维化,促进疾病进展[21]。本研究分析了TGF-β1在肺炎支原体肺炎患儿中的表达,结果显示,TGF-β1在肺炎支原体肺炎患儿中高表达,且处于急性期、重症患儿TGF-β1水平均显著升高,提示TGF-β1在肺炎支原体肺炎中高表达,且与患儿疾病严重程度相关。
综上所述,sB7-H3、LDH、TGF-β1在肺炎支原体肺炎中高表达,且与患儿疾病严重程度呈正相关,参与此病的进展。
参考文献
[1] Lee H,Yun K W,Lee H J,et al.Antimicrobial therapy of macrolide-resistant Mycoplasma pneumoniae pneumonia in children[J].Expert Rev Anti Infect Ther,2018,16(1):23-34.
[2] Kutty P K,Seema J,Taylor T H,et al.Mycoplasma Pneumoniae among Children Hospitalized with Community-acquired Pneumonia[J].Clin Infect Dis,2019,68(1):5-12.
[3] Sauteur P,Seiler M,Trück J,et al.Diagnosis of Mycoplasma pneumoniae Pneumonia with Measurement of Specific Antibody-Secreting Cells[J].Am J Respir Crit Care Med,2019,200(8):1066-1069.
[4]胡亞美,江载芳,申昆玲.诸福棠实用儿科学[M].7版.北京:人民卫生出版社,2015.
[5] Liu J,He R,Wu R,et al.Mycoplasma pneumoniae pneumonia associated thrombosis at Beijing Children’s hospital[J].BMC Infect Dis,2020,20(1):51.
[6] Wu L,Ye M,Qin X,et al.Diagnostic value of quantitative MP-IgG for Mycoplasma pneumoniae pneumonia in adults[J].Clin Chim Acta,2020,503:76-83.
[7] Xu Y,Yu L,Hao C,et al.Plasma soluble B7-H3 levels for severity evaluation in pediatric patients with Mycoplasma pneumoniae pneumonia[J].Int Immunopharmacol,2019,73:163-171.
[8] Li Q L,Wu Y Y,Sun H M,et al.The role of miR-29c/B7-H3/Th17 axis in children with Mycoplasma pneumoniae pneumonia[J].Ital J Pediatr,2019,45(1):61.
[9]吳爱萍,朱斌.支原体肺炎患儿血清sB7-H3、IFN-γ、GM-CSF的变化观察[J].临床肺科杂志,2019,24(6):1042-1045.
[10]辛素芳,李力敏,边莉.儿童肺炎支原体肺炎血清sB7-H3及相关细胞因子的水平变化及临床意义[J].中国医药导报,2017,14(30):108-111.
[11]夏利,贾钦尧,朱书瑶,等.sB7-H3、G-CSF在肺炎支原体肺炎患儿血清中的表达及其临床意义[J].临床肺科杂志,2018,23(3):511-514.
[12] Liu T Y,Lee W J,Tsai C M,et al.Serum lactate dehydrogenase isoenzymes 4 plus 5 is a better biomarker than total lactate dehydrogenase for refractory Mycoplasma pneumoniae pneumonia in children[J].Pediatr Neonatol,2018,59(5):501-506.
[13]李伟平,李志勇.CRP,PCT,SAA,LDH,CK-MB对肺炎支原体肺炎病情判断的临床应用价值[J].潍坊医学院学报,2018,40(6):430-433.
[14]瞿色华,彭万胜.肺炎支原体肺炎患儿血清D-二聚体及乳酸脱氢酶浓度测定的意义[J].广东医学,2017,38(22):3418-3421.
[15]高海英,颜凯.难治性肺炎支原体肺炎患儿血清乳酸脱氢酶变化及临床意义[J].浙江临床医学,2016,18(8):1467-1468.
[16]邓黎明,李君,官燕.乳酸脱氢酶和C-反应蛋白在基层医院小儿重症支原体肺炎诊治中的应用[J].实用医院临床杂志,2019,16(5):173-175.
[17]张艳华,张嘉雯,段晓峰,等.支原体肺炎患儿TNF-α、TGF-β1、血清hs-CRP的水平检测及临床表达意义[J].中国地方病防治杂志,2017,32(4):418-419.
[18] Ko J,Mills T,Huang J,et al.Transforming growth factorβ1 alters the 3’-UTR of mRNA to promote lung fibrosis[J].J Biol Chem,2019,294(43):15781-15794.
[19]陆彩霞,李筠,彭德伟,等.肺炎支原体肺炎患儿血清白介素18、TNF-α、TGF-β1的临床意义[J].临床肺科杂志,2013,18(12):2199-2201.
[20]邱静,孙建,李万成.特发性肺纤维化中TGF-β1诱导上皮细胞间质转化作用机制研究进展[J/OL].中华肺部疾病杂志(电子版),2016,9(2):212-214.
[21] Zhong H,Fan X L,Fang S B,et al.Human pluripotent stem cell- derived mesenchymal stem cells prevent chronic allergic airway inflammation via TGF-β1-Smad2/Smad3 signaling pathway in mice[J].Mol Immunol,2019,109:51-57.
(收稿日期:2021-05-14) (本文编辑:姬思雨)

