膜联蛋白B1在猪囊尾蚴免疫逃避作用的研究进展
于铭川,王昕蕊,宋伟宜,宋伊宁,杨景芳,孙树民
(1内蒙古民族大学动物科技学院,内蒙古通辽028000;2内蒙古通辽市家畜繁育指导站,内蒙古通辽028000)
0 引言
猪囊尾蚴病(Porcine cysticercosis)是由猪带绦虫(Taenia solium)的幼虫(囊尾蚴)寄生于人、畜组织或器官内而引起的一种人兽共患寄生虫病,该病2010被世界卫生组织列为重点研究和控制的17种易被忽视的热 带 疾 病 (Neglected tropical diseases,NTDs)之 一[1]。囊尾蚴病呈世界性分布,特别在拉丁美洲,非洲,亚洲等发展中国家流行广泛,直到今日仍被认为是一种引发重要公共卫生事件的疾病。寄生现象是宿主和寄生虫建立的生物学和免疫学上互作关系。适应宿主环境是寄生虫成功寄生的前提,寄生虫主动免疫逃避和免疫抑制是成功寄生的关键因素,猪囊尾蚴与其他寄生性蠕虫相似,依赖其抗原或衍生物逃避或抑制宿主免疫系统的攻击,从而达到成功寄生的目的。寄生虫抗原与宿主免疫系统互相作用究其根源是抗原蛋白与宿主免疫系统的作用,研究虫体囊液蛋白对探讨免疫逃避或免疫抑制具有重要意义。作为抗原重要家族成员的膜联蛋白(Annexin,ANX),在细胞骨架活动,细胞膜磷酸化、膜受体调节、有丝分裂中发挥重要的功能[2-3],其家族成员在细胞癌变、自身免疫类疾病、抗炎症、抗凝血等机制和通路有重要的研究和应用价值[4-6]。其中ANX B1在虫体侵入过程中对宿主的免疫系统干扰和影响发挥重要作用,特别是在虫体免疫逃避中的作用。因此,探讨虫体囊液中膜联蛋白与宿主机体互相作用,为囊尾蚴入侵机制和早(中)期阻断该病提供新思路。
1 猪囊尾蚴病流行与危害
猪囊尾蚴是一种多细胞、无脊椎的真核寄生虫性蠕虫,自中国文献记载白虫开始距今1800多年的历史,该病不但给养猪业造成巨大损失,而且危害人类的健康,严重的甚至导致死亡。猪带绦虫囊尾蚴病在世界范围内均有发生,主要流行于拉美,撒哈拉以南的非洲国家和亚洲大部分地区。全球现有约5000万人感染带状绦虫,其中绝大多数是由猪带绦虫所引起。据现有癫痫患病数据估计,患脑囊尾蚴病(包括有症状和无症状病人)的总人数介于256万~830万之间,每年全球因脑囊尾蚴病死亡病人超过5万人[7]。近年囊尾蚴病流行范围已扩展到许多发达国家,在北美国、欧洲和澳大利亚等国家已连续多年均有报道[8-9]。最新统计显示,中国人猪带绦虫囊尾蚴病血清阳性率为0.58%,根据流行感染率推算中国囊尾蚴病患者大约在30万~70万人[10]。中国每年猪囊尾蚴感染猪肉和屠宰猪检验费所造成直接经济损失达上百亿元人民币。另外,用于治疗带绦虫病人(按55万患者计算)总费用为313亿元,而造成间接的经济损失很难用数据来评价。鉴于其流行及其危害性,猪囊尾蚴病被世界各国规定为强检必检病种,目前已成为危害最严重食源性寄生虫病。导致该病仍然流行和危害严重最主要原因为致病机制尚不明确。
2 膜联蛋白分类
2.1 膜联蛋白的作用
依照基因的结构进化关系以及在染色体上的定位不同,膜联蛋白可以分为5个大类:A类脊椎动物膜联蛋白、B类无脊椎动物膜联蛋白、C类真菌和单细胞真核生物膜联蛋白、D类植物膜联蛋白和E类原生生物膜联蛋白[11-12]。膜联蛋白家族是一类进化上高度保守的蛋白家族[13],依赖钙离子的磷脂结合,静息状态下主要存在细胞质中[14-15]。膜联蛋白也是一种有效的内源性免疫调节蛋白,参与了癌症中必需的多种功能,包括细胞增殖、凋亡、化疗敏感性、抗凝血抗炎反应、胞吞胞吐、转移,和入侵[16]。研究表明,膜联蛋白A1能激活抑制炎症的自然通路,而无当前抗炎药物的副作用,比目前的消炎药物更安全,通过进一步研究有望成为抗炎治疗的新策略[17-18]。膜联蛋白A2在自身免疫疾病患者中高表达,其通路包括,促进炎性细胞因子的表达,介导信号通路的激活从而诱导炎性因子的分泌,有望成为治疗自身免疫性疾病新的治疗靶点[19-20];并且A2在病毒感染致病过程中,促进病毒复制,并且与其他蛋白互作对细胞凋亡的调节,为预防和治疗病毒提供理论依据[21]。膜联蛋白A3在消化系统癌症患者中,表达量增加使肿瘤体积变大,在患癌早期促进癌细胞增殖,和侵袭。Tong等[22]开发针对膜联蛋白A3特异性单克隆抗体(抗AnnexinA3mAb)能有效阻断膜联蛋白A3,促进细胞凋亡增加,为临床诊断和开发新药提供更多可能。膜联蛋白A4通过抑制外源性细胞凋亡通路,进而调节肝脏胰腺细胞的凋亡及肝脏肿瘤细胞化疗药物抵抗[23]。膜联蛋白A5与磷脂酰丝氨酸高度特异性结合的特性已经被用于分子探针和药物的载体开发,结合流式细胞分析技术后成为当下体外检测细胞凋亡的理想分子探针,获得广泛关注和应用[24-25]。
现有研究证明,膜联蛋白的表达在不同恶性肿瘤的正负相关性存在着差异。在包括胃癌、肝癌、结直肠癌、胆囊癌、胰腺癌等消化道恶性肿瘤以及肺腺癌、乳腺癌中,膜联蛋白的高表达发挥促进肿瘤侵袭转移的作用;而在前列腺癌中则相反。更重要的是,膜联蛋白的异常表达往往与多种恶性肿瘤的临床分期及不良预后相关,这使其可作为一个潜在的生物学检测指标和治疗靶标来为肿瘤患者的诊断及治疗提供更多可能[26]。
2.2 膜联蛋白的结构
膜联蛋白是一种略微弯曲的蛋白质,有一个凸面和一个凹面。人ANX基因的大小范围从15 kb(ANXA9)到 96 kb(ANXA10),位于 15号染色体q21~q22,由339个氨基酸组成[27]。它由一个高度保守的核心结构域(由4个70~80个氨基酸的同源重复序列组成,称为膜联蛋白重复序列)C端和一个独特的由30个氨基酸组成的长N端的“头部结构域”(在一些文献中也称为尾部结构域或N-端相互作用结构域)组成,其结构上核心序列一致,分别位于45~58、117~130、216~233、291~304位氨基酸的三级结构特点,包含18个α螺旋,其余大部分为无规卷曲(占33%);相对分子质量为37584,等电点为5.94。分子结构呈扁平桶状,桶壁由4个结构相似的结构域(Ⅰ、Ⅱ、Ⅲ、Ⅳ)组成,每个结构域包含5个螺旋(A、B、C、D、E),以右手超螺旋的形式折叠;结构域的第1和第2个α螺旋的连接部位为一个突出的环,由G、T、K、L、S、I等氨基酸组成的Ca2+结合的位点,其结构特点如下图一。分析显示膜联蛋白B1具有膜联蛋白A1和膜联蛋白A5的相似结构和功能基础,除了其抗炎、抗凝血功能,膜联蛋白B1特有的氨基酸序列与囊尾蚴寄生的种属特异性和组织特异性有关[28]。可调节膜联蛋白与蛋白配体间相互作用和膜联蛋白与膜的相关性,是区分不同亚家族的主要依据[29-30]。其生生物学特征有两方面,一是具有Ca2+依赖性,膜联蛋白只有在Ca2+存在情况下才能与磷脂膜结合;二是这种结合是可逆的,去除Ca2+后,膜联蛋白就与磷脂分开[31]。膜联蛋白B1核心结构域在Ca2+依赖的膜相互作用中对Ca2+的敏感性有细微的不同。因此,不同的膜联蛋白在细胞中可能具有不同的功能[32]。
3 猪囊尾蚴中膜联蛋白介导免疫逃避
寄生性蠕虫的膜联蛋白是较早被鉴定能参加免疫抑制的蛋白家族成员,参与多种生理和细胞的功能。膜联蛋白目前在原虫[33]、线虫[34]、血吸虫[35]和蠕虫[36]均有研究,其研究主要涉及蛋白结构分析和体内外功能验证以及在通路机制上的干预为主,是否参与免疫逃避的确证阐述较少或多为推测,尚未对膜联蛋白介导免疫逃避分子机制进行阐述,特别是猪带绦虫囊尾蚴感染过程中膜联蛋白的功能研究较少,多为基因或蛋白结构性分析和功能推测,其介导的免疫逃避分子机制研究未被广泛涉及。众多学者推测猪囊虫存在的膜联蛋白具有抑制或调节免疫细胞活性的作用,通过宿主免疫球蛋白掩蔽囊尾蚴抗原,从而逃避宿主免疫追踪,因此囊尾蚴囊液中已被证明含有IgG、IgM、IgA和IgE,寄生虫控制天然免疫的另一个关键策略是通过释放的抗原阻断补体系统,抑制经典和替代的补体通路达到抑制其活性的目的[37-38]。已知活囊也分泌半胱氨酸蛋白酶、金属蛋白酶和丝氨酸蛋白酶,这些蛋白酶降解宿主免疫球蛋白,干扰CD4+细胞的增殖和细胞因子的产生,从而影响B细胞产生抗体[39]。例如,以布氏锥虫虫体为代表,其虫体表面的糖膜联蛋白膜抗原不断更新,致使特异性抗体很难捕获新抗原,且一些寄生虫感染往往诱发宿主产生高免疫球蛋白血症,诱导B细胞激活,虽产生大量抗体,但却无明显的保护作用,至感染晚期,虽有抗原刺激,B细胞却不能分泌抗体,说明多克隆B细胞的激活导致了能与抗原反应的特异性B细胞的耗竭,抑制宿主的免疫应答,甚至出现继发性免疫缺陷[40]。猪囊尾蚴之所以能够在宿主体内长期寄生一方面通过抗原的变异来逃避宿主免疫攻击,另一方面通过分泌型蛋白干扰宿主识别从而调节或逃逸宿主的免疫反应达到寄生目的。因此这类囊液中的分泌型蛋白是研究和分析囊尾蚴侵袭和寄生机制的重要手段。研究初步发现膜联蛋白存在于囊液细胞及细胞组分中,具有脂质结合和离子结合功能,参与一系列依赖钙离子的模型生物活动,所以鉴于囊尾蚴囊液中膜联蛋白的表现出在寄生虫入侵机体中的作用,对其免疫逃避机制的探究显得尤为重要。作为膜联蛋白家族成员膜联蛋白B1(GenBank登录号:AF147955)诱导嗜酸性粒细胞凋亡可能是一种防止宿主免疫攻击的新策略,膜联蛋白B1依赖性蛋白激酶的氨基酸序列具有较高的特异性,为猪囊尾蚴病特异性诊断方法的建立提供了可能[41]。
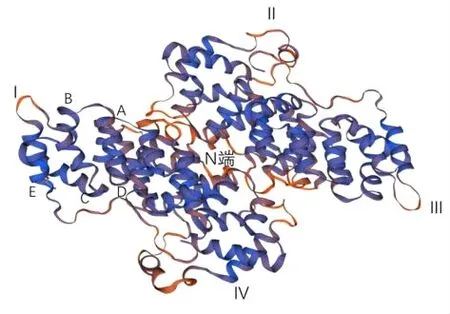
图1 膜联蛋白B1蛋白的结构(SWISS-MODEL数据库)
4 膜联蛋白B1 在猪囊尾蚴免疫逃避中的作用
近些年研究膜联蛋白被认为具有广泛的重要生物学作用,其蛋白量占囊尾蚴总蛋白的2%~3%,提示它可能在猪囊尾蚴的生活史中起重要作用[42]。如膜运输和融合,Ca2+通道活性,抑制蛋白激酶C,抗炎活性,作为细胞凋亡探针或者抗原抗体的特异性结合来诱导免疫细胞凋亡来逃避宿主的免疫攻击等。膜联蛋白B1在猪囊尾蚴中具有阶段特异性表达,另外该蛋白在中间宿主中用作囊虫病疫苗时是非常有效的,因此很容易推测,膜联蛋白B1在寄生虫幼虫期的高表达可能与这种抗原诱导对感染的保护能力有关。这种高表达可能对寄生虫有其他意义,例如维持宿主-寄生虫的平衡,使寄生虫能够在宿主中长时间存活,在许多情况下可伴随宿主存活数年。在囊尾蚴的囊液中以及囊虫病猪和人的血清中都检测到了膜联蛋白B1;免疫化学分析显示,囊尾蚴可以通过主动逃避和抑制免疫而导致无症状的感染[43-44];组织学研究表明,在人和猪中,活的囊尾蚴周围的组织很少或没有的炎症,然而宿主-寄生虫平衡被打破,一个或多个退行性囊肿周围的免疫介导的炎症可以演变成囊虫病。膜联蛋白B1存在于周围的宿主衍生层中,参与囊尾蚴形成包囊[45]。这些寄生虫已经发展出复杂的机制,从而能够在宿主的组织中持续存在。囊尾蚴在宿主中的不均匀分布及其与囊肿形成或包囊的关系的性质可能有助于隔离寄生虫,使其免受免疫攻击。虽然尚未得到充分的证实,但由囊尾蚴分泌的活性因子诱导的免疫细胞凋亡可能是参与免疫逃避的机制之一。
嗜酸性粒细胞在囊尾蚴感染的免疫反应中也具有重要作用。体外试验表明,这些细胞具有损伤或杀死寄生虫幼虫的能力,主要是通过使用抗体依赖的细胞毒性机制。另一方面,绦虫感染是一种慢性疾病,这意味着这类寄生虫制定了避免或防止宿主免疫攻击的策略,因此,分泌的膜联蛋白B1与嗜酸性粒细胞共存的实验观察表明,膜联蛋白B1可能在寄生虫的免疫逃避中起作用[46]。后续研究发现,膜联蛋白B1与嗜酸性粒细胞的结合是Ca2+依赖性的,预先负载钙通道阻断剂可抑制膜联蛋白B1诱导的Ca2+内流,相同浓度的膜联蛋白对嗜酸性粒细胞凋亡作用随着时间、浓度的增加都存在显著差异,也就是说膜联蛋白B1诱导的嗜酸性粒细胞凋亡具有时间和浓度依赖性,易被负载钙通道阻断剂抑制,从而达到抵御宿主防御感染的目的[47-48]。
膜联蛋白某些家族蛋白已经证明也是糖皮质激素抗炎作用的重要介质。地塞米松作为一种合成的糖皮质激素,增加Ca2+并诱导膜联蛋白B1的表达和分泌。当用地塞米松刺激细胞时,膜联蛋白被外化到质膜的外表面,而当细胞预先被负载钙通道阻断剂抑制时,膜联蛋白的分泌被完全阻断[49]。然而当Ca2+的离子载体增加时,没有观察到膜联蛋白B1的分泌。因此这说明增加Ca2+的浓度对膜联蛋白B1的分泌是必要的,但不够充分。除了钙依赖的这个通路外,地塞米松还激活了允许分泌膜联蛋白B1的其他细胞内过程,这一过程将诱导宿主细胞凋亡中起作用,这将有助于降低宿主的免疫应答,促进寄生虫的生存,这一途径还有待进一步研究[50]。
5 展望
囊虫病在世界范围内仍然流行,究其根源为虫体的侵入后宿主免疫学机制是多样复杂的,这些因素包括寄生虫的数量、位置、大小和发育阶段,以及与宿主有关的因素,这些因素可以影响疾病表现的过程和严重程度来体现。尽管研究者已经证实一些囊尾蚴感染存在逃避宿主免疫攻击机制,也推测了囊尾蚴成功感染可能通过自身调节,抑制宿主免疫,引起免疫耐受等作用逃避宿主的免疫攻击,但囊尾蚴与宿主免疫之间复杂的相互作用,还有很多科学问题函待解决,如酶和抑制剂作用的确证、蛋白相互作用的确证等。膜联蛋白是一个广泛存在的蛋白家族,所有真核基因组中广泛表达并稳定,而且它在绦虫的生理活动中起着重要的作用。但是,膜联蛋白在生物学特性和生理功能方面表现出非常复杂的关系,迄今为止,研究者还有许多科学问题尚未阐明(如何与细胞外基质作用;是否参与虫体的糖代谢)等。深入开展膜联蛋白家族成员的研究,丰富囊虫病侵入机制特别是免疫逃避机制的理论,同时,对探寻药物作用靶点阻断该病流行具有重要的意义。

