猪流行性腹泻病毒感染对猪小肠上皮细胞I型干扰素产生通路的影响
丁芳艺 宋海鑫 梁荣 苗晋锋 费荣梅 刘永杰 余祖功 张金秋

摘要: 豬流行性腹泻病毒(Porcine epidemic diarrhea virus, PEDV)是严重危害仔猪肠道健康的病原之一。用病毒感染复数(MOI)=1.0的PEDV感染猪小肠上皮细胞,通过间接免疫荧光试验,证实PEDV能在猪小肠上皮细胞中增殖。通过实时荧光定量PCR(RT-qPCR)检测,发现Toll 样受体3(TLR3)编码基因、视黄醇诱导基因 I/黑色素瘤分化相关基因5(RIG-I/MDA5)的mRNA表达水平分别从感染后2 h、4 h开始显著升高(P<0.05),分别在感染后12 h、24 h达到最高值;线粒体抗病毒信号蛋白(MAVS)编码基因的mRNA相对表达量从感染后6 h开始显著升高(P<0.05),随后基本保持不变。下游接头蛋白质β干扰素TIR结构域衔接蛋白质(TRIF)、肿瘤坏死因子相关因子3(TRAF3)、IκB 激酶ε(IKK-ε)和TANK结合激酶1(TBK1)编码基因的mRNA相对表达量在感染后4 h出现显著上升(P<0.05),随后IKK-ε编码基因的mRNA相对表达量在感染后8 h达到最高值,TRIF、TRAF3和TBK1编码基因的mRNA相对表达量均在感染后12 h达到最高值。干扰素调节因子3(IRF3)编码基因的mRNA相对表达量在感染早期无显著变化,在感染后24 h达到最高值(P<0.05)。与对照组相比,PEDV感染无法诱导猪小肠上皮细胞(IPEC-J2)IFN-β编码基因的mRNA相对表达量显著升高,但能有效抑制Poly(I:C)(聚肌胞苷酸)诱导的IFN-β产生。结果表明,PEDV能够在感染早期激活TLRs、RLRs介导的I型IFN产生通路中相关受体及接头蛋白质的基因表达,但最终能抑制干扰素产生,并能在猪小肠上皮细胞中有效增殖。
关键词: 天然免疫;猪流行性腹泻病毒;猪小肠上皮细胞;I型干扰素
中图分类号: S828.7 文献标识码: A 文章编号: 1000-4440(2021)01-0099-07
Effects of porcine epidemic diarrhea virus infection on IFN-β production pathway in porcine intestinal epithelial cells
DING Fang-yi 1,2,3, SONG Hai-xin 1,2,3, LIANG Rong1,2,3, MIAO Jin-feng2, FEI Rong-mei2, LIU Yong-jie2, YU Zu-gong2, ZHANG Jin-qiu 1,3,4,5
(1.Institute of Veterinary Immunology and Engineering, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, China;2.College of Veterinary Medicine, Nanjing Agricultural University, Nanjing 210095, China;3.Jiangsu Key Laboratory for Food Quality and Safety——State Key Laboratory Cultivation Base, Nanjing 210014, China;4.Jiangsu Co-innovation Center for Prevention and Control of Important Animal Infectious Diseases and Zoonoses, Yangzhou 225009, China;5.College of Pharmacy, Jiangsu University, Zhenjiang 212013, China)
Abstract: Porcine epidemic diarrhea virus (PEDV) is one of the pathogens that seriously endanger the intestinal health of piglets. Porcine intestinal epithelial cells (IPEC-J2) were infected with PEDV at a multiplicity of infection MOI of 1.0. Virus proliferation in IPEC-J2 was observed by indirect immunofluorescence assay (IFA). Through real-time fluorescent quantitative PCR (RT-PCR) detection, it was found that the mRNA levels of TLR3 encoding gene and RIG-I/MDA5 significantly increased from 2 hours post infection (hpi) and 4 hpi, respectively (P<0.05), and peaked at 12 hpi and 24 hpi. The relative mRNA expression of mitochondrial antiviral signaling protein (MAVS) coding gene significantly increased at 6 hpi (P<0.05), and then remained unchanged. The mRNA levels of TRIF, TRAF3, IKK-ε and TBK1 coding genes significantly increased from 4 hpi (P<0.05), and then the relative mRNA expression of IKK-ε encoding genes reached the highest level at 8 hpi while TRIF, TRAF3 and TBK1 encoding genes at 24 hpi. The relative mRNA expression of interferon regulatory factor 3 (IRF3) encoding gene showed no significant change at the early stage after infection, and reached the highest level at 12 hpi. Compared with control group, there was no significant difference of IFN mRNA expression in IPEC-J2 infected with PEDV. However, PEDV infection could inhibit the production of IFN-β induced by Poly(I:C). The results suggested that PEDV could activate TLRs and RLRs signaling pathway in the early stage after infection, and effectively proliferate in IPEC-J2 by inhibiting IFN-β.
Key words: innate immunity;porcine epidemic diarrhea virus;porcine intestinal epithelial cells;type I interferon
猪流行性腹泻病毒(Porcine epidemic diarrhea virus, PEDV)是具有囊膜的单股正链RNA病毒,属于冠状病毒科、α冠状病毒属,是近年来导致新生仔猪急性肠炎及水样腹泻致死的主要病原之一,给养殖业带来了巨大威胁[1]。尤其是2010年以来,随着PEDV新变异株的出现,美洲、欧洲及亚洲的多个国家再次暴发猪流行性腹泻,使养猪业遭受了严重的经济损失[2]。
PEDV基因组全长约为28 kb,含有5′端帽子结构和3′端Poly(A)尾巴,从5′端开始,依次为5′端非翻译区(Untranslated region,UTR)、7个开放阅读框(Open reading frame, ORF)(包括ORF1a、ORF1b、ORF2~ORF6)和3′端UTR[3]。病毒感染细胞后,病毒基因组RNA及其在复制过程中产生的单链RNA(ssRNA)、双链RNA(dsRNA)能够被胞质中的(RIG-I)样受体家族(RIG-I-like receptors,RLRs)或内体中Toll 样受体家族(Toll-like receptors,TLRs)识别,通过视黄醇诱导基因(RIG-I)/黑色素瘤分化相关基因5(MDA5)/线粒体抗病毒信号蛋白质(Mitochondrial antiviral-signaling protein,MAVS)或/和TLR3/β干扰素TIR结构域衔接蛋白质(TIR domain-containing adaptor inducing IFN-β,TRIF)等通路进行信号传递,促进I型IFN及相关促炎细胞因子的产生,发挥细胞的抗病毒功能,这是宿主细胞抵御病毒入侵的第一道防线[2]。
近年来的大量研究发现,PEDV能够通过不同方式抑制I型IFN的产生[4-5],但是具体的分子机制尚未完全明确。本研究以PEDV经典毒株CV777作为模式株,用其感染猪小肠上皮细胞,检测宿主细胞相关受体TLR3、RIG-I以及MDA5和重要接头蛋白质TRIF、MAVS、肿瘤坏死因子相关因子3(TNF receptor-associated factor 3,TRAF3)、TANK结合激酶1(TBK1)、IκB 激酶ε(IKK-ε)、干扰素调节因子3(Interferon regulatory factor 3, IRF3)、效应分子IFN-β表达水平的变化,以期深入了解宿主细胞抵御PEDV感染及机体整体天然免疫变化的规律,为进一步理解宿主清除PEDV的免疫机制及PEDV的拮抗机制提供理论依据。
1 材料与方法
1.1 主要试验材料
PEDV CV777株、猪小肠上皮细胞(IPEC-J2),由笔者所在实验室保存;PEDV-N蛋白单克隆抗体,由笔者所在实验室制备;羊抗鼠荧光二抗,购自北京Solarbio科技有限公司;RNA提取试剂盒、反转录试剂盒、荧光定量PCR试剂,购自TaKaRa公司;转染试剂Lipofectamine 3000 Reagent Protocol,购自Invitrogen公司;Poly(I:C)(聚肌胞苷酸)购自Sigma Aldrich公司。
1.2 试验方法
1.2.1 细胞培养与病毒增殖 将冻存的IPEC-J2细胞从液氮罐中取出,在37 ℃水浴中快速融化后于1 000 r/min离心10 min。弃去冻存液,加入完全培养基(含有10%胎牛血清的DMEM)重悬细胞后,将重悬细胞液转移至25 cm2培养瓶内,置于37 ℃、体积分数为5%的CO2培养箱内。当细胞铺满至单层后,将细胞传代,接种至6孔板中,待细胞汇合度达到90%左右时,按病毒感染复数(MOI)=1.0接种PEDV病毒,置于37 ℃、体积分数为5%的CO2培养箱中继续培养。
1.2.2 间接免疫荧光 将IPEC-J2细胞接种于24孔板中,分别按MOI=0.1、MOI=1.0接种PEDV,设置未接毒的阴性对照。培养24 h后弃去细胞培养液,用磷酸缓冲盐溶液(PBS)清洗3遍,随后加入固定液,用PBS清洗3遍,加入0.2% TritonX-100于室温孵育后,用PBS清洗3遍,再用5%牛血清白蛋白(BSA)封闭1 h,然后用PBS清洗3遍,加入PEDV N蛋白抗体于37 ℃孵育1 h,用PBS清洗3遍,加入荧光二抗,于37 ℃避光孵育1 h,用PBS清洗3遍后在倒置荧光显微镜下观察。
1.2.3 细胞转染 将IPEC-J2細胞接种至6孔板中,待细胞汇合度约为90%时,用不含有血清的Opti-MEM培养基(125 μl)稀释Lipofectamine 3000(5 μl)试剂,充分混匀。随后用不含血清的Opti-MEM培养基(125 μl)稀释Poly(I:C)(Sigma),再添加10 μl P3000试剂制备Poly(I:C)预混液,充分混匀后在室温下孵育15 min。将混合后的复合物加入6孔板中,培养6 h后更换培养液,于37 ℃孵育,24 h后收集样品,提取细胞总RNA。
1.2.4 细胞总RNA的提取及cDNA的合成 用RNA提取试剂盒(TaKaRa)提取细胞样品的RNA,采用反转录试剂盒合成cDNA,反应体系如下: 2 μl 5×PrimeScript RT Master Mix(Perfect Real Time),500 ng总RNA,用RNase Free dH2O补足总体积至10 μl。将上述溶液混匀后,设置如下反应程序:37 ℃ 15 min,85℃ 5 s,4 ℃终止反应。将得到的cDNA储存于-20 ℃,用于后续试验。
1.2.5 实时荧光定量RT-qPCR 以方法1.2.4中合成的cDNA为模板进行实时荧光定量PCR(RT-qPCR)。20 μl反应体系如下: 10 μl 2×TB Green Premix Ex TaqTMⅡ(Tli RNaseH Plus),0.8 μl PCR Forward Primer(10 μmol/L),0.8 μl PCR Reverse Primer(10 μmol/L),2 μl DNA模板,6.4 μl RNase Free dH2O。PCR反应条件: 95 ℃ 30 s预变性,95 ℃ 5 s,60 ℃ 30 s,40个循环。每个样品设3个重复,用2-△△Ct法计算结果。扩增引物序列见表1。
1.2.6 数据处理与分析 用GraphPad Prism 6软件作图并分析数据,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
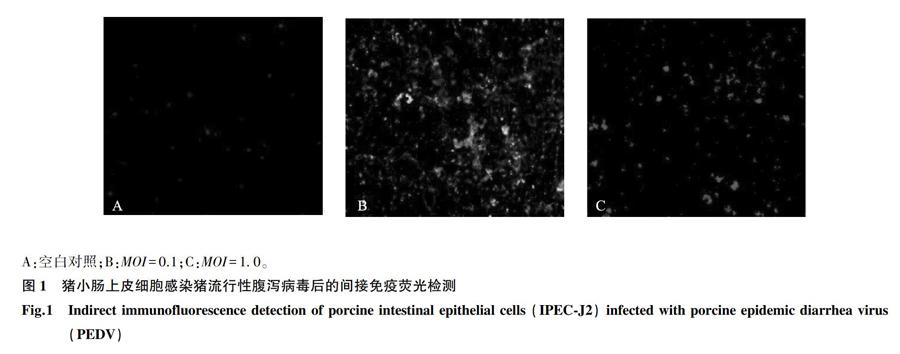
2.1 PEDV感染IPEC的间接免疫荧光检测
分别按MOI=0.1、MOI=1.0对猪小肠上皮细胞接种PEDV,24 h后收集样品,固定、封闭后加入PEDV N蛋白抗体和荧光二抗,通过荧光显微镜观察病毒的增殖情况。由图1可以看出,感染后24 h在猪小肠上皮细胞中能有效地检测到PEDV N蛋白的表达,且N蛋白表达量与病毒感染剂量呈正相关。
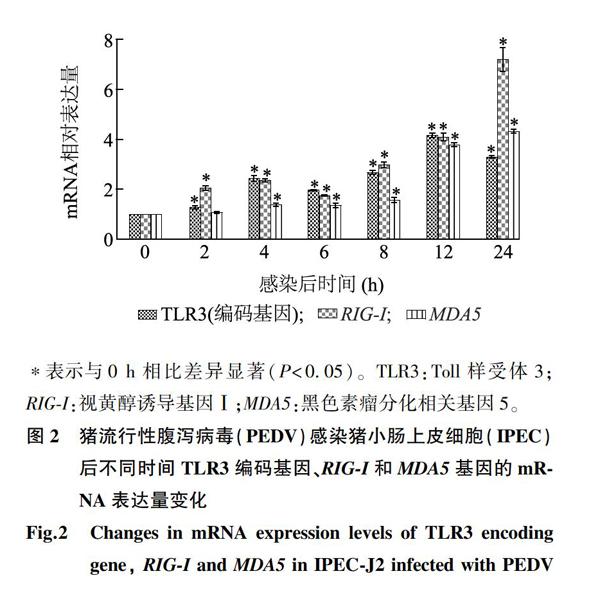
2.2 TLRs及RLRs信号通路中不同受体在mRNA相对表达量上的变化
猪小肠上皮细胞按MOI=1感染PEDV后,分别于感染后0 h、2 h、4 h、6 h、8 h、12 h、24 h收集细胞。提取各时间点样品的RNA,反转录成cDNA,以cDNA为模板进行RT-qPCR检测,观察TLRs、RLRs信号通路中相关受体编码基因在病毒感染后24 h内mRNA表达水平的动态变化。由图2可以看出,与对照组相比,TLR3编码基因以及RIG-I、MDA5的mRNA相对表达量均在感染后出现显著变化,其中TLR3编码基因、RIG-I的mRNA相对表达量从感染后2 h开始显著升高(P<0.05),MDA5的mRNA相对表达量从感染后4 h开始显著升高(P<0.05),TLR3编码基因和RIG-I、MDA5的mRNA相对表达量在感染后12 h或24 h达到最高值。
2.3 TLRs及RLRs信号通路中关键接头蛋白质在mRNA相对表达量上的变化
用MOI=1.0的PEDV感染IPEC-J2,分别于感染后0 h、2 h、4 h、6 h、8 h、12 h、24 h收集样品,通过RT-qPCR方法观察TLRs和RLRs通路中不同蛋白质在mRNA表达水平的变化。由图3可以看出,TRIF、TRAF3编码基因的mRNA相对表达量在感染后4 h出现显著上升(P<0.05),之后稍微下降,又于感染后24 h达到最高值。MAVS编码基因的mRNA相对表达量在感染后6 h开始显著上升(P<0.05),在感染后8 h、12 h、24 h之间无显著差异。IKK-ε、TBK1编码基因的mRNA相对表达量均于感染后4 h出现显著上升(P<0.05),随后IKK-ε编码基因的mRNA相对表达量在感染后8 h达到最高值,而TBK1編码基因的mRNA相对表达量在感染6 h后先稍有下降后又上升,至感染后24 h时达到最高值(P<0.05)。IRF3编码基因的mRNA相对表达量在感染早期(感染后0~8 h)无显著变化,在感染后12 h达到最高值(P<0.05)。
2.4 TLRs及RLRs信号通路效应分子IFN-β在mRNA表达水平上的变化
用MOI=1.0的PEDV感染IPEC-J2细胞,并向其中1组转染1 μg Poly(I:C),同时设置不接种病毒的阴性对照和只转染Poly(I:C)的阳性对照。结果显示,PEDV感染后对IPEC-J2细胞中的IFN-β在mRNA表达水平上无显著影响,但是能够有效抑制Poly(I:C)诱导IFN-β,详见图4。
3 讨论
PEDV的体外培养一直是业内的难题,Hofmann等[6]最早于1988年首次在添加了胰酶的Vero(非洲绿猴肾细胞)中成功扩增出PEDV。目前,PEDV的体外复制和增殖主要是在Vero细胞上进行的,并缺失I型IFN基因簇,进而导致I型IFN表达缺陷,因此不适合用于研究病毒对宿主细胞天然免疫的影响。另外,MARC-145(非洲绿猴胚胎肾细胞)、LLC-PK1(猪肾细胞)和ST(猪睾丸细胞)等细胞系也曾被用于PEDV的体外研究,但是这些细胞并非PEDV等肠道冠状病毒感染的靶细胞,因此可能无法真实反映病毒拮抗宿主天然免疫反应的变化规律。近年来,猪小肠上皮细胞系IPEC-J2在研究PEDV的致病机制过程中发挥了重要作用。作为PEDV感染的主要靶细胞,IPEC-J2可能更适于研究病毒对宿主天然免疫的影响及调节作用。因此,本研究选择IPEC-J2进行试验。
本研究首先观察了PEDV在IPEC-J2细胞中的增殖情况,结果发现:用不同MOI的PEDV感染IPEC-J2细胞后,24 h内均能检测到PEDV N蛋白的表达,且N蛋白表达量与病毒感染复数呈正相关,表明PEDV能够有效感染IPEC-J2细胞,并能在细胞内有效增殖,这为下一步研究PEDV感染对IPEC-J2细胞中I型IFN产生通路中的相关受体、接头蛋白质及效应蛋白质的影响奠定了基础。
天然免疫在限制病毒的感染和早期扩散方面发挥着重要作用。宿主细胞可通过不同模式识别受体以感知病毒的入侵,主要包括TLRs、RLRs、C型凝集素受体家族(CLRs)及核苷酸寡聚化结构域样受体家族(NLRs)等[7]。其中与RNA病毒感染密切相关的是由RLRs、TLRs介导的信号转导途径。RNA病毒感染细胞后,病毒基因组RNA及复制过程中产生的ssRNA、dsRNA被胞质中的RIG-I/黑色素瘤分化相关基因5识别,随后通过MAVS传递信号,招募TRAF3/6,进一步激活TBK1/IKK激酶复合体并使其发生磷酸化,最终使NF-κB、IRFs等核转录因子磷酸化,形成同二聚体或异二聚体,然后进入细胞核,启动 Ⅰ 型干扰素转录。本研究发现,PEDV感染IPEC-J2细胞后,RIG-I、MDA5等受体及TRAF3、TBK1等接头蛋白质编码基因的mRNA相对表达量分别从感染后2 h或4 h开始显著升高(P<0.05),在感染后12 h或24 h达到最高值,表明病毒RNA或复制过程中产生的大量ssRNA或dsRNA能够被胞浆中相应的模式识别受体RIG-I、MDA5等感知并识别,相关受体及接头分子均被快速激活,进而启动下游信号传递。另外,关键接头蛋白质MAVS编码基因的mRNA相对表达量在感染后6 h开始显著上升(P<0.05),随后基本保持不变,提示MAVS发挥其信号传递作用可能与其mRNA表达水平的关系不密切,这与笔者所在实验室前期针对流感病毒的研究结果一致[8]。目前的研究结果表明,MAVS的活化及下游信号传递与N端的CARD样结构域和C端的TM结构密切相关,两者共同介导MAVS复合体的构象改变、泛素化降解及下游的信号传递。在此过程中,MAVS在蛋白质水平的降解对其介导的I型IFN的产生是必不可少的[9-10]。
進入内体中的病毒RNA能够被胞内受体如TLR3、TLR7或TLR8识别,进而招募其下游接头蛋白质,如MyD88、TRIF、TRAF3/6等,并将信号传递给NF-κB、IRFs等核转录因子,进而诱导Ⅰ型干扰素及促炎症细胞因子的产生。本试验结果表明,TLR3编码基因的mRNA相对表达量从感染后2 h开始显著升高(P<0.05),在感染后12 h即达到最高值;TRIF、TRAF3编码基因的mRNA相对表达量从感染后4 h开始显著升高(P<0.05),在感染后24 h达到最高值,表明病毒复制过程中产生的部分dsRNA能够被内体中TLR3受体快速识别并激活下游的信号传递过程。由此可见,PEDV感染猪小肠上皮细胞可以激活TLR3等受体途径,进而引起NF-κB活化,这与Cao等[11]的研究结果一致。
Poly(I:C)是dsRNA类似物,进入细胞后可以激活TLRs和RLRs信号通路,诱导细胞产生干扰素[12]。本试验以Poly(I:C)作为阳性对照,发现按MOI=1.0对IPEC-J2细胞接种PEDV 24 h后,细胞中的IFN-β编码基因在mRNA表达水平无显著变化,并且发现PEDV能够有效抑制Poly(I:C)诱导的IFN-β产生,这与孙敏[13]的研究结果一致。但李亮[14]研究发现,用MOI=5.0的PEDV-JMS毒株感染回肠类器官细胞后,IFN-α编码基因的mRNA表达水平在感染24 h内升高了2倍,推测可能与毒株特性、细胞模型及病毒的感染剂量有关,具体有待于进一步验证。
综上所述,PEDV能够激活TLRs/RLRs及下游关键接头蛋白质的表达,但是最终能够抑制Ⅰ型IFN的产生,从而在猪小肠上皮细胞中有效增殖,推测PEDV对该天然免疫信号通路仍存在负调控机制。如Cao等[15]的研究发现,PEDV可以抑制RIG-I、MAVS介导的IFN-β启动子活性,但不能下调TBK1/IKK-ε介导的IFN-β启动子活性,因此推测PEDV阻断IFN-β信号传递的作用位点在TBK1/IKK-ε上游。此外,还有研究发现,PEDV编码的N蛋白、木瓜样蛋白酶(PLP),Nsp1、Nsp5编码的3CLpro及Nsp7可能参与调控宿主细胞的I型IFN应答[16-20]。由此可见,关于PEDV编码蛋白质参与调控宿主I型IFN应答的分子机制仍需进一步探索,这也是今后研究的重点。
参考文献:
[1] CAVANAGH D. Nidovirales: a new order comprising Coronaviridae and Arteriviridae[J]. Archives of Virology, 1997, 142(3): 629-633.
[2] SUN R Q, CAI R J, CHEN Y Q, et al. Outbreak of porcine epidemic diarrhea in suckling piglets, China[J]. Emerging Infectious Diseases, 2012, 18(1): 161-163.
[3] KOCHERHANS R, BRIDGEN A, ACKERMANN M, et al. Completion of the porcine epidemic diarrhoea coronavirus (PEDV) genome sequence[J]. Virus Genes, 2001, 23(2): 137-144.
[4] XING Y L, CHEN J F, TU J, et al. The papain-like protease of porcine epidemic diarrhea virus negatively regulates type I interferon pathway by acting as a viral deubiquitinase[J]. The Journal of General Virology, 2013, 94(7): 1554-1567.
[5] DING Z, FANG L R, JING H Y, et al. Porcine epidemic diarrhea virus nucleocapsid protein antagonizes beta interferon production by sequestering the interaction between IRF3 and TBK1[J]. Journal of Virology, 2014, 88(16): 8936-8945.
[6] HOFMANN M, WYLER R. Propagation of the virus of porcine epidemic diarrhea in cell culture[J]. Journal of Clinical Microbiology, 1988, 26(11):2235-2239.
[7] THOMPSON M R, KAMINSKI J J, KURT-JONES E A, et al. Pattern recognition receptors and the innate immune response to viral infection[J]. Viruses, 2011, 3(6): 920-940.
[8] ZHANG J Q, MIAO J F, HOU J B, et al. The effects of H3N2 swine influenza virus infection on TLRs and RLRs signaling pathways in porcine alveolar macrophages[J]. Virol Journal, 2015, 12: 61.
[9] KAWAI T, TAKAHASHI K, SATO S, et al. IPS-1, an adaptor triggering RIG-I- and Mda5-mediated type I interferon induction[J]. Nature Immunology, 2005, 6(10): 981-988.
[10]XU L G, WANG Y Y, HAN K J, et al. VISA is an adapter protein required for virus-triggered IFN-β signaling[J]. Molecular Cell, 2005, 19(6): 727-740.
[11]CAO L Y, GE X Y, GAO Y, et al. Porcine epidemic diarrhea virus infection induces NF-κB activation through the TLR2, TLR3 and TLR9 pathways in porcine intestinal epithelial cells[J]. Journal of General Virology, 2015, 96(7): 1757-1767.
[12]MIAN M F, AHMED A N, RAD M, et al. Length of dsRNA (poly I:C) drives distinct innate immune responses, depending on the cell type[J]. Journal of Leukocyte Biology, 2013, 94(5): 1025-1036.
[13]孙 敏. 猪流行性腹泻病毒遗传变异规律与Ⅰ型干扰素逃避机制[D]. 南京:南京农业大学, 2017.
[14]李 亮. 猪肠类器官模型的建立及干扰素λ在肠道黏膜免疫中抗猪流行性腹泻病毒(PEDV)作用机制的研究[D]. 北京: 中国农业大学, 2019.
[15]CAO L Y, GE X Y, GAO Y, et al. Porcine epidemic diarrhea virus inhibits dsRNA-induced interferon-β production in porcine intestinal epithelial cells by blockade of the RIG-I-mediated pathway[J]. Virology Journal, 2015, 12: 127.
[16]DING Z, FANG L, JING H, et al. Porcine epidemic diarrhea virus nucleocapsid protein antagonizes beta interferon production by sequestering the interaction between IRF3 and TBK1[J]. Journal of Virology, 2014, 88(16): 8936-8945.
[17]XING Y L, CHEN J F, TU J, et al. The papain-like protease of porcine epidemic diarrhea virus negatively regulates type Ⅰ interferon pathway by acting as a viral deubiquitinase[J]. Journal of General Virology, 2013, 94(7): 1554-1567.
[18]ZHANG Q Z, SHI K C, YOO D W. Suppression of type Ⅰ interferon production by porcine epidemic diarrhea virus and degradation of CREB-binding protein by nsp1[J]. Virology, 2016, 489: 252-268.
[19]ZHU X Y, FANG L R, WANG D, et al. Porcine deltacoronavirus nsp5 inhibits interferon-β production through the cleavage of NEMO[J]. Virology, 2017, 502: 33-38.
[20]李紅杰,王晓雪,高冬生,等. 猪流行性腹泻病毒Nsp7的亚细胞定位和对Ⅰ型干扰素应答的影响[J]. 畜牧兽医学报, 2017, 48(3): 501-507.
(责任编辑:徐 艳)
收稿日期:2020-09-15
基金项目:国家自然科学基金项目(31772701);江苏省农业科技自主创新基金项目[CX(17)3027]
作者简介:丁芳艺(1995-),男,江西上饶人,硕士,主要从事畜禽疫病防控方向的研究。(E-mail)dingfy0526@163.com。宋海鑫为共同第一作者。
通讯作者:张金秋,(E-mail)jqzh03@126.com

