2020年全球传染病重要疫情事件回顾
焦艳梅,揣征然,赵雅琳,闫晶晶,孙志杰,张云辉,王永怡,Quanjian Yan,王福生
2020年,新型冠状病毒(新冠病毒)肆虐全球。突如其来的新型冠状病毒肺炎(新冠肺炎)疫情,让全世界陷入恐慌,人类基本的生活秩序、工作秩序被打乱,全球经济受到重创。疫情初期,大量患者涌现,医院人满为患,医疗资源被严重挤兑,死亡人数剧增。医护人员用着简陋的防护装备,超负荷工作,大量人员被感染。疫情出现仅半月,科研人员便确定病原体并获得基因序列,不到10个月便研发出疫苗并快速应用。年底,多种疫苗开始应用,让人类看到了曙光。但是,在热带雨林里,还有诸多病毒在窥视着人类,埃博拉病毒、马尔堡病毒、黄热病毒、拉沙病毒等随时有可能潜入人群。各种高致病性H5N1、H5N6、H7N9禽流感病毒等正在加速进化。人类自身的行为对于地球生态环境的破坏已经到了无以复加的地步,全球气候变暖、洪水泛滥、热带雨林消失、动物栖息地被破坏等,这些变化使得自然疫源性疾病大量侵入人类社会。2020年的疫情,使人们再次领略到地球村的狭小和脆弱,体会了地球彼端的传染病距你我只隔一个机舱门的距离。保护地球家园、善待地球村每一个生命、One Health理念,不能仅仅停留在概念上,而是到了全体村民付诸实践的时候了。
1 新冠肺炎疫情肆虐全球
2019年12月下旬,中国湖北武汉出现了不明原因的群发肺炎病例,先期出现的几十例病例与华南海鲜市场有关,患者症状类似于2003年的SARS。2020年1月武汉市病例数急剧增加,疫情迅速向全国其他省份扩散。对患者呼吸道样本测序分析显示病原体是一种新型的冠状病毒,WHO将该病原体命名为“2019-nCoV”,国际病毒分类委员会命名为“SARS-CoV-2”,将此次SARS-CoV-2引起的不明原因肺炎命名为“COVID-19”,中文名为“新型冠状病毒肺炎”,简称“新冠肺炎”。中国暴发新冠肺炎疫情的同时,世界各国同一时期迅速出现大量新冠肺炎类似病例,而且大量医护人员在抢救患者时被感染,全球疫情形势严峻。至2月底,中国累计报告确诊病例约79 000例,死亡2837例。其他50个国家出现病例4719例,死亡67例。WHO于1月31日宣布此次疫情为国际关注的突发公共卫生事件,2月28日,将疫情全球风险级别由“高风险”提高为“非常高风险”,3月11日宣布新冠肺炎疫情为全球大流行[1-4]。
2月份以前,中国是疫情的中心。中国于1月23日对武汉市进行了“封城”,同时发起了针对新冠肺炎疫情的全国性运动,实行交通限制,控制人员流动,全国居民尽最大可能居家隔离,国家先后派出300多支医疗队共4万余名医护人员支援武汉。经过全国上下一致努力,疫情于2月下旬得到明显控制,患者得到了很好地救治。到3月中旬,全国本土新增病例数趋于零。4月6日,武汉解除“封城”,4月15日,所有援鄂医疗队撤离完毕,4月26日,武汉在院新冠肺炎患者清零。此后,陆续在东北边境、西南边境、北京、大连冷冻水产品批发市场、新疆边境、北京首都机场、石家庄国际机场附近暴发了由输入性病例引起的局部暴发疫情,但是经过实施“武汉抗疫模式”,局部疫情均得到成功控制[3-4]。截至2020年底,我国大陆地区累计报告确诊病例约89 800例,累计治愈出院约85 000例,死亡约 4600 例[5]。
3月份以后,欧洲和美国新冠肺炎病例数急剧上升,呈指数级增长,成为了疫情的中心。面对严峻的疫情,全世界采取保持“社交距离”的方式减少病毒的传播,多数民众居家隔离,全球经济活动大多处于“停摆”状态。中国和一些国家经过实践证明,在无疫苗预防、无特效治疗药物的情况下,戴口罩、正确洗手、保持社交距离、追踪传染源和接触者,严格集体隔离等措施是应对新冠肺炎疫情的有效手段,但是有一些地区难以有效实施,加之部分人群对于戴口罩有偏见,使本来发展迅猛的疫情更加不易控制。欧洲和美洲多国在春季和秋冬季的2次反复高涨疫情中,曾反复实施局部地区、社区封锁隔离措施,但是仍然不能有效控制感染人数的上升[6-7]。2020年底,在欧洲和美洲部分国家暴发了新一轮疫情。截至12月31日,全球累计新冠肺炎确诊病例8147.5 万例,累计死亡病例179.8万例。仅12月31日当天全球新增新冠肺炎确诊病例692 018例,新增死亡病例13 941例,创疫情暴发以来单日死亡病例数最高纪录[8]。美国确诊病例数突破2000万例,死亡病例数突破35万例。印度确诊病例数突破1000万例,死亡病例数突破14万例。巴西确诊病例数位居全球第三位,达到761万例,死亡病例数超过18万例。确诊病例数超过200万国家的还有俄罗斯、法国、英国、土耳其、意大利[8-9]。
虽经过全球专家近1年探索,抗新冠病毒临床药物方面仍然没有实质性进展。WHO发起的“团结试验”中期结果表明,瑞德西韦、羟氯喹、洛匹那韦/利托那韦以及干扰素治疗在防止新冠肺炎患者死亡或缩短住院时间方面几乎没有效果。而单克隆抗体的效果比较显著[10]。
从疫情开始,全球就将征服本次新冠肺炎疫情的希望寄托在疫苗上。2020年3月,我国基于腺病毒载体和美国基于mRNA技术平台研制的新冠疫苗率先进入临床试验,随后DNA疫苗、灭活疫苗也相继开展临床试验。截至2020年12月,全球已有基于灭活疫苗、核酸疫苗(包括DNA疫苗和mRNA疫苗)、载体疫苗、蛋白亚单位疫苗、减毒活疫苗、病毒样颗粒疫苗等6种不同技术路线的60种候选疫苗被批准进入临床试验,部分疫苗获批附条件上市或紧急使用。俄罗斯分别于8月和10月率先上市2种该国研制的疫苗卫星-V(Sputnik V)和EpiVacCorona。12月,英国、加拿大、沙特、巴林、美国等多国已经批准了2款mRNA新冠疫苗(Pfizer/BioNTech联合疫苗和Moderna疫苗)紧急使用[7,11]。12月30日,我国药品监督管理局批准首个新冠肺炎灭活疫苗(国药集团新冠肺炎灭活疫苗)附条件上市[12]。
2 刚果(金)第十次埃博拉疫情年中结束,第十一次疫情年底结束
刚果(金)第十次埃博拉疫情暴发于2018年8月,地点在刚果(金)北基伍、南基伍和伊图里省。此次疫情是全球有记录以来第二次严重的埃博拉疫情,仅次于2013—2016年暴发于西非地区几内亚、塞拉利昂和利比里亚等国的埃博拉疫情(该疫情报告了2.85万例病例,1.13万例死亡病例)。疫情暴发后截至2018年底,累计报告608例病例,368例死亡病例。2019年7月17日,WHO宣布刚果(金)2018年暴发的埃博拉疫情为国际关注的公共卫生紧急事件[3,13]。2019年下半年疫情逐渐缓解,截至2019年底,累计报告3380例病例,2232例死亡病例。2020年上半年仅出现少量散发病例,截至6月中旬,累计报告3470例病例(儿童占28.0%),2287例死亡病例。WHO于2020年6月25日宣布,刚果(金)历时2年的第十次埃博拉疫情结束。在本次疫情应对中,尽管国际机构和当地部门在医疗方面取得了很大进展,但不安全形势一直是应对行动中的一个主要障碍,医疗设施曾遭到约300多次袭击,导致11名医务人员和患者死亡。除了武装暴力,受影响社区普遍存在的不信任感增加了额外的困难[14]。
然而,刚果(金)第十次疫情结束之前,第十一次疫情又在该国的赤道省暴发。2020年6月1日,WHO宣布,刚果(金)赤道省姆班达卡万加塔卫生区暴发新的埃博拉疫情。基因测序结果显示,此次埃博拉疫情与此前北基伍省的埃博拉疫情无关联,亦与赤道省2018年的埃博拉疫情无关,因此系第十一次埃博拉疫情。得益于先前应对疫情经验和各界的共同努力,本次疫情中出现病例数较少,10月以后未再出现新增病例。11月18日,刚果(金)卫生部宣布,该国第十一次埃博拉疫情结束。第十一次疫情中,累计报告130例病例(确诊119例,临床诊断11例),死亡55例,治愈75例[7,15]。由于新冠肺炎疫情大流行,导致当地医疗资源紧张,但是在当地政府和100多名WHO专家的指导下,急救人员与社区成员密切合作,迅速行动,终于扑灭了这次疫情。WHO警示,埃博拉病毒存在于该地区的动物宿主中,且可以在幸存者的一些体液中持续存在几个月,在一些特殊的情况下可能导致继发传播。虽然第十一次疫情已经结束,但仍有必要继续保持警惕,并保持强有力的监测,因为未来几个月可能会继续暴发疫情[16]。
2种抗病毒药物REGN-EB3和mAb114在本次疫情中继续发挥救治作用。REGN-EB3和mAb114的疗效在2018年11月—2019年8月的临床试验中得到了证实。该试验共入组了681例患者,分为4组,分别使用ZMapp、Remdesivir、mAb114、REGN-EB3治疗,其中ZMapp用作对照。研究的主要终点指标是治疗28 d的病死率。结果显示:ZMapp、Remdesivir、mAb114、REGN-EB3各组患者病死率分别为49.7%(84/169)、53.1%(93/175)、35.1%(61/174)、33.5%(52/155);另外,早期接受治疗且血液病毒载量较低的患者中,病死率分别为:24.5%(24/98)、29.0%(29/100)、9.9%(10/101)、11.2%(10/89)[17-18]。因此,REGNEB3和mAb114疗效较好,并在后续的埃博拉病毒病救治中进一步推广和验证。Remdesivir被淘汰出局后,于2020年用于抗新冠病毒治疗,但是临床疗效不佳,目前WHO不推荐使用,但是美国仍在广泛使用。
REGN-EB3是由Regeneron公司研发的一款含3种全人IgG单克隆抗体的抗体鸡尾酒疗法,用于治疗由扎伊尔型埃博拉病毒引起的感染,该药可用于成人和儿童感染者。REGN-EB3于2020年10月获得美国FDA批准,获批时的药名为Inmazeb,这是美国FDA批准的第一个用于治疗埃博拉病毒感染的药物[19]。mAb114是由Ridgeback Biotherapeutics公司研发的一种单克隆抗体药物,是从刚果(金)1995年埃博拉疫情中幸存者的体内分离出的单克隆抗体,可与扎伊尔型埃博拉病毒表面蛋白的核心受体结合,阻止病毒感染细胞。mAb114于2020年12月获得美国FDA批准,获批时的药名为Ebanga,这是美国FDA批准的第二个用于治疗埃博拉病毒感染的药物,是FDA批准的惟一一款以冻干形式提供的单次注射埃博拉病毒病药物[20]。这2种药物对于埃博拉病毒病的治疗具有里程碑式的意义。
2种埃博拉疫苗在近2次疫情出现数天内即得到快速应用,减缓了埃博拉疫情的蔓延。2018年8月疫情开始后,在疫区使用了默克公司生产的疫苗Ervebo。Ervebo是一种减毒活疫苗,由改造过的水疱性口炎病毒和扎伊尔型埃博拉病毒表面的一个蛋白组成,用于预防由扎伊尔型埃博拉病毒引起的感染。初步研究结果显示,疫苗具有97.5%的保护效力。在2014—2016年西非3国埃博拉疫情末期,曾在几内亚进行该疫苗的临床试验,结果显示免疫效果显著。Ervebo于2019年底被欧盟和美国紧急批准许可上市,是全球首个获得监管批准的埃博拉疫苗,标志着一个历史性的里程碑[20]。2020年2月开始,刚果(金)、布隆迪、加纳和赞比亚等多国陆续对Ervebo发放许可证。强生公司的2针免疫方案(Ad26.ZEBOV,MVA-BNFilo)也于2019年10月大规模投入应用,供给暂时不存在埃博拉病毒活跃传播地区的高危人群,作为进一步扩大预防该病毒传播的额外手段。该疫苗须要接种2剂,第一剂是包含埃博拉表面蛋白但无复制功能的腺病毒,8周后再接种第二剂,包含几种埃博拉病毒蛋白的改造天花病毒。该疫苗于2020年6月获得欧盟批准。
3 登革热疫情较2019年明显减弱
经历了2019年有记录以来最严重的登革热疫情后,2020年全球登革热病例数大幅度减少。
2020年,全球两大登革热多发地区之一——美洲地区,累计报告2 247 358例登革热病例,较2019年的3 167 542例下降了28.9%。作为近年全球报告登革热病例最多的国家,巴西病例数仍然占美洲地区总病例数的63.4%,为1 418 296例(死亡528例),较2019年的2 248 570例下降36.9%。2020年美洲地区大多数国家病例数较2019年大幅度下降,但巴拉圭病例数较2019年大幅度增加,由2019年的11 811例猛增到223 782例,上升了1794.7%,即增加了17.74倍,是过去10年来最严重的疫情[21]。巴拉圭卫生部门认为,受新冠肺炎疫情影响,该国日常工作秩序被打乱,居民大量将垃圾堆放于生活区,适逢雨季,大量蚊虫孳生,导致今年登革热病例数骤增[22]。南美洲地区病例数较多的其他国家见表1[21]。
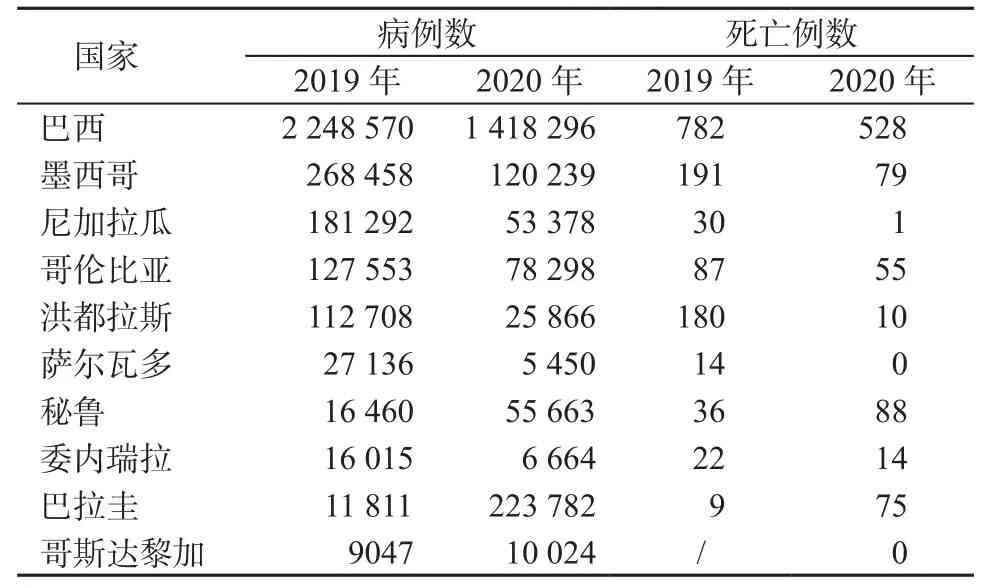
表1 2019—2020年南美洲登革热病例数较多的国家(例)Table 1 Countries with more cases of dengue fever in South America from 2019 to 2020(cases)
全球第二个登革热多发地区——东南亚地区,登革热病例数也较2019年大幅减少。往年病例数最多的菲律宾由2019年的437 536例下降到2020年的83 155例,下降了81.1%。其他国家也都有大幅度下降,其中以孟加拉国下降幅度最大,下降了99.0%,下降幅度如此之大的原因之一是2019年暴发了该国历史上最大的登革热疫情,而2020年疫情明显减弱。但新加坡经历了该国2013年以来最严重的登革热疫情。2013年新加坡报告了22 318例病例和8例死亡病例,2020年报告了34 844例登革热病例。新加坡国家环境局解释了该国2020年登革热病例激增原因主要为:第一,2020年流行的是以前较不常见的登革病毒血清3型(dengue virus-3,DENV-3),人群对DENV-3普遍缺乏免疫力;第二,监测系统显示,自2019年以来,主要媒介埃及伊蚊的数量有所增加;第三,新冠肺炎疫情加剧了登革热疫情[23-27]。东南亚地区病例数较多的其他国家见表2。
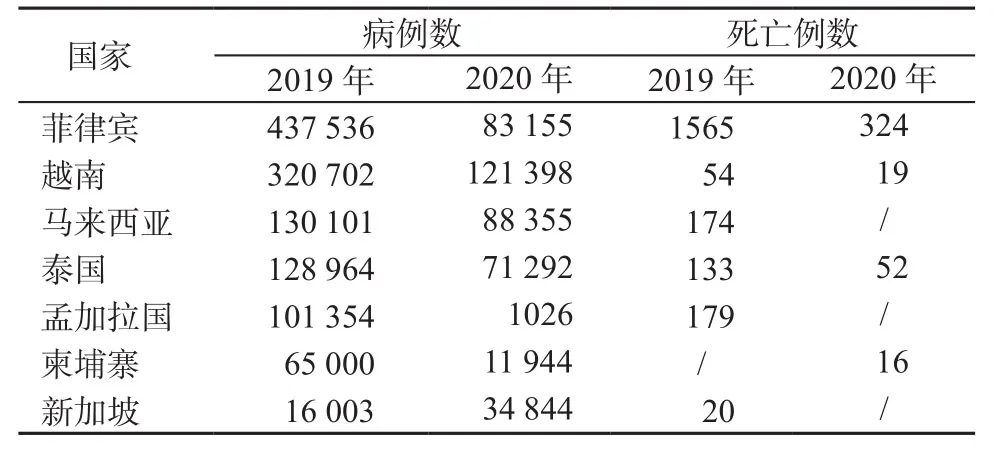
表2 2019—2020年东南亚登革热病例数较多的国家(例)Table 2 Countries with more cases of dengue fever in Southeast Asia from 2019 to 2020(cases)
近几十年来,全球登革热发病率急剧上升,80%的病例无症状或症状轻微,经自我管理后痊愈,因此登革热病例的实际数量多于报告数量。估计每年有3.9亿DENV感染病例,其中9600万出现不同严重程度的临床症状。全球39亿人面临DENV感染风险。过去20年间,向WHO报告的登革热病例数量增加了7倍,从2000年的505 430例增加到2010年的240多万例和2019年的420万例。2000—2015年间报告的死亡人数从960例增加到4032例。登革热病例数量出现巨大增长的部分原因是各国改变了记录登革热病例及向卫生部和WHO报告的做法。该病目前在WHO非洲、美洲、东地中海、东南亚和西太平洋区域100多个国家呈地方性流行。美洲、东南亚和西太平洋区域受影响最严重[28]。
目前尚无特异性抗DENV药物,因此疫苗的预防作用显得格外重要。目前全球仅有一款登革热疫苗CYD-TDV(商品名Dengvaxia)上市。该疫苗是由法国赛诺菲研发而成,首先于2015年12月在墨西哥获批上市,于2018年获欧盟和美国FDA批准,之后陆续在拉丁美洲、亚洲等20多个登革热流行国家获批上市,预防由所有血清型DENV所引起的登革热[29]。CYD-TDV是一种四价嵌合疫苗,以DENV 1-4型病毒株编码 PrM/E 蛋白基因替换黄热病毒(yellow fever virus,YFV)17D相应基因作为疫苗株,进而获得YFV/DENV 1-4 嵌合病毒减毒株。临床前研究表明,CYD-TDV 的基因型和表型稳定,也没有通过血液传播给蚊子的风险[30]。武田四价疫苗TAK-003在2020年由日本武田公司发布,正在进行的Ⅲ期临床试验结果显示,在4~16岁儿童中,18个月疫苗保护效力可达73%[31],有望成为第二个获批的登革热疫苗。
因为4种血清型的DENV分别感染人体后,只对本型DENV有免疫作用,另一血清型DENV感染后,还可以引起抗体依赖增强和细胞因子风暴(这也是导致重症登革热的主要原因),这就使得登革热疫苗不能像其他疫苗那样广泛使用并获得明显的预防效果。因此防治DENV的媒介埃及伊蚊和白纹伊蚊显得越来越重要,其中生物蚊媒防控策略甚至被寄予消灭登革热的希望[32]。这些策略包括减少蚊虫种群数量(称为种群抑制)或通过自然种群传播基因修饰或细菌感染使野生蚊虫无法传播传染病(称为种群置换)。沃尔巴克菌是世界上分布最为广泛的共生菌,常见于节肢动物门和部分线虫体内,影响所寄生动物的生殖和发育。这种特别的细菌感染昆虫和其他节肢动物后,会导致其无法产生雄性后代。感染某种沃尔巴克菌的雄性蚊子被释放并与未感染同一种沃尔巴克菌的野生雌性蚊子交配时,雌性蚊子就无法产生活卵。或者,当释放所有大量感染沃尔巴克菌的雄性和雌性蚊子时,将使蚊子传播病毒的能力降低,可能导致这种菌株在野生种群中传播,从而使蚊子传播病毒的能力降低[33]。该技术在近2年获得突破性进展。印度尼西亚加查马达大学的女科学家Adi Utarini(阿迪·塔里尼)团队的大规模对照研究结果令人振奋。该研究将拥有近40万人口的印度尼西亚日惹市分成24个群落,并随机选择12个群落,释放经过感染沃尔巴克菌改造后的埃及伊蚊,而剩下的12个群落则作为对照。最终的结果显示,在部署蚊子2年后,试验地区的登革热病例减少了77%。这也是首次成功开展的针对埃及伊蚊而减少登革热病例的随机对照试验,具有高度可信性。该研究希望未来5年内在覆盖7500万登革热风险人群的地区释放携带沃尔巴克菌的蚊子,并在10年内覆盖5亿人[34-35]。Adi Utarini因此被Nature评为2020年度十大科学人物,同时被誉为蚊虫指挥官,认为她的这一技术可能有助于消灭登革热[36]。
4 脊髓灰质炎病例数继续猛增,全球根除脊髓灰质炎目标受阻
继2019年全球脊髓灰质炎病例数猛增的趋势,2020年全球共报告了140例野生脊髓灰质炎病毒(wild poliovirus,WPV)1型病例,较2019年的176例稍有下降,但是循环疫苗衍生的脊髓灰质炎病毒(circulating vaccine-derived poliovirus,cVDPV)2型病例数由2019年的249例猛增到1059例,增加了325%。WPV 1型病例仍然只存在于巴基斯坦和阿富汗,两国2017年病例数降到历史最低的22例,2018年为33例,2019年猛增到176例,2020年巴基斯坦和阿富汗病例数分别为84例和56例。2020年cVDPV 2型病例数仍然以巴基斯坦和阿富汗最多,分别为105例和303例,非洲20个国家中以乍得、科特迪瓦、刚果(金)例数最多,分别为92例、71例和69例[37]。2020年出现疫情的国家也由2019年的18个增加到23个,其中新增国家也门报告了28例cVDPV 1型病例[38],见图1。

图1 2020年全球出现脊髓灰质炎病例的地区[2]深红色.WPV 1型;淡红色.cVDPV 2型;绿色.cVDPV 2型;黄色区域.WPV 1型流行国家Figure 1 Regions with poliomyelitis cases in the world in 2020[2]
引起人类严重脊髓灰质炎的野生毒株有以下3种:WPV 1型、WPV 2型和WPV 3型。从症状上看,这3种毒株导致的疾病完全相同,都会导致不可逆转的瘫痪甚至死亡,但是3种病毒株在遗传和病毒学上的差异使得这3种病毒株成为3种不同的病毒,必须分别予以消灭。在给予全球所有人群实行疫苗免疫后,全球自1999年后未检测到WPV 2型,自2012年后未检测到WPV 3型,WHO分别于2015年和2019年宣布WPV 2型和WPV 3型在地球被消灭,目前仅剩WPV 1型未被消灭[39-40]。2020年8月25日,WHO宣布,经过4年无病例后,非洲区域认证委员会证实WHO非洲区域已无WPV。这是一个历史性的里程碑,现在WHO 6个区域中的5个区域(代表世界人口90%以上)已不再有WPV,使世界更加接近实现在全球范围内消灭WPV的目标[41]。全球现在只有巴基斯坦和阿富汗两国存在WPV 1型传播,这也是全球根除脊髓灰质炎行动的最后堡垒。巴基斯坦和阿富汗两国近10年来虽然每年仅数十例病例,但是长期不能被根除,2019年和2020年的病例数突然过百,已引起密切关注。
全球WPV虽然仅剩巴基斯坦和阿富汗两个国家在流行,但是cVDPV仍然在约20个国家流行,这给全球消灭脊髓灰质炎行动的最后阶段带来障碍。cVDPV源自脊髓灰质炎口服减毒活疫苗,这种疫苗包含的弱化脊髓灰质炎病毒株,病毒毒力有可能在人体内复原,进而病毒繁殖并在免疫力不足人群中传播较长时间。目前流行的cVDPV是cVDPV 2型。2020年全球cVDPV 2型病例突破千例,除了巴基斯坦和阿富汗,还分布在非洲20个国家。2020年也门突然出现了28例cVDPV 1型病例。鉴于2020年脊髓灰质炎疫情突然严重,加之受新冠肺炎疫情大流行影响,部分国家采取了暂停脊髓灰质炎疫苗接种活动,影响了脊髓灰质炎正常控制计划,导致疫情明显加重[42]。2020年11月6日,联合国儿童基金会和WHO呼吁采取紧急行动以避免出现脊髓灰质炎重大疫情[43]。11月13日,WHO将新型2型口服脊髓灰质炎疫苗(印度尼西亚Bio Farma公司)纳入紧急使用,用于应对一些非洲和东地中海国家不断增加的cVDPV传播[44]。一些地区发起了脊髓灰质炎疫苗紧急接种运动,以弥补新冠肺炎疫情大流行对根除脊髓灰质炎计划造成的干扰所至的免疫缺口[45-47]。
WHO在1988年提出2000年实现全球消灭脊髓灰质炎的目标。自那时起,全球脊髓灰质炎病例数下降了99%,约有1000万人免于瘫痪[40]。目前全球根除脊髓灰质炎行动的最终战略计划处于最后阶段,正在实施疫苗接种政策改革,以确保完成和维持根除行动。但是2019年和2020年的疫情突然扩大,加之受新冠肺炎疫情大流行的影响,使全球根除脊髓灰质炎行动受到巨大挑战。
5 尼日利亚拉沙热疫情继续
2020年1月24日,尼日利亚CDC宣布该国再次暴发拉沙热疫情,并启动了国家拉沙热紧急行动。病例主要出现在2020年前3个月,4月底,尼日利亚CDC宣布2020年拉沙热暴发的紧急阶段疫情结束。2020年该国27个州累计报告疑似病例6791例,确诊1189例,死亡244例,病死率20.5%。所有确诊病例中,75%病例来自Ondo州、Edo州、Ebonyi州,分别占36%、32%、7%[7,48-49]。全年病例数变化情况见图2。

图2 尼日利亚2020年拉沙热病例数变化情况[49]Figure 2 Changes of Lassa fever cases in Nigeria in 2020[49]
拉沙热主要流行于尼日利亚、利比亚、塞拉利昂、几内亚等少数西非国家,以尼日利亚负担最重。疫情发生在旱季(11月至次年4月)[3]。2016年以来,尼日利亚拉沙热疫情处于间断暴发状态,目前疫情仍然在持续中,2020年疫情重于2019年。2019年,尼日利亚的拉沙热疫情持续流行,全年累计报告5057例拉沙热疑似病例,其中833例确诊,174例死亡(病死率为20.9%),病例数较2018年增加约40%。尼日利亚20个州和联邦首都直辖区均有病例出现[3,48-49]。2016年以来,疫情变化情况见图3。

图3 2016—2020年尼日利亚拉沙热确诊病例数变化曲线[49]Figure 3 Change curve of number of Lassa fever cases diagnosed in Nigeria from 2016 to 2020[49]
拉沙热是由拉沙病毒引起,主要经啮齿类动物传播的一种急性传染病。1969年在尼日利亚东北部拉沙城首次被发现,目前在贝宁、几内亚、加纳、利比里亚、马里、塞拉利昂以及尼日利亚流行,在非洲其他国家也可能存在,但尼日利亚承受着最大的负担。亚洲、非洲、欧洲和美洲多个国家均发现输入性病例。人类通常通过接触受感染的Mastomys鼠的排泄物感染拉沙病毒。拉沙病毒还可以通过直接接触拉沙热患者的血液、尿液、粪便或其他身体分泌物感染,在人际间传播。拉沙病毒感染者约80%无症状。拉沙热的潜伏期为2~21 d。有症状的拉沙热患者呈现逐渐发作的过程,患者会呈现不适、发烧、头痛、咽痛、咳嗽、恶心、呕吐、腹泻、肌痛、胸痛、听力丧失等一种或多种临床表现。20%的发病者会转为重症,常见胸腔和心包积液、昏迷、休克、自主出血等。总病死率为1%,但住院患者为15%~25%。在临床病程早期给予抗病毒药物利巴韦林,对拉沙热是有效的治疗。目前没有拉沙热防护疫苗[50-52]。拉沙病毒传染性极强,与埃博拉病毒、马尔堡病毒等共同被列为生物安全第四级的危险病毒。拉沙病毒是近年来增长最快、关注度最高的沙粒病毒科烈性传染病病毒[3,53]。
随着中非关系的日益紧密,贸易往来频繁,中国面临拉沙热的威胁显著增加。2014年,中国在塞拉利昂建立了可开展拉沙热实验室检测的参比实验室,积极推动当地患者早发现、早诊断、早治疗、早隔离,提升患者和密切接触者管理水平和疫情防控能力[51]。
6 南美洲寨卡病毒病疫情仍呈较低水平流行态势
WHO数据显示,2020年,南美洲共报告约1.4万例寨卡病毒病病例,病例数以巴西最多,累计报告12 893 例,占90%,其次为玻利维亚,累计报告544 例,萨尔瓦多累计报告170例,哥伦比亚累计报告164例,哥斯达黎加累计报告120例,秘鲁累计报告103例,墨西哥累计报告20例,尼加拉瓜累计报告17例。2020年南美洲寨卡病毒病疫情整体仍呈较低水平流行态势[7,54]。
寨卡病毒病是一种由寨卡病毒引起的蚊媒病毒性疾病。其临床表现类似登革热,包括轻度发热、皮疹(主要是斑疹)、头痛、关节痛、肌痛、虚弱和非化脓性结膜炎,发生在蚊子媒介叮咬后约2~7 d,25%的患者可能会出现症状,但通常很轻微,持续2~7 d。由于感染症状轻微,寨卡病毒很少被关注,2015年巴西暴发疫情以后,人们才意识到寨卡病毒的传播和其导致疾病的严重后果。成人重症病例被报告与格林-巴利综合征、神经病和脊髓炎相关。如果母亲怀孕期间感染寨卡病毒,可引起胎儿小头畸形和其他严重脑异常。小头畸形是与寨卡病毒感染相关的第一个先天性异常表现[55]。
寨卡病毒最初于1947年在乌干达寨卡森林的恒河猴体内发现。1969 年首次在非洲以外的马来西亚发现该病毒。2006年以前其主要散发在非洲到东南亚、华莱士线以北区域。2007 年 4 月,太平洋岛国密克罗尼西亚的雅普岛出现49 例寨卡病毒病病例,这是该病首次在非洲与亚洲地区之外局部暴发。此后在其他太平洋岛国流行。2008—2014 年间,泰国、马来西亚、柬埔寨、印度尼西亚、菲律宾也有散发病例的报告。2015年寨卡病毒病突然在南美洲暴发,巴西病例数最多,估计为44万~130万感染病例。到2016年底,美洲48个国家和地区共报告20万本土病例。2017年以后,南美洲病例数大幅度减少,几乎所有国家和地区都出现了下降,直至目前,每年仅有数万例病例报道[56-58]。
7 欧洲和亚洲暴发禽间高致病性H5N8禽流感疫情
2020年,全球35个国家发生约1200起禽间禽流感疫情,其中野禽禽流感疫情586起,家禽禽流感疫情691起,H5N8禽流感疫情1061起,占83.09%[59]。
H5N8禽流感疫情主要于2020年秋冬季在欧洲和亚洲暴发。在欧洲,2020年10月份开始,德国、法国、瑞典、英国、比利时、法国、波兰家禽养殖场家禽出现高致病性H5N8禽流感疫情,数百万只鸡鸭被扑杀。亚洲是重灾区,暴发了历史上最严重的禽流感疫情,主要国家有日本、韩国和印度[7,60-62]。
11月上旬,日本西部的香川县首次报告了禽流感疫情,此后疫情迅速蔓延,截至年底,47个都道府县中已有15个报告了H5N8禽流感疫情,约占到日本行政区总数的1/3,同时也是日本有记录以来禽流感疫情扩散范围最广的一次。日本境内活鸡扑杀总数达到了600万只,创下了国内的最高纪录[7,63]。
韩国疫情始于11月下旬,疫情迅速蔓延至全国。截至年底,全国各地共有13个农场出现H5N8禽流感疫情,有些地方为H5N6禽流感。为了防止禽流感疫情进一步扩散,韩国政府下令大规模扑杀活鸡、活鸭等家禽。韩国共扑杀了近2000万只家禽。除此之外,政府还要求对家禽养殖场周边的野鸟栖息地消毒,争取从源头控制疫情[7,64]。
11月份,中国山西运城市平陆县发现野生天鹅高致病性H5N8禽流感疫情,当地生活着约4000只野天鹅,其中2只生病,2只死亡。疫情发生后,当地立即启动应急机制,开展应急响应工作,并对周边环境进行消毒[65]。
H5亚型禽流感病毒是一种主要在禽类之间高度传染并引起高致病性的病毒,目前报道的禽类感染病毒亚型有H5N1、H5N2、H5N5、H5N6、H5N8等。2010年以前,主要以H5N1禽流感病毒为主,其后流行率呈逐年下降趋势,逐渐转变以H5N6、H5N8为主,在全球多个国家引起多起禽类感染疫情,给养禽业造成了严重的经济损失。H5N8禽流感病毒于2014年首次在亚洲的鸟类中发现,后借助迁徙路线向欧洲等其他地方传播[66-67]。以前未发现H5N8禽流感由动物传给人类,但是2020年12月,俄罗斯南部的一个养殖场上,7名工人感染了H5N8禽流感病毒,被感染者无症状或表现为轻症,尚未发现人际传播[68]。这一案例立即引起全球的警觉。
目前出现或曾经出现在我国的高致病性禽流感病毒有H5N1、H5N6、H5N8、H7N9,其中H5N1、H5N6、H7N9均出现过禽类传染人的病例,而且H5N6禽流感病例均发生在我国。自2014年出现首例病例到2020年底,我国出现过27例人感染H5N6禽流感病例,其中2例发生在2020年[68]。人感染H5N6禽流感病死率达65.2%,而且病毒在不断发生适应性进化和突变,人类间感染风险增高,存在流感大流行的潜在风险。我国活禽市场检测发现,H5N6禽流感病毒有可能逐渐取代H5N1而在我国南部地区成为优势株[69-71]。
12月以后,印度至少已有10个邦和地区发现禽鸟因感染禽流感死亡的情况。在喜马偕尔邦的湖区,约2700只候鸟死亡。在南部的喀拉拉邦,数万只鸭子死亡。在拉贾斯坦邦和中央邦有数百只乌鸦死亡,这三地的禽类样本中均检出H5N8禽流感病毒[72-73]。
8 WHO发布《2020年世界疟疾报告》
同往年一样,WHO在2020年底发布上一年全球疟疾报告——《2020年世界疟疾报告》[74]。该报告显示,2019年全球疟疾病例总数为2.29亿,死亡40.9万例,这一组数据与近4年年度数据相当。2019年疟疾流行的87个国家中,29个国家病例数占全球疟疾病例的95%,5个非洲国家占全球所有疟疾病例的51%,分别为:尼日利亚(27%)、刚果(金)(12%)、乌干达(5%)、莫桑比克(4%)、尼日尔(3%)。其他国家疟疾病例占比见图4。西太平洋地区共报告疟疾病例约170万例,与2000年的300万例相比下降43%,高风险人群感染率也从5%降至2%。大湄公河次区域六国柬埔寨、中国(云南省)、老挝人民民主共和国、缅甸、泰国和越南报告的疟疾病例数从2000年到2019年下降了90%,而恶性疟疾病例同期下降97%[74-75]。

图4 29个国家病例数占2019年全球新发疟疾病例的95%[74]Figure 4 Twenty-nine countries accounted for 95% global new malaria cases in 2019[74]
经过全球共同努力,自2000年以来,已避免15亿人罹患疟疾,避免760万人死于疟疾。过去20年中,21个国家消除了疟疾,其中10个国家被WHO正式认证为无疟疾国家。2000—2019年间,共有10个国家获得了该组织的“无疟疾”认证,分别是阿拉伯联合酋长国(2007年)、摩洛哥(2010年)、土库曼斯坦(2010年)、亚美尼亚(2011年)、吉尔吉斯斯坦(2016年)、斯里兰卡(2016年)、乌兹别克斯坦(2018年)、巴拉圭(2018年)、阿根廷(2019年)和阿尔及利亚(2019年)[74,76]。中国自2017—2020年已连续近4年无本地原发感染疟疾病例报告,2020年11月已正式向WHO申请国家消除疟疾认证[77]。2020年,萨尔瓦多成为中美洲第一个申请WHO无疟疾认证的国家。萨尔瓦多在1990—2010年期间,疟疾病例从9000多例下降到26例;自2017年以来,该国报告的本土病例为零[75]。但也有部分区域国家出现了疟疾病例上升的趋势,自2015年以来,巴布亚新几内亚的病例数量增加了32%,菲律宾增加了29%,所罗门群岛增加了270%,瓦努阿图增加了20%。其中巴布亚新几内亚约占到了西太平洋区2019年全部病例的80%,该国以及菲律宾和所罗门群岛,可能无法完成到2020年将疟疾病死率减少至40%的目标[75-76]。
在全球抗击疟疾的努力中,抗疟药起着至关重要的作用。在青蒿素发现以前,氯喹是有效的抗疟药物,然而,部分疟原虫对氯喹产生耐药性后,氯喹的抗疟疾疗效急剧下降,二十世纪八十年代,非洲因氯喹耐药治疗失败每年导致上百万儿童因疟疾死亡。青蒿素的发现和应用使得人们再次燃起“彻底消灭疟疾,构建无疟疾世界”的理想,如今青蒿素及其衍生物已成为抗疟疾的一线药物。但是自2008年以来,在东南亚地区出现越来越多的抗青蒿素及其衍生物的疟原虫,而在全球疟疾病例数占绝大多数的非洲并未发现对青蒿素耐药的疟原虫突变。然而2020年Uwimana等[78]首次发现并证实非洲本土出现了能够抵抗青蒿素及其衍生物的疟原虫突变:Kelch13突变疟原虫。且通过系统发育分析表明,这些突变株是由非洲本土疟原虫变异而来,而非东南亚等其他区域输入。这些突变疟原虫很可能逐渐成为非洲地区主流疟原虫。模型预测显示,在不采取措施的情况下,5年内因青蒿素及其衍生物的无效将会在非洲导致7800万例新增病例和116 000例死亡病例。这使得依靠青蒿素是构建“无疟疾世界”的前景面临挑战。
9 WHO发布《2020年全球结核病报告》[79-80]
2020年10月15日,WHO发布了《2020年全球结核病报告》,对2020年及以前全球结核病流行以及防控情况进行了总结。
9.1 人群分布概况 2019年全球新发结核病约1000万例,发病率130/10万。男性占56%,女性占32%,年龄<15岁的儿童占12%。在所有受影响的人中,8.2%是HIV感染人群。
9.2 地理分布概况 2019年新发结核病病例大部分来自东南亚(44%)、非洲(25%)和西太平洋(18%),而地中海东部(8.2%)、美洲(2.9%)和欧洲(2.5%)较少。全球约66%的新发结核病患者来自8个国家:印度(26%)、印度尼西亚(8.5%)、中国(8.4%)、菲律宾(6.0%)、巴基斯坦(5.7%)、尼日利亚(4.4%)、孟加拉国(3.6%)和南非(3.6%)。30个结核病高负担国家中,其他22个国家的病例数占全球总数的21%,见图5。
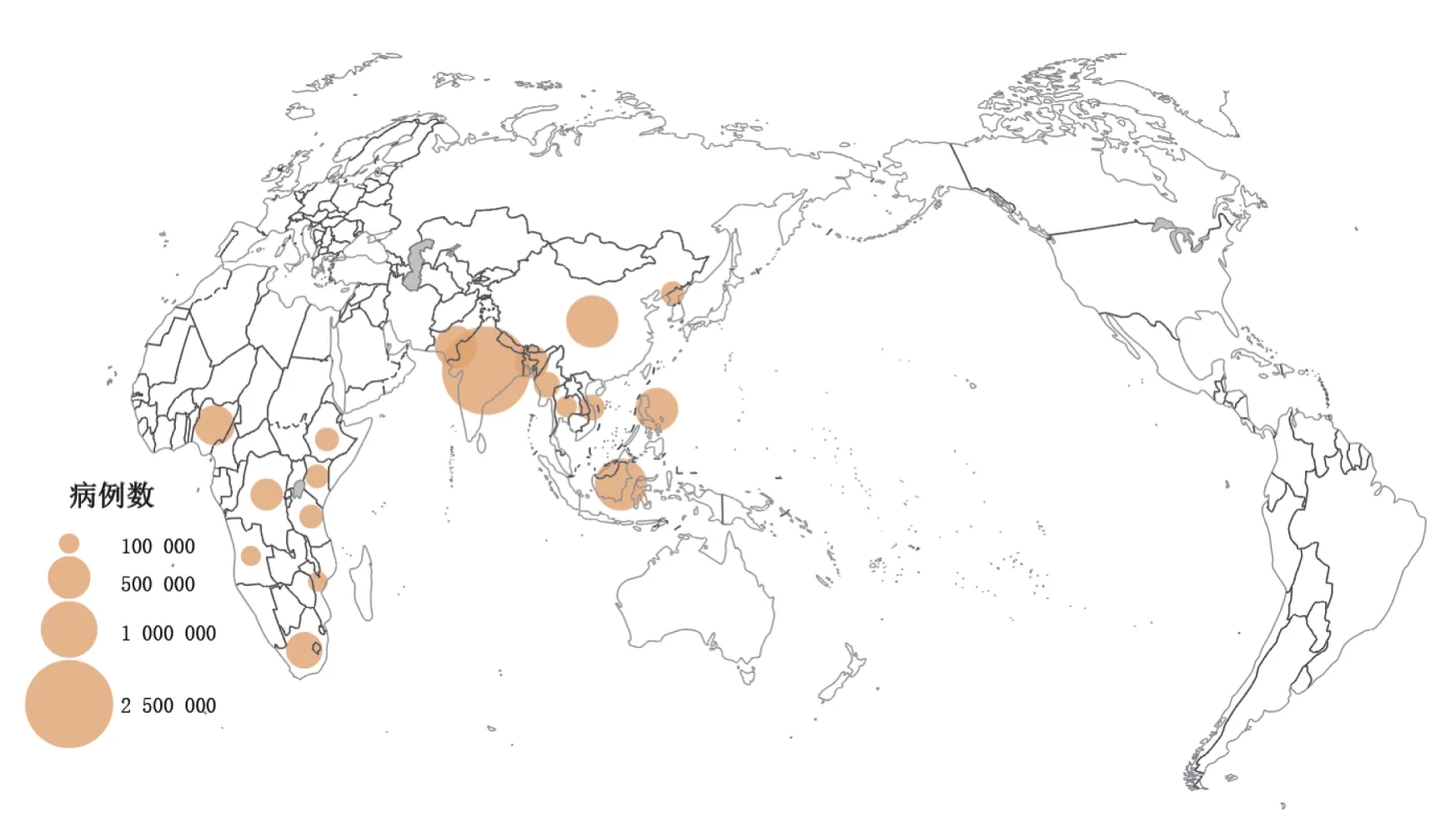
图5 2019年全球新发病例数大于100 000例的国家或地区[79]Figure 5 Countries or regions with more then 100 000 global new cases in 2019[79]
每年全球各地结核发病率为5/10万~500/10万不等。2019年54个国家的结核病发病率较低(每10万人口每年少于10例),主要分布在WHO美洲和欧洲区域以及东地中海的一些国家和西太平洋地区。这些国家即将实现消除结核病的目标。
在全球范围内,虽然结核病发病率正在下降,但速度不足以达到2020年里程碑目标(2015—2020年间结核发病率下降20%)。2015—2019年的累计下降幅度为9.0%(新发病例从142/10万降至130/10万),2018—2019年期间下降幅度为2.3%。WHO的大多数地区和许多结核病高负担国家都不能实现“终止结核病策略”设定的2020年里程碑目标。值得庆幸的是,WHO欧洲区2015—2019年间结核病发病率降低了19%,非洲地区也取得了良好的进展,降低了16%。共有78个国家即将达到2020年的里程碑目标,其中包括已经达到里程碑目标的7个结核病高负担国家(柬埔寨、埃塞俄比亚、肯尼亚、纳米比亚、俄罗斯联邦、南非和坦桑尼亚联合共和国)以及另外3个即将达到里程碑目标的结核病高负担国家(莱索托、缅甸和津巴布韦)。
9.3 HIV/结核分枝杆菌共感染概况 1000万新发结核病患者中,8.2%为HIV阳性人群。2019年因结核病死亡例数为140万例,其中包括20.8万HIV阳性人群,HIV阴性人群死亡例数为120万例(2000年为170万例),HIV阳性人群死亡例数为20.8万例(2000年为67.8万例)。
2019年,全球登记报告的结核病患者中开展HIV检测的患者比例达69%,高于2018年的64%。WHO非洲区结核病高负担主要由HIV引起,该区域86%的结核病患者开展了HIV检测,报告有456 426例结核病合并HIV感染病例,其中88%在接受抗反转录病毒治疗。
9.4 耐药结核病概况 2019年,全球有46.5万耐利福平结核病患者,其中78%为耐多药结核病。全球负担最大的3个国家是印度(27%)、中国(14%)和俄罗斯(8%)。
2019年,全球在耐多药结核病/耐利福平结核病的诊断和治疗方面取得了一些进展。有61%的细菌学确诊的结核病患者接受了利福平耐药检测,高于2017年的51%和2012年的7%。初治结核病患者的检测覆盖率为59%,复治患者的检测覆盖率为81%。2019年,全球发现并登记耐多药结核病/耐利福平结核病患者206 030例,较2018年的186 883例增加了10%,其中177 099例患者被纳入治疗,较2018年的156 205例有所增加。最新治疗结局数据显示,全球耐多药结核病/耐利福平结核病患者治疗成功率为57%。3个结核病高负担国家埃塞俄比亚、哈萨克斯坦和缅甸因其结核病治疗覆盖率高、耐多药结核病/耐利福平结核病治疗成功率高于75%而得到WHO的肯定。
最新的数据显示,在全球范围内,药物敏感性结核病的治疗成功率为85%,耐多药结核病/耐利福平结核病的治疗成功率为57%。自2000年以来,通过结核病诊断和治疗挽救了约6300万人生命。
9.5 中国结核病概况 2019年,中国新发结核病病例数为83.3万例(发病率为58 /10万),其中HIV/结核分枝杆菌共感染1.4万例(0.95 /10万);HIV阴性结核病死亡3.1万例,HIV阳性结核病例死亡2200例。新发耐多药结核病/耐利福平结核病6.5万例(发病率为4.5 /10万)。中国总体结核病发病率呈下降趋势,HIV/结核分枝杆菌共感染率一直保持较低的水平。
9.6 新药和疫苗 目前有22种药物、多种不同的抗结核药物方案和14种候选疫苗正在进行临床试验。M72/AS01E候选疫苗IIb期临床试验的最终结果显示,随访3年后,结核感染者的疫苗致免疫力估计值约为50%,有望成为新的有效预防结核病的疫苗。
10 联合国艾滋病规划署发布2019年全球AIDS报告[81-82]
2020年7月,联合国艾滋病规划署发布了一年一度的全球AIDS防治进展报告《2020全球艾滋病防治进展报告》,对2019年全球AIDS流行情况进行总结。
10.1 人群分布概况 截至2019年底,全球现存活HIV/AIDS患者约为3800.0万例,其中成人3620.0万例,儿童(<15岁)180.0万例(占4.7%)。成人感染者中,女性感染者1920.0万例,占50.5%。2019年新增HIV感染者170.0万例,其中成人150.0万例,儿童(<15岁)15.0万例,占8.8%。2019年死于AIDS相关疾病者约69.0万例,其中成人60.0万例,儿童(<15岁)9.5万例占13.8%。截至2019年底,全球死于AIDS患者累计3269.0万例。而2018年底的数据显示,全球存活HIV/AIDS患者为3790.0万例,当年新增HIV感染者 170.0万例;因AIDS相关疾病死亡77.0万例。
10.2 地区分布概况 AIDS疫情最严重的地区仍然是东部和南部非洲,截至2019年底存活患者数为2070.0万例,占全球存活患者数(3800.0万例)的54.5%;2019年新增HIV感染者73.0万例,占全球当年新增HIV感染者(170.0万例)的42.9%;2019年AIDS死亡患者30.0万例,占全球当年AIDS死亡患者(69.0万例)的43.5%。位居第二的是亚洲和太平洋地区,累计存活患者、当年新增HIV感染者、当年AIDS死亡患者数分别为580.0万例、30.0万例、16.0万例。WHO其他区域病例数见图6。撒哈拉以南非洲地区的妇女和女童仍是受AIDS影响最严重的群体。2019年,该地区新增的HIV感染者占全球总数的59%,每周有4500名15~24岁的青春期少女和年轻女性感染HIV。

图6 2019年WHO六大区域HIV/AIDS患者例数分布[82]Figure 6 Distribution of HIV/AIDS cases in 6 WHO regions in 2019[82]
10.3 动态变化的数字 近年全球新感染例数下降的原因是东部和南部非洲新感染例数大幅下降(自2010年以来减少了38%)。加勒比海地区,西非和中非地区,西欧、中欧、北美地区以及亚洲和太平洋地区新感染例数也有不同程度减少。相比之下,东欧和中亚的AIDS疫情继续扩散,2010—2019年期间新增感染例数上升了72%,中东和北非地区上升了22%,拉丁美洲上升了21%。
10.4 抗反转录病毒药物治疗覆盖率 截至2019年底,全球接受抗HIV治疗例数为2540万例,覆盖率为67.0%,仍有1260万例无法获得抗HIV治疗。由于各国内部和各国之间抗击AIDS疫情进展不均,原定2020年实现的全球抗AIDS“三个90%”防治目标将无法实现。尽管如此,2000年以来,抗反转录病毒药物治疗覆盖率逐年稳步增加(见图7),使约1530万患者的生命得以挽救,AIDS相关死亡减少了51%。这一成就来自各个国家AIDS防治规划的努力,也得益于民间社会和国际发展伙伴的支持。

图7 2000—2019年全球患者抗反转录病毒药物治疗覆盖率[82]Figure 7 Global coverage rate of antiretroviral therapy in patients from 2000 to 2019[82]
——“零疟疾从我开始”

