固相萃取/液相色谱-质谱/质谱法测定山银花中5种主要黄酮苷元的含量
史颖珠,侯建波,谢 文,姚滨滨,盛 涛,胡晓莉,张 辉
(1.浙江大学 生物系统工程与食品科学学院,浙江 杭州 310058;2.杭州海关技术中心,浙江 杭州 310016;3.浙江省检验检疫科学技术研究院,浙江 杭州 310016;4.浙江立德产品技术有限公司,浙江 杭州 310016)
山银花为忍冬科植物灰毡毛忍冬(LoniceramacranthoidesHand.-Mazz.)、红腺忍冬(LonicerahypoglaucaMiq,)、华南忍冬(LoniceraconfusaDC.)或黄褐毛忍冬(LonicerafulvotomentosaHsu et S.C.Cheng)的干燥花蕾或带初开的花,并在夏初花开放前采收获得。自《中国药典》2005年版起,与金银花进行区分。山银花具有清热解毒,疏散风热的功效,可用于治疗痈肿疔疮、喉痹、丹毒、热毒血痢、风热感冒、温病发热[1]。研究发现其还具有抗菌、抗病毒、抗氧化和抗动脉粥样硬化等作用[2-5],在我国主要分布在长江以南的湖南、四川、广东、贵州、广西、云南等省区和长江以北的河南、山东、安徽和湖北等省份[6]。
山银花的有效成分除了绿原酸、灰毡毛忍冬皂苷乙和川续断皂苷乙外,还有黄酮类、挥发油类、有机酸类和三萜类化合物[7-10]。有研究人员通过HPLC-MS/MS、光谱技术测定和鉴别山银花黄酮类、有机酸类和环烯醚萜类化合物的含量[11-13],以及开展包含黄酮类化合物在内的指纹图谱研究[14-16]。由于黄酮类化合物种类较多,在植物体内苷元可与糖类物质形成不同的苷而普遍存在[17-19],且标准品较难获取,目前除液相色谱-高分辨质谱法[20-22],其他分析手段较难获得更全面的信息。本文通过文献调研筛选出山银花中5种主要黄酮苷元及其对应的黄酮苷(槲皮素、木犀草素、山萘酚、芹菜素、黄芩素、芦丁、木犀草苷、紫云英苷、野漆树苷和黄芩苷)(化学结构式如图1所示),通过盐酸水解,乙醇溶液提取,HLB固相萃取柱净化,液相色谱-质谱/质谱法对苷元进行定量测定,从而建立了山银花中槲皮素、木犀草素、山萘酚、芹菜素和黄芩素5种主要黄酮苷元含量的测定方法。该方法通过对黄酮苷元的检测,可更为全面地反映出各苷元所代表的黄酮类化合物总量。
1 实验部分
1.1 仪器与试剂
API 4000型三重四极杆串联质谱仪(配电喷雾离子源ESI,美国AB公司),1100型液相色谱仪(美国Agilent 公司),Milli-Q Synergy 185超纯水器(美国Millipore公司),IKA MS3 Basic型涡旋器(德国IKA公司),24孔固相萃取装置(美国Supelco公司),Heraeus Multifuge X1R型台式离心机(美国Thermo 公司),G&G JJ500型电子天平(中国双杰公司),Mettler AE260(瑞士Mettler Toledo公司)。
甲醇(色谱纯,Tedia公司)、甲酸(质谱级,Scharlau公司)、乙腈(色谱纯,Scharlau公司)、乙醇(分析纯,华东医药股份有限公司)、盐酸(优级醇,永华化学科技(江苏)有限公司)、叔丁基对苯二酚(TBHQ,分析纯,Aladdin公司)、L-(+)-抗坏血酸(分析纯,广东光华科技股份有限公司);CNW C18固相萃取柱(6 mL,500 mg,Anpel公司),Waters C18固相萃取柱(6 mL,500 mg,Waters公司),Waters HLB固相萃取柱(6 mL,200 mg,Waters公司),Biocomma HLB固相萃取柱(6 mL,200 mg,Biocomma公司);色谱柱:Mightysil RP-18(3 μm,4.6 mm×150 mm,日本关东化学株式会社)和 Inertsil ODS-3(3 μm,4.6 mm×150 mm,日本岛津公司)。
标准物质:槲皮素(纯度96.4%,ChromaDex公司),木犀草素(纯度96.9%,ChromaDex公司),山萘酚(纯度95.5%,中国食品药品检定研究院),芹菜素(纯度98.5%,Bepure公司),黄芩素(纯度99.2%,ANPEL公司),芦丁(纯度95.0%,TRC公司),木犀草苷(纯度98.9%,ANPEL公司),紫云英苷(纯度99.1%,ANPEL公司),野漆树苷(纯度98.9%,ANPEL公司),黄芩苷(纯度96.8%,ChromaDex公司)。用甲醇将各化合物标准品溶解,稀释并定容获得10 mg/mL的标准储备液,根据需要用甲醇将储备液稀释至所需浓度。
图1 5种主要黄酮苷元及其对应黄酮苷的化学结构式
1.2 实验条件
1.2.1 色谱条件色谱柱:Mightysil RP-18(3 μm,4.6 mm×150 mm),流动相:甲醇(A)-0.15%甲酸溶液(B),梯度洗脱程序:0~10.0 min,40%~75%A;10.0~15.0 min,75%~90%A;15.0~22.0 min,90%A;22.0~23.0 min,90%~40%A;23.0~30.0 min,40%A;流速:0.4 mL/min;进样量:20 μL;柱温25 ℃。
1.2.2 质谱条件离子源:电喷雾离子源(ESI);扫描模式:负离子扫描;监测方式:多反应监测(MRM);电喷雾电压(IS):-4 500 V;雾化气压力(GS1):289 kPa(42 psi);气帘气压力(GS2):310 kPa(45 psi);辅助气流速(CUR):172 kPa(25 psi);离子源温度(TEM):540 ℃;其它质谱参数如表1所示。
1.3 实验方法
称取0.5 g(精确至0.01 g)试样置于150 mL圆底烧瓶中,加0.5 g TBHQ,36 mL 50%的乙醇溶液和4.0 mL浓盐酸,在氮气保护下,水浴加热回流120 min,氮气保护下冷却后,加水定容至50 mL,取上清液1 mL,加入9 mL水,混匀并转移至HLB固相萃取柱中(依次用5 mL甲醇和5 mL 5%甲醇溶液活化),加入5 mL 10%甲醇溶液淋洗,抽干后,加10 mL甲醇进行洗脱,控制流速为1~2 mL/min,收集全部洗脱液,甲醇定容至10 mL,摇匀,过0.22 μm有机滤膜,取1.0 mL定容溶液,加40%甲醇溶液稀释定容至25 mL,混合均匀,供LC-MS/MS测定。
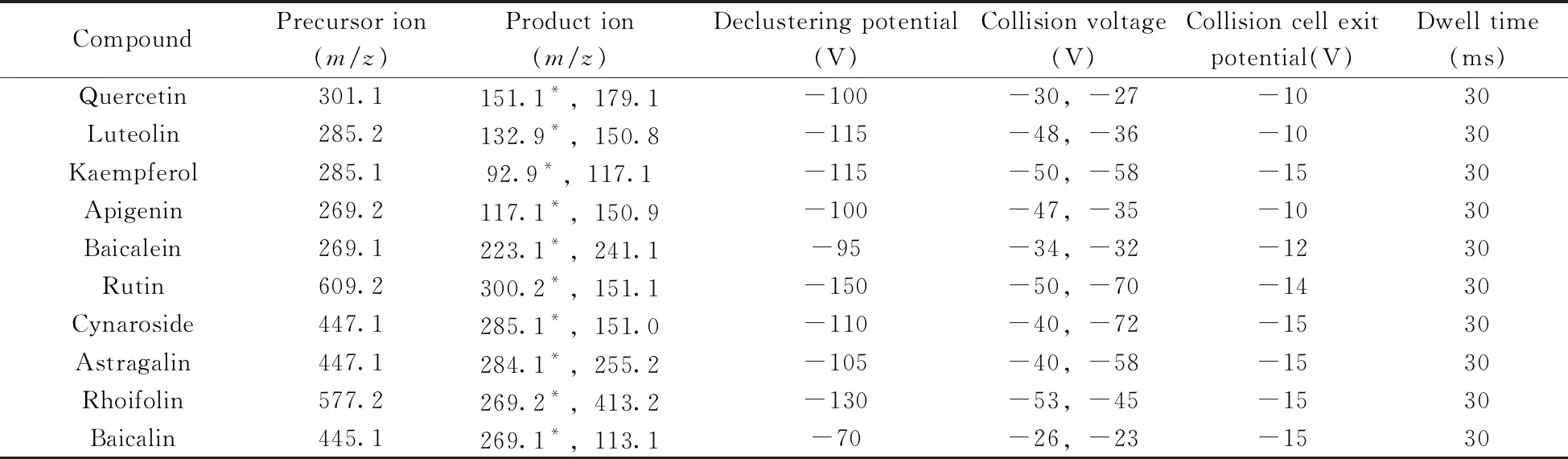
表1 各化合物的基本信息及质谱测定条件
2 结果与讨论
2.1 水解与提取条件的选择
浸提、超声、回流等技术通常用于中草药中有效成分的提取,参考中国药典[1]的方法,实验首先采用超声方式进行提取,结果表明超声环境下黄酮苷几乎不发生水解反应。
对芦丁、木犀草苷、紫云英苷、野漆树苷和黄芩苷在不同含量乙醇溶液(30%、50%、70%),盐酸(5%、10%和12.5%)条件下,于氮气保护下水浴加热回流不同时间(30、60、90、120、180 min)进行实验,同时对比TBHQ和抗坏血酸两种不同抗氧化剂的保护情况。结果表明,在无抗氧化剂时,槲皮素、山萘酚和黄岑素的回收率低于50%。在抗坏血酸存在下,槲皮素、山萘酚和黄岑素的回收率无明显提高,而加入TBHQ后,槲皮素、山萘酚、黄岑素的回收率可达70%以上。乙醇溶液的含量变化对结果无明显影响,考虑到黄酮苷和苷元的溶解性差异,实验选择50%的乙醇进行实验。在50%乙醇溶液中,当盐酸浓度低于10%和水解时间小于120 min时,约20%的黄岑苷未水解。实验最终确定的水解与提取条件为:采用10%盐酸和50%乙醇溶液,在TBHQ和氮气保护下水解120 min。在上述条件下对10 ng/mL黄酮苷元进行实验,发现水解过程中各苷元的损失率均低于20%,有效保障了黄酮苷元的回收率。
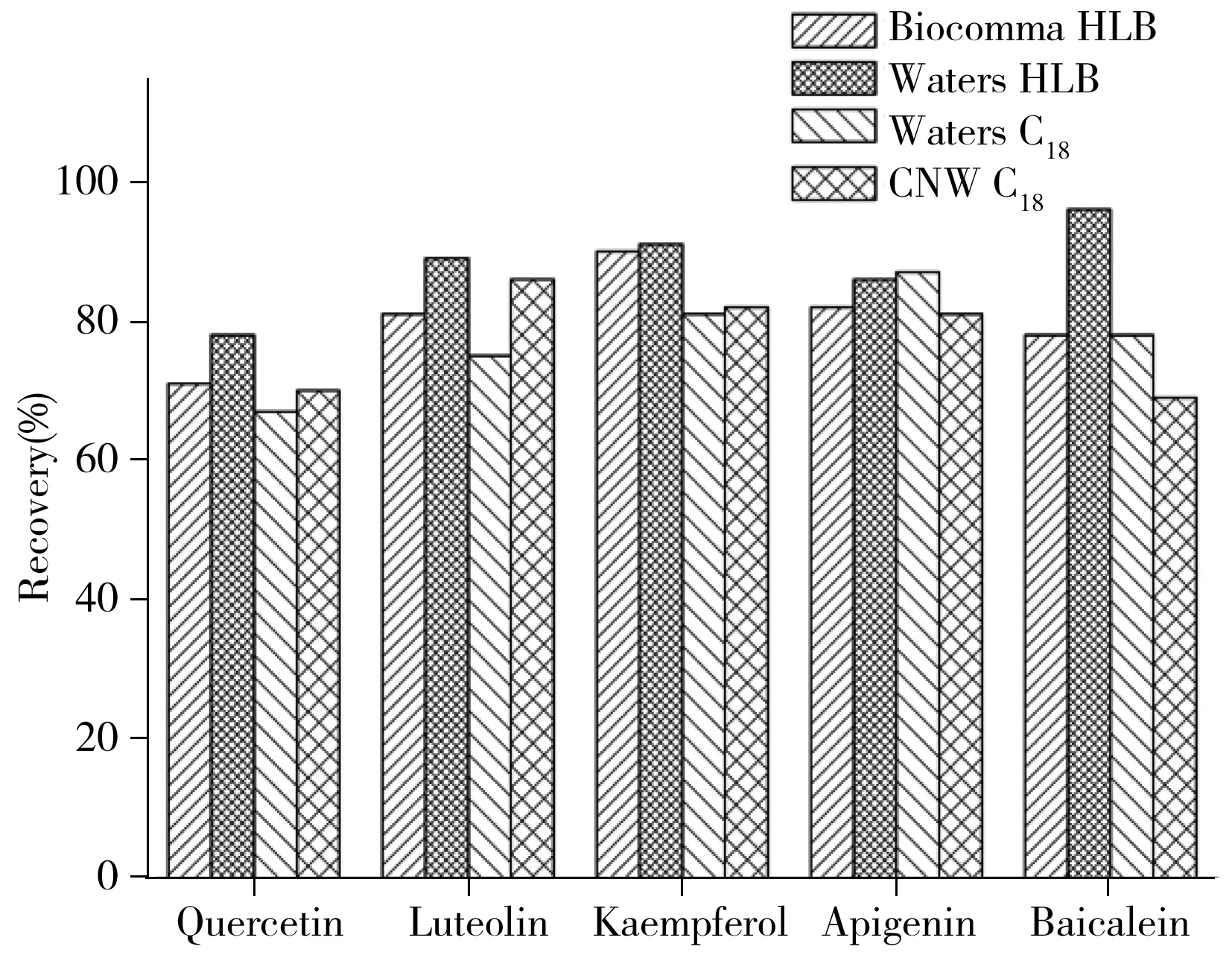
图2 不同固相萃取柱的净化情况
2.2 净化条件的选择
考察了C18和HLB两种类型固相萃取净化柱对水解提取溶液的净化情况,以降低基质效应对LC-MS/MS定量测定的背景干扰,提高检测结果的准确性。实验取1 mL 100 ng/mL的黄酮苷元标准溶液(50%乙醇溶液,含10%盐酸和0.5 g TBHQ),加入9 mL水,混匀并转移至各固相萃取柱中,分别采取10 mL的10%、20%、30%、40%、50%甲醇溶液淋洗和甲醇洗脱。结果如图2所示,50%甲醇溶液淋洗时,C18和HLB固相萃取柱中槲皮素、木犀草素、山萘酚、芹菜素和黄芩素均可以较好地被保留,甲醇洗脱回收率均大于65%,其中槲皮素和黄芩素在C18柱的净化回收率比HLB柱的净化回收率低5%~15%。Waters和Biocomma的HLB回收率无明显差异,但由于黄芪素采用Waters HLB的净化结果较好,且试验中Waters HLB的稳定性更好。因此,实验最终采用Waters HLB固相萃取柱开展方法学考察。
2.3 色谱条件的考察
对比了Mightysil RP-18(3 μm,4.6 mm×150 mm)和 Inertsil ODS-3(3 μm,4.6 mm×150 mm)两种色谱柱以甲醇或乙腈为有机相,0.15%甲酸溶液或水为水相时对目标化合物槲皮素、木犀草素、山萘酚、芹菜素和黄芩素5种黄酮苷元,及其对应的黄酮苷物质芦丁、木犀草苷、紫云英苷、野漆树苷和黄芩苷(质量浓度均为2 ng/mL)的分离情况。
研究表明,相同色谱条件下,黄芩苷在Mightysil RP-18柱中分离时谱峰峰形更好,且信号提升约4倍。在相同色谱柱和梯度洗脱程序下,甲醇为有机相时大部分化合物的响应信号和峰形优于乙腈(其中野漆树苷、芦丁、木犀草苷在甲醇为流动相时响应信号提升3~5倍)。在相同色谱柱下,以甲醇为有机相,对比了水和0.15%甲酸溶液为水相的分离情况,以Mightysil RP-18色谱柱为例,在0.15%甲酸溶液中信号的峰形和响应优于水(其中黄芩素提升约5倍)。
因此,实验最终采用Mightysil RP-18为分离柱,甲醇为有机相,0.15%甲酸溶液为流动相。在该色谱条件下,分子离子峰相同的木犀草素和山萘酚,芹菜素和黄芩素,木犀草苷和紫云英苷可得到很好地分离(如图3)。

图3 液相色谱-质谱/质谱法对目标物(2 ng/mL)的分离结果
2.4 质谱条件的优化
对各黄酮苷和苷元的标准溶液分别进行稀释,采用流动注射的方式在负离子模式下进行母离子全扫描,确定分子离子峰,再分别以待测化合物的分子离子为母离子,对其子离子进行全扫描。按照欧盟EC/657指令和《质谱分析方法通则》的要求,选择两个特征子离子对目标化合物进行定量确证,以其中信噪比高、峰形好、干扰小的离子对作为定量离子对。以多反应监测负离子模式优化各种质谱参数,获得的最佳质谱条件见表1。
2.5 基质效应的考察
通过对比相同浓度的溶剂工作液(稀释溶剂为流动相初始比例:甲醇-0.15%甲酸溶液,体积比4∶6)和经过前处理的基质加标溶液中各化合物的信号响应强度,计算离子抑制率[离子抑制率(%)=(溶剂工作液中响应强度-基质加标溶液响应强度)×100%/溶剂工作液中响应强度]以考察基质效应情况[23]。如表2所示,实验条件下,配制质量浓度为4 ng/mL的溶剂工作液和基质加标溶液,得到各化合物定量离子对的离子抑制率均小于15%,即该条件下获得的基质溶液无明显基质效应。因此采用甲醇-0.15%甲酸溶液(体积比4∶6)配制工作溶液进行定量计算。
2.6 线性关系、定量下限及回收率
在优化实验条件下,以待测物标准品的峰面积Y为纵坐标,以其含量X(g/kg)为横坐标,考察了5种黄酮苷元含量分别为0、0.05、0.1、0.5、1 g/kg(采用40%甲醇溶液配制)时的线性关系。结果显示,各化合物的线性范围均为0~1.0 g/kg,相关系数(r2)大于0.995。方法的定量下限(以S/N=10计)为0.005 g/kg(槲皮素),0.01 g/kg(木犀草素和芹菜素)和0.05 g/kg(山萘酚和黄芩素)。
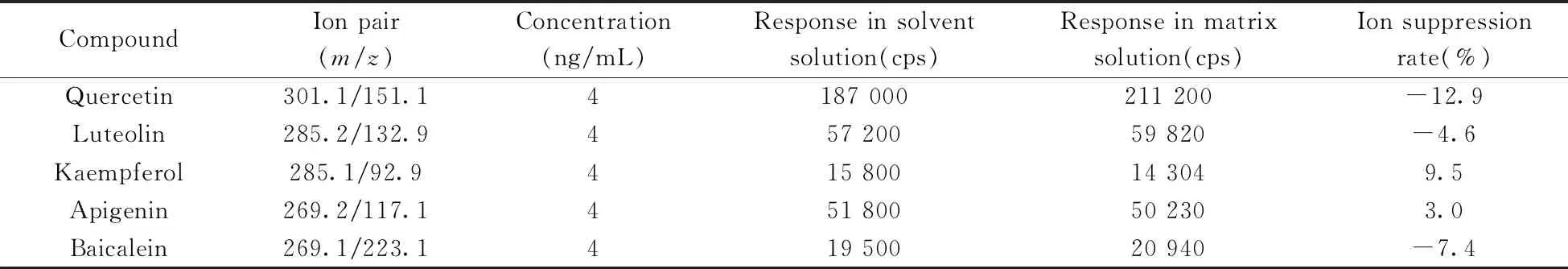
表2 山银花基质中各化合物的基质效应情况
在优化实验条件下,对山银花样品进行检测,测定样品水解后含槲皮素0.17 g/kg、木犀草素0.19 g/kg、山萘酚0.06 g/kg、芹菜素0.05 g/kg和黄芩素0.09 g/kg。对样品进行3个浓度水平的加标回收实验,加入各黄酮苷(添加量相当于水解后槲皮素和木犀草素含量分别为0.10、0.20、0.40 g/kg,山萘酚、芹菜素和黄芩素含量分别为0.05、0.10、0.20 g/kg),每个含量水平取6个平行样,采用外标法定量。结果如表3所示,方法的平均回收率为70.4%~104%,相对标准偏差(RSD)为4.0%~12%。
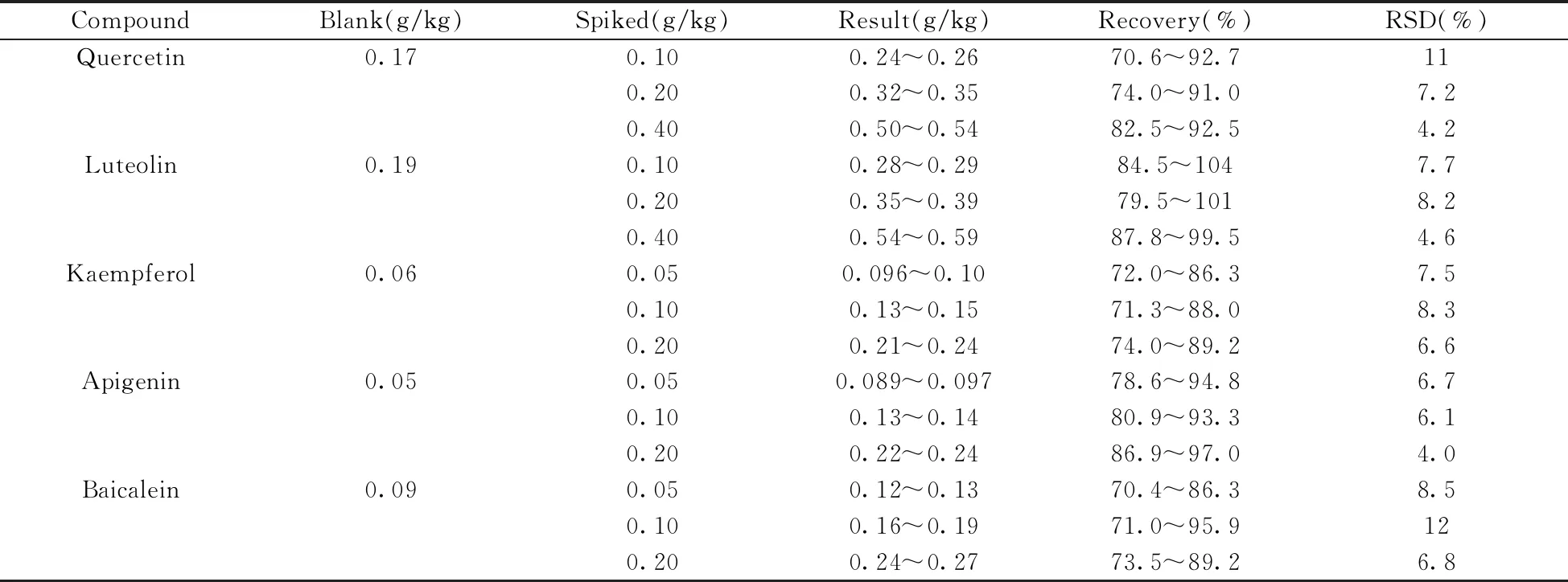
表3 山银花中5种黄酮苷元在3个加标水平下的回收率及相对标准偏差(n=6)
2.7 实际样品的检测
应用本方法对采购的13批山银花样品进行测定,结果如表4所示。在山银花样品中检出的5种黄酮苷元中,木犀草素含量最高(0.112~0.453 g/kg),其次是槲皮素(0.030~0.260 g/kg)和芹菜素(0.010~0.050 g/kg),山萘酚和黄岑素的含量最低。
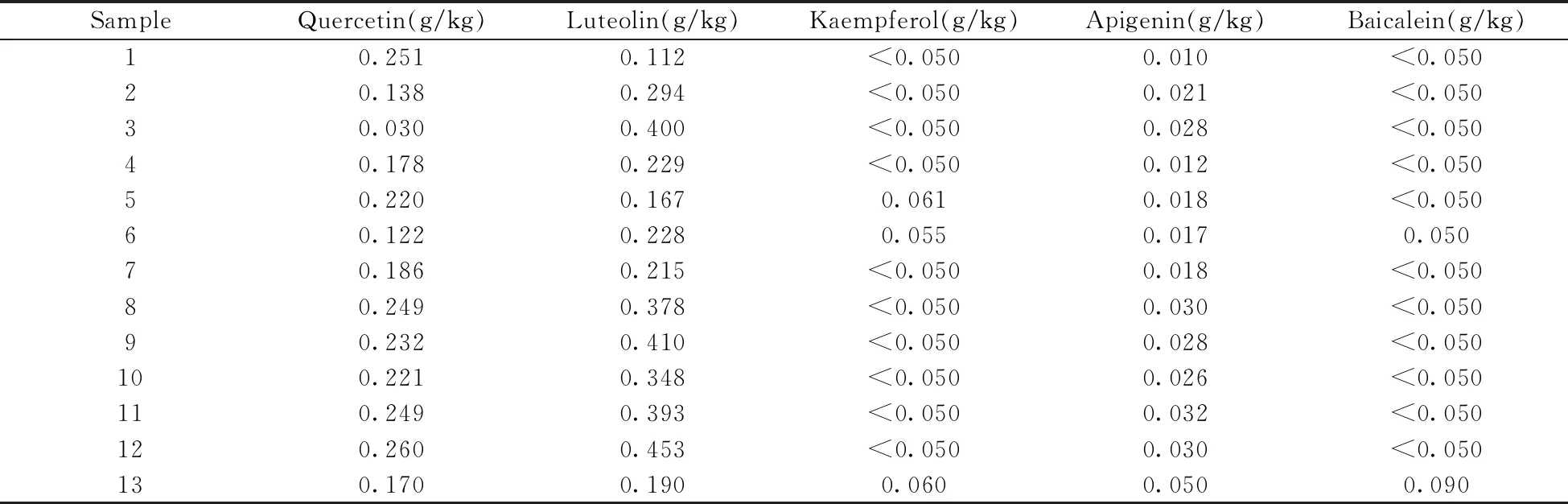
表4 山银花样品中的检测结果
3 结 论
本文通过含有盐酸的乙醇溶液水解山银花中5种主要黄酮苷,并对其黄酮苷元进行提取,HLB固相萃取柱净化,LC-MS/MS法检测,外标法定量,实现了对山银花中代表性黄酮苷(芦丁、木犀草苷、紫云英苷、野漆树苷和黄芩苷)的有效水解,及水解产物槲皮素、木犀草素、山萘酚、芹菜素和黄芩素含量的测定。该方法通过水解获得山银花中的黄酮苷元,并对其含量进行测定,可更准确地获得山银花中各主要黄酮类化合物含量的数据,对后续的含量分析以及药物活性关系和品质研究,具有重要的辅助作用。

