基于超高效液相色谱-四极杆-静电场轨道离子阱串联质谱的冷链贮藏过程中滩羊肉的脂质组学研究
贾 玮,李芮廷,刘树兴,石 琳,武希璇,储晓刚,2
(1.陕西科技大学 食品与生物工程学院,陕西 西安 710021;2.中国检验检疫科学研究院,北京 100123)
滩羊肉是我国宁夏的优势特色畜种产品[1-3],以脂肪分布均匀,肉质鲜美,风味独特受到消费者的喜爱。冷链(-20 ℃)贮藏是消费者和上游供应商之间的冷藏食品的连续温控储存和运输系统,用于保持食品的质量安全和长期储存[4]。宰后的新鲜滩羊需经过冷链贮藏才可到达消费者的餐饮中,在此过程中水分、温度和持水力等因素均会对肉质产生一定影响[5-9]。
脂质作为滩羊肉的主要营养成分之一,其组成成分会对肉的气味、风味、颜色及质地等产生一定的影响,是决定消费者购买意愿的主要标志[10-14]。研究表明,脂类物质代谢物的存在形式与肉类的气味和风味密切相关,如4-甲基壬酸、4-甲基辛酸和4-乙基辛酸是绵羊的主要风味脂肪酸[15-16]。脂质组学因具有独特的生物活性被广泛应用于食品鉴定(如泰和乌骨鸡与猪肉)[17-18]。质谱分析在仪器和技术方面的迅速发展,极大地促进了脂质组学及其在食品中的应用[19]。目前针对食品在冷链贮藏过程中脂质组学方面的研究较少,因而利用液相色谱-质谱联用技术研究宰后滩羊肉的脂质组成对探索动物宰后肉成熟机理、改进冷鲜肉加工贮运技术具有积极的指导作用。
本文采用超高效液相色谱-四极杆-静电场轨道离子阱串联质谱(UHPLC-Q-Orbitrap MS/MS)与脂质组学相结合的分析方法,对滩羊肉在冷链贮藏过程中变化显著的脂质进行了筛查,研究其含量的变化规律,分析在冷链贮藏过程中发生的脂质代谢,揭示不利于滩羊肉品质保证的脂质变化规律,并确定其相对合适的冷链贮藏时间;分析显著变化脂质的二级碎裂质谱和碎裂机制模式,获得其特征性碎裂片段。旨在分析滩羊肉冷链贮藏影响因素与探索脂质变化规律,从而为滩羊肉的质量控制和市场上滩羊肉的冷链贮藏时间判别提供相关依据。
1 实验部分
1.1 试剂与材料
甲酸铵(纯度≥99%,瑞士Fluka公司);甲酸(纯度≥95%,美国Sigma Aldrich公司);水和异丙醇(色谱纯,美国Fisher Scientific公司);乙腈(纯度≥99.95%,荷兰Akzo Nobel公司)。滩羊肉购于中国宁夏回族自治区,将其去除骨头和皮肤,切割背部最长肌的中间部分成大小为3 cm×3 cm×3 cm的肉,用绞肉机绞碎混合后,再分别均匀地转移至聚乙烯塑料袋中并排气,放入温度为-20 ℃冷库(第0~24 d)。每日在同一时间随机抽取12个平行样本进行脂质提取(连续取24 d)。
1.2 仪器与设备
超高效液相色谱-四极杆-静电场轨道离子阱串联质谱(美国Thermo Fisher Scientific公司),配备Syringe自动取样器系统、电喷雾离子源和Hypersil Gold C18反相色谱柱(100 mm×2.1 mm×1.9 μm);TY2018001252型立式高速冷冻离心机(湖南赫西仪器装备有限公司);KQ-500DE型数控超声波清洗器(江苏昆山超声仪器有限公司);MIX-25P型迷你混合器(杭州MIULAB公司)。
1.3 样品前处理
通过对比脂质的回收率、精密度、提取脂质的数量和所用程序的复杂性等方法学参数,表明异丙醇提取方式优于甲醇/氯仿提取方式[20]。因此,优化后的前处理采用异丙醇沉淀蛋白质的脂质提取方式。提取过程如下:将12个平行样本各称取0.5 g混合肉糜分别置于12个10 mL离心管中,各加入4.5 mL异丙醇,涡旋混合1 min,室温下超声处理10 min后,置于-20 ℃下保存3~5 h加速蛋白质沉淀,涡旋1 min,离心(14 000×g,4 ℃,10 min)。取1 mL上清液过0.22 μm尼龙滤膜并转移至进样小瓶中,进样分析。
1.4 色谱-质谱条件
色谱柱:Hypersil Gold C18反相色谱柱(100 mm×2.1 mm×1.9 μm);流动相:溶液A为0.1%甲酸+10 mmol/L甲酸铵+乙腈/水(60∶40,体积比),溶液B为0.1%甲酸+10 mmol/L甲酸铵+异丙醇/乙腈(90∶10,体积比)。进样量为5 μL;进样速度为300 μL/min;柱温为55 ℃。梯度洗脱程序:0~1 min,30%~38% B;1~4 min,38%~56% B;4~14 min,56%~98% B;14~15 min,98%~100% B;15~16 min,100% B;16~16.1 min,100%~30% B;16.1~20 min,30% B。
电喷雾离子源(ESI)参数:喷雾电压为3.5 kV;鞘气流速为48 L/min;辅助气流速为11 L/min;毛细管温度为240 ℃;辅助气加热器温度为300 ℃;采集时间为0~20 min;全扫描模式的分辨率为70 000 FWHM;二级扫描模式的分辨率为35 000 FWHM;质量采集范围为m/z100~1 500。质量控制样品(QC)和空白样品在每组样品间隔进样分析。
1.5 数据处理
将质谱所得原始数据存于Xcalibur(版本4.1)软件,导入Compound Discover软件中通过背景漂移校正、峰提取、峰对齐获得脂质分子峰表,利用LIPID MAPS数据库匹配特征性脂质。随后将匹配好的5组样品(第0、6、12、18、24 d)的脂质数据可视化为csv文件,导入MetaboAnalyst(版本4.0)进行多元统计学分析。LIPID MAPS数据库匹配脂质分为5类:脂肪酰基肉碱、磷脂酰胆碱(PC)、溶血性磷脂酰胆碱(LPC)、磷脂酰乙醇胺(PE)和溶血性磷脂酰乙醇胺(LPE)。
2 结果与讨论
2.1 脂肪酰基类脂质分子分析
采用正离子模式对滩羊肉的脂质提取物和质量控制样品进行分析,所得质谱图的脂质信号以1~3 min、5~10 min和12~13 min为主。对脂肪酰基肉碱进行二级碎裂并分析其特征性碎裂离子,发现其碎裂模式与多不饱和脂肪酸的碳原子数无关,而与其极性头部基团相关。以棕榈酰肉碱的二级裂解为例(图1),其分子离子为m/z400.341 09[M+H]+。裂解途径为:分子离子发生i-断裂,导致C3H9N片段丢失产生特征性碎裂离子m/z341.267 82[M+H-C3H9N]+,该离子进而以γH重排的方式生成终产物离子m/z85.028 91[M+H-C3H9N-C16H32O2]+;分子离子还可通过失去C16H32O2片段产生同分异构体离子m/z144.101 65[M+H-C16H32O2]+,该同分异构体离子可通过正离子诱导的i-断裂导致C3H9N片段丢失,生成终产物离子m/z85.028 91[M+H-C3H9N-C16H32O2]+。最终形成3个特征性碎片离子,分别为m/z85.028 91、m/z341.267 82和m/z144.101 65。

图1 棕榈酰肉碱的二级质谱图及碎裂途径分析
2.2 甘油磷脂类脂质分子分析
LPC、PC、LPE和PE 4种亚类脂质解离发生在极性基团。LPC(18∶1)分子离子以正离子诱导的i-断裂产生离子m/z463.281 92,再通过多次γH重排和H2O的丢失产生离子m/z181.025 59和离子m/z163.015 29(如图2A和图3A)。特征性碎裂离子分别为m/z522.354 19、m/z181.025 59、m/z163.0152 9。PC(18∶2/18∶2)分子离子发生诱导裂解,极性基团失去C3H9N片段生成离子m/z723.493 86,通过γH重排失去脂肪酸酰基链和分子骨架,生成极性基团离子m/z124.999 77和m/z98.984 66(如图2B和图3B)。特征性碎裂离子分别为m/z723.493 86、m/z124.999 77和m/z98.984 66。PE(16∶0/18∶2)分子离子经过诱导裂解产生特征性碎裂片段m/z460.284 18,发生γH重排产生特征性碎裂离子m/z417.249 72和碎片离子m/z198.052 59,均通过γH重排产生特征性碎裂离子m/z155.010 38(如图2C和图3C)。特征性碎裂离子分别为m/z460.284 18、m/z417.249 72、m/z155.010 38。PE(18∶0/18∶1)分子离子通过失去H2片段产生离子m/z743.546 17,裂解失去NH3片段产生碎裂离子m/z726.519 41,再通过α-裂解产生离子m/z104.977 17;第2条裂解途径为m/z743.546 17通过α-裂解产生特征性碎裂离子m/z122.009 68,再裂解失去NH3片段产生m/z104.977 17(如图2D和图3D)。特征性离子分别为m/z743.546 17、m/z122.009 68和m/z104.977 17。

图2 甘油磷脂的碎裂途径分析

图3 甘油磷脂的二级质谱图
通过特征碎裂离子与LIPID MAPS数据库比对,共鉴定115个脂质成分,其中48个脂质在冷链贮藏过程中的含量变化显著(如表1),包括脂肪酰基类(脂肪酰基肉碱)和甘油磷脂类(PC、LPC、PE、LPE)两大类。表1中p-值为t检验结果,用于评价变量在不同样本间的差异是否显著;FC-值为差异倍数,为代谢物的平均表达量在两组样本中的比值。同时,运用脂质组学方法研究48个差异性脂质分子在冷链贮藏过程中的含量变化规律。

表1 滩羊肉24 d冷链贮藏过程中变化显著性脂质代谢物的分子信息

(续表1)
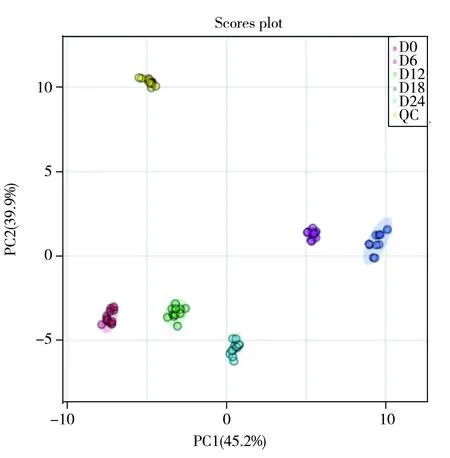
图4 5组样品和QC样品的PCA模型(n=12)

图5 5组样品的PLS-DA模型(n=12)
采用主成分分析(PCA)和正交偏最小二乘判别分析(PLS-DA)研究5组样品中变化显著的物质。PCA模型可表明不同冷链贮藏时间滩羊肉的脂质代谢产物水平的总体轮廓分布,图4结果显示,所得PC1和PC2分别为45.2%和39.9%,充分地解释了样品间的差异性。每组样品均明显分离,且QC样品很好地聚集,说明仪器的稳定性良好。为进一步判断不同冷链贮藏时间的变化显著性脂质,建立了PLS-DA模型(如图5),该模型可消除背景噪声和组内误差干扰的影响,使组间差异最大化。该模型的解释变量R2和可预测变量Q2分别为0.997和0.995,可以很好地解释和预测两组样本间的差异。上述结果表明,PCA和PLS-DA模型对于不同冷链贮藏时间发生脂质变化的滩羊肉样品均能较好地分类。
2.3 脂质组学分析
本实验鉴定了冷链贮藏过程中滩羊肉的48个变化显著性脂质,包含8个脂肪酰基肉碱、3个LPC、1个LPE、23个PC、13个PE等5类脂质。其变化主要表现在第0~12 d和第12~24 d间的不同变化趋势,不仅可以解释滩羊肉在冷链贮藏过程中发生的脂质代谢,探讨滩羊肉的最佳冷链贮藏时间,并可通过分析建立的“贮藏脂质代谢物指纹图谱”评价市场上经过冷链贮藏的滩羊肉品质。
2.3.1 脂肪酰基类的组学分析脂肪酰基肉碱是滩羊肉在冷链贮藏过程中检出的亚类脂质之一,归属于脂肪酰基类。如表1所示,8个长链脂肪酰基肉碱发生显著性变化,分别为O-(17-羧基庚烷酰基)肉碱、O-十四烷酰基肉碱、2-羟基十六烷酰基肉碱、亚油酸肉碱、硬脂酰肉碱、棕榈酰肉碱、O-油酰肉碱和反式十六烷基-2-烯醇肉碱。脂肪酰基肉碱在第0~12 d表达上调,第12~24 d表达下调,第12 d达到最大含量。同时发现长链脂肪酰基肉碱与L-肉碱的比例在第0~12 d表达上调,表明冷冻贮藏促进了长链脂肪酸向脂肪酰基肉碱的转化[21]。脂肪酰基肉碱为脂肪酸β-氧化的中间产物,其含量的积累可促进脂肪酸在冷链贮藏后期的β-氧化,导致滩羊肉品质下降。
2.3.2 甘油磷脂类的组学分析滩羊肉在冷链贮藏过程中发生显著性变化的第2类脂质为甘油磷脂,其中PC、PE、LPC、LPE 4种亚类变化尤为显著。如表1所示,第0~12 d期间,PC(18∶0/22∶5(4Z,7Z,10Z,13Z,16Z))、PE(18∶0/18∶1(9Z))等62%的PC和PE发生明显上调,12 d后开始下降;PC(16∶0/16∶0)、PE(16∶0/18∶2(9Z,12Z))等其余脂质在冷链贮藏初始表现下调直至冷链贮藏结束。LPC(18∶2)、LPE(18∶0)等全部LPC和LPE的含量在整个冷链贮藏过程中显著增加。文献研究显示,磷脂酶活性在冷链贮藏期间的增加可导致水牛肉中LPC和LPE的含量增加以及PC和PE的含量降低[22],这表明冷链贮藏会影响PC、PE、LPC和LPE之间的脂质转化及含量变化。PC具有自氧化作用,PE具有抗氧化作用,在冷链贮藏的第12 d后滩羊肉会发生大量的PC和PE氧化代谢;环境的稳定性和氨基酸种类的不同使得PE转化为PC,导致PC短期积累,从而影响滩羊肉风味[23-24]。
3 结 论
本研究建立了UHPLC-Q-Orbitrap MS/MS结合脂质组学分析滩羊肉在冷链贮藏过程中脂质变化规律的方法。结果表明滩羊肉在冷链贮藏期间保持氧化分解状态,其中,在冷链贮藏的前12 d,PC、PE和脂肪酰基肉碱含量的短期积累导致滩羊肉在第12 d后发生大量的自氧化代谢反应,进而使得滩羊肉品质变差的概率大大提升。说明在宰后冷链贮藏的前12 d内滩羊肉脂质的变化对肉质影响相对较小,即12 d为最佳的冷链贮藏时间。同时采用二级碎裂质谱信息研究滩羊肉在冷链贮藏过程中变化显著脂质的裂解机理,获得变化显著脂质的特征碎裂片段。利用QC样本对方法稳定性进行判断,结果表明QC样本聚集明显,满足仪器对实验分析的稳定性要求。本研究利用碎裂机理和UHPLC-Q-Orbitrap MS/MS结合脂质组学的检测方法具有可靠性高、样品消耗量少和信息采集丰富等特点,可广泛应用于冷链贮藏中肉的品质判断。

