咀嚼改善PS子代大鼠抑郁样行为的作用机制
周长文 王芹春
【摘要】 目的:研究咀嚼對PS子代大鼠抑郁样行为的作用机制。方法:利用束缚应激建立产前应激大鼠(prenatal stress,PS)模型,首先采用行为学实验观察咀嚼对PS子代大鼠抑郁样以及焦虑样行为的影响,最后利用RT-PCR和Western Blot观察子代大鼠海马GluA1 mRNA和蛋白表达的变化。结果:雌雄PS子代大鼠的糖水偏好度均低于CON组(P<0.01),强迫游泳的不动时间均高于CON组(P<0.01);而咀嚼可明显提高PS子代大鼠的糖水偏好度,缩短不动时间(P<0.01),在高架十字迷宫实验中,雌雄PS子代大鼠在中央区的时间明显少于CON组,咀嚼可提高PS子代大鼠中央区的时间(P<0.05)。通过RT-PCR实验发现,PS可抑制雌雄子代大鼠海马区GluA1 mRNA的表达(P<0.05),咀嚼则可逆转PS所致对GluA1 mRNA的抑制作用。结论:咀嚼可有效逆转PS导致的子代抑郁样行为,并部分改善焦虑样行为。抑郁样行为的发生与PS抑制海马区GluA1的表达有关,咀嚼可通过提高GluA1的表达有效改善PS子代的抑郁样行为。
【关键词】 咀嚼 产前应激 抑郁样行为 谷氨酸受体
Mechanism of Chewing to Improve Depression-like Behavior in PS Offspring Rats/ZHOU Changwen, WANG Qinchun. //Medical Innovation of China, 2021, 18(15): 00-007
[Abstract] Objective: To study the mechanism of chewing on depression-like behavior in PS offspring rats. Method: The model of prenatal stress (PS) was established by restraint stress. First, the effects of chewing on depression-like and anxiety-like behaviors of PS offspring rats were observed by behavioral experiments. Finally, the expression of GluA1 mRNA and protein in hippocampus of offspring rats were observed by RT-PCR and Western Blot. Result: Both male and female PS offsprings sugar water preference were lower than those of CON group (P<0.01), and the immobility time of forced swimming was higher than that of CON group (P<0.01). However, chewing could significantly improve the sugar preference of PS offspring and shorten immobility time (P<0.01). In the elevated plus maze experiment, male and female PS progeny rats spent significantly less time in the central area than that of CON group, chewing can improve the time of the central area of PS progeny rats (P<0.05). Through RT-PCR experiments, it was found that PS can inhibit the expression of GluA1 mRNA in the hippocampus of male and female offspring rats (P<0.05), and chewing can reverse the inhibitory effect of PS on GluA1 mRNA. Conclusion: Chewing can effectively reverse the depression-like behaviors of the offspring caused by PS and partially improve the anxiety-like behaviors. The occurrence of depression-like behavior is related to PS inhibiting the expression of GluA1 in the hippocampus. Chewing can effectively improve the depressive-like behavior of PS offspring by increasing the expression of GluA1.
[Key words] Chewing Prenatal stress Depressive behavior Glutamate receptor
First-authors address: Heze Medical College, Heze 274000, China
doi:10.3969/j.issn.1674-4985.2021.15.001
越来越多的证据表明,产前时期是神经发育的关键时期,对大脑的发育产生长期的影响,从而引起学习记忆能力下降和抑郁焦虑等情绪障碍。这严重影响了人们的生活质量和健康水平,尤其目前孕期的不良心理状态已经成为导致疾病发生的重要诱因之一。产前应激(prenatal stress,PS)是指母体在怀孕期间受到外界某些不良的非特异性应激反应,可造成子代行为及精神方面如抑郁、焦虑等的异常表现。临床研究表明孕妇在应激影响下,如慢性和普通生活压力等,可增加其后代有行為和情感问题的发生率[1],发生潜在心理精神疾病的风险大大增加[2]。
众所周知,海马是Papez情感环路的重要组成部分之一,同时也是介导应激反应重要的脑区。海马通过整合应激过程所产生的信息,调控神经内分泌及行为作用,从而影响负性情绪调节和学习认知等[3]。有报道在易复发的抑郁症患者中发现,其海马体积小于正常人[4]。但经过治疗后,比未经过治疗的患者海马体积有所增加[5]。还有研究发现PS可导致海马DG区(齿状回)的神经发生[6]。
这表明海马的形态与功能与调节情绪紧密相关。谷氨酸(glutamate,Glu)是哺乳动物中枢神经系统中非常重要的一种兴奋性神经递质,其受体广泛分布在中枢神经系统,尤其其中的α-amino-3-hydroxy-5-methyl-4-isoxazole propionic acid receptors(AMPARs)80%聚集在CA1区的椎体神经元[7]。AMPARs是一种离子型谷氨酸受体,主要由GluA1-4四个亚基组成[8]。前期多项研究证实AMPARs诱导海马突触可塑性重要基础的长时程增强(long-term potentiation,LTP)和长时程抑制(long-term depression,LTD)的产生[9-10]。AMPARs调节LTP和LTD的作用尤其在生物发育早期发挥关键作用[11]。
咀嚼(chewing)是一种有效应对应激的行为[12]。在人类中,嚼口香糖可缓解压力并改善工作表现,在啮齿动物中也发现,咀嚼可改善约束或应激导致的疾病,如胃溃疡和骨质疏松症,并减轻应激诱发的认知和情感障碍[13-14]。还有研究发现咀嚼可抑制应激所增加的血浆皮质酮水平,提高空间学习能力水平以及海马DG中的神经增殖[15-16]。由此,咀嚼是否可改善产前应激所导致的抑郁样行为,其作用是否与海马中的GluA1受体相关,成为本文的研究重点。
1 材料与方法
1.1 动物 本实验在2019年9月-2020年12月进行,期间所有大鼠均饲养在温度24 ℃、湿度60%、12 h︰12 h(早8:00到晚20:00)光-暗循环的动物房中,自由饮水饮食。实验所有措施均符合动物伦理学规范。将雌性大鼠(200~220 g)和雄性大鼠(230~250 g)按照3︰1比例于晚20:30进行合笼,次日上午8:30前对雌性大鼠阴道进行涂片检查。若精子阳性定为妊娠第0天,然后将受孕大鼠单笼饲养。
1.2 产前应激及分组 按照以前研究建立产前应激大鼠模型[17-18]。束缚应激3次/d进行,即在其孕14~20 d的8:00-11:00、12:00-15:00、16:00-
19:00三个时间段各进行一次,45 min/次,每次应激的间隔时间均不少于2 h。进行过程随机选取部分束缚孕鼠在束缚瓶内放入一根长约3 cm,直径约5 mm木棍,进行咀嚼干预。在子鼠出生21 d断奶后,每窝随机拿出子代大鼠1~2只进行后续实验。所有子鼠均单笼正常饲养。根据孕鼠应激以及干预情况,将其雌雄子代各分为三组:CON组(正常孕鼠子代,n=12,雌雄各6只)、PS组(PS孕鼠子代,n=12,雌雄各6只)、PS+chew组(PS/咀嚼孕鼠子代,n=12,雌雄各6只)。
1.3 行为学实验
1.3.1 糖水偏好实验(sucrose preference test,
SFT) 快感缺失症状是抑郁样行为的核心症状。本项目将采用公认的SFT来反映大鼠的抑郁样行为。实验前所有大鼠同时给予2%(w/v)的蔗糖溶液和饮用水,适应24 h。次日在行为学实验前禁水3 h,然后称重两个相同的饮水瓶,尽量使饮用水水量和蔗糖溶液相近。为防止大鼠对饮水瓶位置产生习惯性,每天交替放置蔗糖和饮用水。记录1 h内各组大鼠糖水消耗量和饮用水消耗量。按此过程,每只大鼠进行三次糖水偏好测试。用糖水偏好度作为抑郁样行为的衡量标准。糖水偏好度=蔗糖溶液消耗量/(饮用水消耗量+蔗糖溶液消耗量)×100%。比较各实验组间的差异。
1.3.2 强迫游泳(forced swim test,FST) 将受试大鼠放入一个高50 cm,内径30 cm的圆柱形玻璃缸中,该玻璃缸盛有30 cm深的水,水温(25±1)℃。保持安静,实验时通过SMART3摄像系统(RWD,China)观察5 min内大鼠游泳状态,记录累计不动时间。其行为分为四类:(1)游泳(水中随意游动);(2)攀爬(前爪划动水面或碰触桶壁);(3)潜水(身体整个潜入水下);(4)不动(浮于水面或四肢无明显活动)。大鼠刚开始时往往为努力游泳,试图逃脱,但在一段时间过后,便为不动状态漂浮,表现为绝望状态。不动时间越长,抑郁作用便越强。当大鼠不再挣扎漂浮于水中姿势保持不动,或仅有某些轻微动作保持头部浮在水面上,此种状态所处时间视为不动时间(immobility time)。用不动时间作为抑郁样行为的衡量标准,比较各组间的差异。
1.3.3 高架十字迷宫实验(elevated plus maze) 高架十字迷宫由两个开放臂和两个闭合臂(每臂为
50 cm×10 cm),中间为10 cm×10 cm的中央部,高度约50 cm。实验开始将大鼠放在中央部,观察
5 min内大鼠停留开放臂和闭合臂的时间,测试指标:开臂停留时时间百分比=开臂停留时时间/开臂停留时间+闭臂停留时间+中央部停留时间。
1.4 RT-PCR 出生的各组子鼠,行为学实验完成后,用20%乌拉坦(1~2 mL/100 g)腹腔麻醉后,迅速断头,并分离出双侧海马。按照FAST 200提取RNA试剂盒(Fastagen,上海飞捷生物技术有限公司)说明书步骤提取海马总RNA,然后利用超微量紫外分光光度计测量RNA浓度(Bio-Teke,ND5000,北京百泰克生物技术有限公司)并记录260/A280比值判别RNA纯度。反转录反应按照Rever Tra Ace?qPCR RT Master Mix试剂盒操作步骤进行(Toyobo,日本Toyobo公司):65 ℃反应
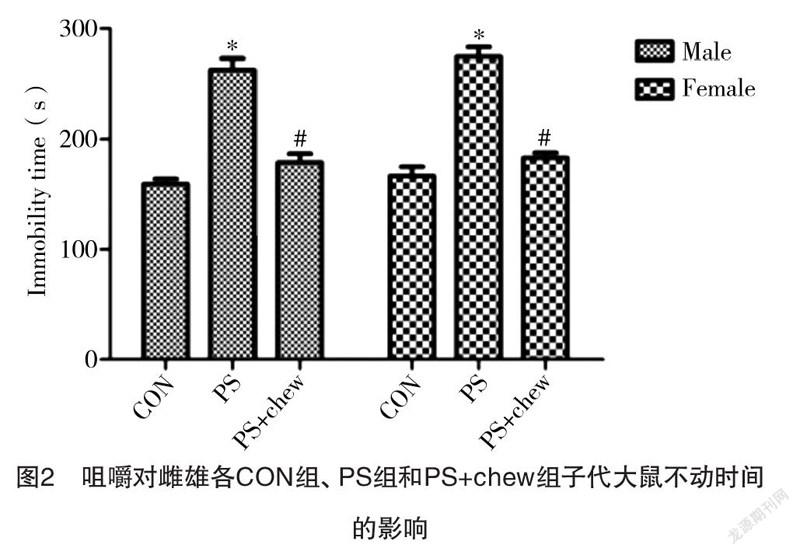
5 min,37 ℃ 15 min,50 ℃ 5 min,98 ℃ 5 min。最后使用SYBR? Green realtime PCR Master mix实时定量PCR试剂盒(Toyobo,日本Toyobo公司)上机(Bio-Rad,CFX Connect,美国Bio-Bad公司)观察RNA实时定量:预变性95 ℃ 3 min,变性95 ℃ 15 s,退火60 ℃ 30 s,延伸72 ℃30 s,38个循环。GAPDH(Sangon Biotech,B662204,生工生物工程上海股份有限公司)作为内参,GluA1(表1)相对含量以2-ΔΔCT计算。
1.5 Western Blot 各组子代大鼠海马组织使用RIPA缓冲液(Solarbio,北京索莱宝公司,在使用前加入1 mmol蛋白酶抑制剂PMSF)从海马中分离出总蛋白。测定蛋白质浓度后,蛋白质样品用10%SDS-PAGE分离,然后转移至PVDF膜(Millipore,美国Millipore公司)。在室温下用5%脱脂奶封闭2 h后,Glu A1(1︰3 300,ab31232,Abcam,美国Abcam公司)和β-actin(1︰1 000,Cell signal,美国Cell Signaling Technology公司)并在4 ℃下孵育过夜。洗涤后,加入山羊抗兔二抗(1︰5 000,Proteintech,HRP-60008,武汉三鹰生物技术有限公司),并在室温下孵育1 h。然后,将膜用ECL化学发光(Millipore,美国Millipore公司)。目标蛋白条带的灰度值由Quantity One软件扫描。
1.6 统计学处理 采用SPSS 10.0软件对所得数据进行统计分析,计量资料均数±标准误(mean±SEM)表示,进行单因素方差分析。以P<0.05为差异有统计学意义。
2 结果
2.1 咀嚼对PS子代大鼠抑郁样行为及焦虑样行为的影响
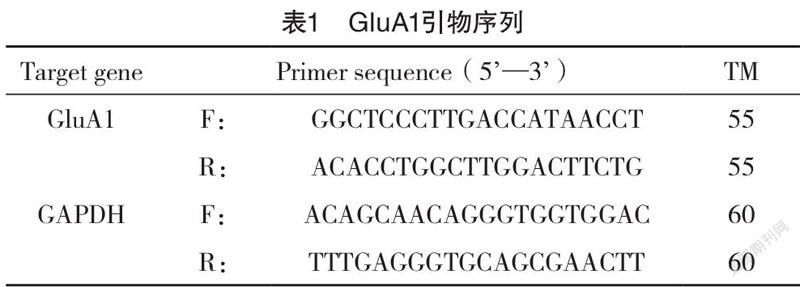
2.1.1 咀嚼对PS子代大鼠糖水偏好度的影响 为了解咀嚼在PS子代大鼠抑郁样行为的作用,首先观察咀嚼对子代大鼠的饮水总量和糖水偏好度的影响。PS组雄性子代大鼠的糖水偏好度较CON组明显下降[(40.72±3.72)% vs (69.67±8.73)%,P<0.05],與PS组相比,而咀嚼可明显改善PS子代大鼠糖水偏好度的减少[(58.62±3.05)% vs(40.72±3.72)%,P<0.05],在雌性子代中,发现了相同的结果,见图1A。在饮水总量中,雌雄各组均无明显差异(图1B)。
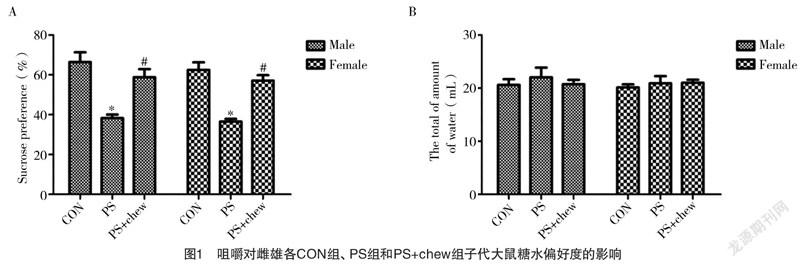
2.1.2 咀嚼对PS子代大鼠不动时间的影响 通过观察子代大鼠在强迫游泳中的不动时间做进一步验证,结果显示,PS雄性子代大鼠不动时间较CON组明显增加[(266.01±23.59)s vs (172.5±13.57)s,
P<0.05],而咀嚼明显减少PS雄性子代大鼠的不动时间[(181.27±15.61)s vs (266.01±23.59)s,P<0.05],雌性PS子代大鼠的不动时间表现出与雄性相同的变化。见图2。
2.1.3 咀嚼对PS子代大鼠焦虑行为的影响 通过高架十字迷宫实验,观察咀嚼对PS子代焦虑样行为的影响,PS组雄性子代大鼠在开放臂停留时间百分比明显短于CON组[(5.99±1.59)% vs (15.27±2.44)%,P<0.01],咀嚼则可抑制PS所致时间的减少[(10.18±1.31)% vs (5.99±1.59)%,P<0.01],见图3A。然而,PS+chew组与CON相比,到达开放臂时间百分比减少,存在显著差异[(10.18±1.31)% vs (15.27±2.44)%,P<0.05],在雌性子代大鼠中发现了相同变化的结果(图3B)。
2.2 咀嚼对PS子代大鼠海马GluA1 mRNA表达的影响 PS组雄性子代大鼠海马中GluA1 mRNA的相对表达量较CON组明显减少[(0.35±0.01) vs 1,P<0.01];与PS组相比,PS+chew组大鼠海马中的GluA1 mRNA的相对表达量显著提高[(0.97±0.20) vs (0.35±0.01),P<0.01],与CON组相比GluA1 mRNA的相对表达量无显著差异(P=0.793)。雌性大鼠影响与雄性大鼠相同。见图4。
2.3 咀嚼对PS子代大鼠海马GluA1蛋白表达的影响 PS组雄性子代大鼠中GluA1蛋白的相对表达量与CON组相比显著减少[(0.43±0.07) vs (0.77±0.08),P<0.05],同样咀嚼可抑制PS导致大鼠海马中的GluA1蛋白的减少作用[(0.66±0.09) vs (0.43±0.07),P<0.05]。同样,雌性大鼠海马GluA1蛋白的表达表现出与雄性相同的变化。见图5。
3 讨论
多项研究表明,在怀孕期间,如果母亲出现应激等不良的情绪变化,导致子代更容易出现情感、行为和认知等方面能力的下降[19-21]。Brown等[22]调查了168例孕妇,其丈夫于孕期身亡,其子女患精神分裂症、抑郁症等各种神经功能障碍的比例明显增高。因此PS是导致子代发生抑郁症的高危因素之一,具体的发生机制有待进一步探讨。束缚应激属于一种心理应激,是广泛应用并得到公认的应激原之一[23]。因此本项研究首先采用产前束缚应激建立PS动物模型,然后检测PS子代的抑郁样行为。在SFT中,结果发现PS可显著降低雌雄子代大鼠的糖水偏好度,出现明显的抑郁样行为,但各组饮水总量并没有明显差异,说明糖水饮用的减少并不是因为总量减少而导致。在强迫游泳中同样发现,PS组子代大鼠的不动时间明显延长,进一步证实PS可导致子代出现抑郁样行为。这和此前研究结果相同。咀嚼作为日常应对压力的一种实用行为,在维持身心健康方面具有重要的功能[24-25]。在啮齿动物中研究发现,应激期间的咀嚼可减轻焦虑样行为以及所引起的认知障碍[26-27]。
咀嚼是否也能改善PS所致子代的抑郁樣行为,实验又观察咀嚼在SFT和强迫游泳实验的作用,结果发现咀嚼可显著增加PS子代的糖水偏好度,减少不动时间,证实咀嚼也可改善PS子代的抑郁样行为。有趣的是,在高架十字实验中发现,虽然咀嚼可增加PS子代大鼠在中央区的时间,但是与对照组相比,还有明显差异。高架十字迷宫实验是评估大鼠焦虑样行为的经典实验,结果发现咀嚼对PS子代大鼠焦虑样行为是部分改善。咀嚼改善应激所致的抑郁样行为的机制近来发现与降低PS所致室旁核血管加压素的增高,增加海马区BDNF的表达有关[28-29]。
海马作为情绪调节的重要中枢,一直是研究焦点之一。突触可塑性是维持海马正常功能的重要基础。GluA1是介导突触可塑性的重要受体[30]。GluA1主要调节AMPARs通道的电导,其磷酸化不仅在LTP过程中增强突触调节,而且在LTP发生后仍影响AMPARs的电导[31]。LTP正常功能的维持也主要依赖于GluA1[32-34]。因此研究又探讨咀嚼对抑郁样行为的改善作用是否与GluA1有关。通过RT-PCR结果发现,PS子代大鼠海马中的GluA1 mRNA表达较对照组明显降低,初步表明PS导致的抑郁样行为与子代海马的GluA1 mRNA表达减少有关。而给予咀嚼干预后,PS子代大鼠海马的GluA1 mRNA表达较PS子代明显升高,证实咀嚼可逆转PS对子代大鼠GluA1的损害作用,从而发挥改善PS子代抑郁样行为的作用。在Western Blot实验中,发现了相同的结果。PS导致子代大鼠海马中GluA1蛋白表达相对于对照组明显降低,咀嚼干预后,可恢复PS子代大鼠海马GluA1蛋白的表达,进一步证实GluA1的变化是PS导致子代大鼠产生抑郁样行为的重要机制之一。
通过以上研究证实咀嚼可有效逆转PS导致的子代抑郁样行为,并部分改善焦虑样行为。抑郁样行为的发生与PS抑制海马区GluA1的表达有关,咀嚼可通过提高GluA1的表达有效改善PS子代的抑郁样行为。由于LTP正常功能的维持也主要依赖于GluA1[32-34],Collingridge等[35]报道,在发育期间突触后膜的AMPARs功能抑制,是LTD产生的重要机制之一。多项研究结果也发现在出生后2周的大鼠海马突触活动的改变极易影响AMPARs的表达[36-37]。
由此推测咀嚼改善PS子代的抑郁样行为与提高受损海马突触可塑性密切相关。为何咀嚼对于子代焦虑样行为只是部分改善,成为下一步研究的主要内容。
参考文献
[1] Murphy S K,Fineberg A M,Maxwell S D,et al.Maternal infection and stress during pregnancy and depressive symptoms in adolescent offspring[J].Psychiatry Res,2017,257:102-110.
[2] Talge N M,Neal C,Glover V.Antenatal maternal stress and long-term effects on child neurodevelopment:how and why?[J].Journal of Child Psychology and Psychiatry,2007,48(3-4):245-261.
[3] Goosens K A.Hippocampal regulation of aversive memories[J].Curr Opin Neurobiol,2011,21(3):460-466.
[4] Maller J J,Daskalakis Z J,Fitzgerald P B.Hippocampal volumetrics in depression:the importance of the posterior tail[J].Hippocampus,2007,17(11):1023-1027.
[5] MacQueen G M,Yucel K,Taylor V H,et al.Posterior hippocampal volumes are associated with remission rates in patients with major depressive disorder[J].Biol Psychiatr,2008,64(10):880-883.
[6] Bustamante C,Bilbao P,Contrerans W,et al.Effects of prenatal stress and exercise on dentate granule cells maturation and spatial memory in adolescent mice[J].Int J Dev Neuroscience,2010,28(7):605-609.
[7] Lu W,Shi Y,Jackson A C,et al.Subunit composition of synaptic AMPA receptors revealed by a single-cell genetic approach[J].Neuron,2009,62(2):254-268.
[8] Collingridge G L,Olsen R W,Peters J,et al.A nomenclature for ligand-gated ion channels[J].Neuropharmacol,2009,56(1):2-5.
[9] Malenka R C,Bear M F.LTP and LTD:an embarrassment of riches[J].Neuron,2004,44(1):5-21.
[10] Lee H K,Huganir R L.AMPA receptor regulation and the reversal of synaptic plasticity-LTP,LTD,depotentiation and dedepression.In:Sweatt J D,editor.Learning and memory:A comprehensive reference[M].Elsevier Press,2008.
[11] Lee H K.AMPA receptor phosphorylation in synaptic plasticity: Insights from knockin mice.In:Kittler J,Moss S J, editors.The Dynamic Synapse:Molecular methods in ionotropic receptor biology[M].Boca Raton:CRC Press,2006.
[12] Kubo K,Iinuma M,Chen H.Mastication as a stress-coping behavior[J].Bio Med Res Int,2015,2015:876409.
[13] Furuzawa M,Chen H,Fujiwara S,et al.Chewing ameliorates chronic mild stress-induced bone loss in senescence-accelerated mouse(SAMP8),a murine model of senile osteoporosis[J].Exp Gerontol,2014,55:12-18.
[14] Azuma K,Furuzawa M,Fujiwara S,et al.Effects of Active Mastication on Chronic Stress-Induced Bone Loss in Mice[J].Int J Med Sci,2015,12(12):952-957.
[15] Miyake S,Yoshikawa G,Yamada K,et al.Chewing ameliorates stress-induced suppression of spatial memory by increasing glucocorticoid receptor expression in the hippocampus[J].Brain Res,2012,1446:34-39.
[16] Kubo K,Sasaguri K,Ono Y,et al.Chewing under restraint stress inhibits the stress-induced suppression of cell birth in the dentate gyrus of aged SAMP8 mice[J].Neurosci Lett,2009,466(3):109-113.
[17] Sun H,Jia N,Guan L,et al.Involvement of NR1,NR2A different expression in brain regions in anxiety-like behavior of prenatally stressed offspring[J].Behav Brain Res,2013,257:1-7.
[18] Koehl M,Darnaudéry M,Dulluc J,et al.Maccari S.Prenatal stress alters circadian activity of hypothalamo-pituitary-adrenal axis and hippocampalcorticosteroid receptors in adult rats of both gender[J].Journal of Neurobiology,1999,40(3):302-315.
[19] Van den Bergh B R,Mulder E J,Mennes M,et al.Antenatal maternal anxiety and stress and the neurobehavioural development of the fetus and child:links and possible mechanisms.A review[J].Neurosci Biobehav Rev,2005,29(2):237-258.
[20] Stalge N M,Neal C,Glover V.Antenatal maternal stress and long-term effects on child neurodevelopment:how and why?[J].
J Child Psychol Psychiatry,2007,48(3-4):245-261.
[21] Glover V.Annual research review:prenatal stress and the origins of psychopathology:an evolutionary perspective[J].J Child Psychol Psychiatry,2011,52(4):356-367.
[22] Brown A S,van Os J,Driessens C,et al.Further evidence of relation between prenatal famine and major effective disorder[J].Am J Psychiatry,2000,157(4):190-195.
[23] Glavin G B,Pare W P,Sandbak T,et al.Restraint stress in biomedical research:an update[J].Neurosci Biobehav Rev,1994,18(2):223-249.
[24] Nishigawa K,Suzuki Y,Matsuka Y.Masticatory performance alters stress relief effffect of gum chewing[J].J Prosthodont Res,2015,59(4):262-267.
[25] Smith A P.Chewing gum and stress reduction[J].J Clin Transl Res,2016,2:52-54.
[26] Kubo K Y,Iinuma M,Chen H.Mastication as a Stress-Coping Behavior[J].Bio Med Res Int,2015:876409.
[27] Ono Y,Yamamoto T,Kubo K Y,et al.Occlusion and brain function:Mastication as a prevention of cognitive dysfunction[J].
J Oral Rehabil,2010,37(8):624-640.
[28] Kubo K Y,Kotachi M,Suzuki A,et al.Chewing during prenatal stress prevents prenatal stress-induced suppression of neurogenesis, anxiety-like behavior and learning deficits in mouse offspring[J].International Journal of Medical Sciences,2018,15(9):849-858.
[29] Qian Zhou,Ayumi Suzuki,Mitsuo Iinuma,et al.Effects of Maternal Chewing on Prenatal Stress-Induced Cognitive Impairments in the Offspring via Multiple Molecular Pathways[J].Int J Mol Sci,2020,21(16):5627.
[30] Fadó R,Soto D,Mi?ano-Molina A J,et al.Novel regulation of the synthesis of AMPA receptor subunit GluA1 by carnitine palmitoyltransferase 1C(CPT1C) in the hippocampus[J].Journal of Biological Chemistry,2015,290(42):25548-25560.
[31] Grimm V E,Frieder B.The effects of mild maternal stress during pregnancy on the behavior of rat pups[J].Int J Neurosci,1987,35(1-2):65-72.
[32] Van Den Hove D L A,Steinbusch H W M,Scheepens A,et al.Prenatal stress and neonatal rat brain development[J].Neuroscience,2006,137(1):145-155.
[33] Goffer Y,Xu D,Eberle S E,et al.Calcium-permeable AMPA receptors in the nucleus accumbens regulate depression-like behaviors in the chronic neuropathic pain state[J].J Neurosci,2013,33(48):19034-19044.
[34] Nabavi S,Fox R,Proulx C D,et al.Engineering a memory with LTD and LTP[J].Nature,2014,511:348-352.
[35] Collingridge G L,Peineau S.Long-term depression in the CNS[J].Nat Rev Neurosci,2010,11(7):459-473.
[36] Xiao M Y,Wasling P,Hanse E,et al.Creation of AMPA-silent synapses in the neonatal hippocampus[J].Nat Neurosci,2004,7(3):236-243.
[37] Abrahamsson T,Gustafsson B,Hanse E,et al.AMPA silencing is a prerequisite for developmental long-term potentiation in the hippocampal CA1 region[J].J Neurophysiol,2008,100(5):2605-2614.
(收稿日期:2021-04-08) (本文編辑:程旭然)

