5-氮杂胞嘧啶核苷降低小麦成熟胚再生频率
董鲁浩,李晓慧,宋语宁,王 贺,李兴国,别晓敏
(1山东农业大学农学院/作物生物学国家重点实验室,山东泰安271018;2山东农业大学生命科学学院/作物生物学国家重点实验室,山东泰安271018)
0 引言
DNA甲基化是一种重要的表观遗传调控机制,在染色体完整、基因组印迹、X染色体失活、转座子和逆转录病毒的抑制以及基因表达等方面起着重要作用[1-2]。在真核生物中,5-氮杂胞嘧啶核苷(5-azacytidine,5-azaC)通过抑制DNA甲基化转移酶活性维持基因组DNA的低甲基化水平[3]。
前人研究表明,低甲基化水平和高甲基化水平的平衡是植物体细胞胚胎发生的关键所在[4-5]。在培养基中添加5-azaC可改变多种植物愈伤组织的甲基化水平,进而影响胚性愈伤组织的形成和再生频率[6]。可可树(Theobroma cacaogenotype EET 103)外植体在添加5-azaC培养基中可阻止体细胞胚胎发生数量的下降,20 μmol/L 浓度处理最为有效[7]。刘艳等[8]将20.0 μmol/L 5-azaC加入水曲柳(Fraxinus mandshurica)愈伤组织的培养基中,第l天加入可明显的抑制体细胞胚胎发生,第15~21天时加入则显著促进的体细胞胚胎发生。5-azaC浓度为100 μmol/L时改变杂交落叶松hybrid larch(Larix×eurolepis)胚性愈伤组织的DNA甲基化状态,显著降低相对生长速率和胚性潜能[9]。Santos等[10]选择不同体细胞胚胎发生能力的蒺藜苜蓿(Medicago truncatula)为材料,发现100 μmol/L 5-azaC阻碍了胚性能力强的株系体细胞胚胎的产生和胚性能力弱的株系愈伤组织的生长。在菊花(Dendranthema×grandiflorum)离体材料培养过程中,5-azaC在100μmol/L以上可抑制生长发育,500 μmol/L以上有致死效应,所处理材料中基因组DNA甲基化水平明显降低[11]。Solís等[12]发现5-azaC通过降低整体DNA甲基化来促进油菜(Brassica napusL.cv.Topas)和大麦(Hordeum vulgareL.cv.Igri)的小孢子胚胎发生,2.5 μmol/L处理4天可增加胚胎诱导数,但随着处理时间的延长胚胎诱导数下降。
作为全球第一大口粮作物,小麦(Triticum aestivumL.)为世界35%~40%的人提供口粮[13-14]。随着全球人口数量的增加和人们对高品质生活的追求,利用基因工程方法和分子育种手段对小麦产量和品质等农艺性状进行改良已成为重要趋势[15-16]。小麦组织培养的再生频率是影响遗传转化的重要因素[17-18]。通过优化培养基组分来提高植物再生频率是常用手段之一[19-20]。目前5-azaC已应用于多种植物胚性愈伤组织的诱导,但在小麦成熟胚愈伤组织诱导中的研究尚未见报道。本研究通过在培养基中添加5-azaC来分析其对小麦成熟胚再生效率的影响,为进一步优化小麦成熟胚愈伤组织诱导和分化的组织培养体系提供依据。
1 材料与方法
1.1 材料种植与保存
CB037、Fielder和中国春(Chinese Spring,CS)为本研究所用的3种小麦材料。供试的小麦材料春播于山东农业大学实验站农场,收获成熟种子进行成熟胚培养。
1.2 材料培养及5-azaC浓度设置
选择饱满的小麦成熟种子消毒,先将成熟胚刮碎后接种于预培养基上暗培养7天,再转移到胚性愈伤组织诱导培养基暗培养14天,最终转移至分化培养基上光照培养(16 h光照/8 h黑暗),所有试验材料置于25℃培养箱[21]。培养基成分见表1。
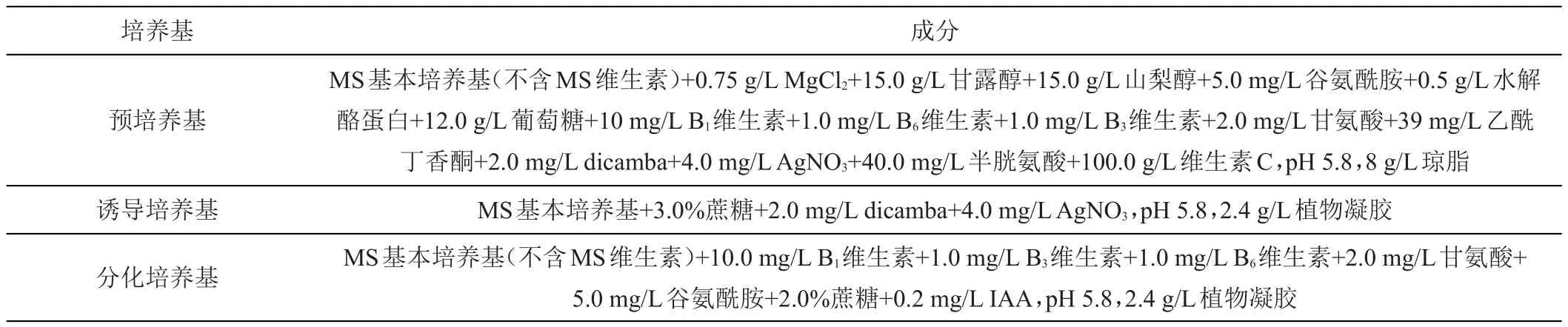
表1 试验所用培养基
在小麦成熟胚胚性愈伤组织诱导培养基中,5-azaC分别设置0 μmol/L(对照)、10 μmol/L和50 μmol/L 3个浓度处理。每个浓度取材3个重复,每个重复接种30个小麦成熟胚。
1.3 数据统计与分析
小麦成熟胚在预培养基培养7天时统计接种外植体数目,在胚性愈伤组织诱导培养基培养14天统计胚性愈伤组织诱导数目,在分化培养基上培养21天统计成熟胚的愈伤组织分化数目和绿芽诱导数目,并计算胚性愈伤组织诱导率、愈伤组织分化率和绿芽诱导率,见公式(1),公式(2)和公式(3)。利用6.85版DPS中LSD法进行方差分析。


2 结果与分析
2.1 不同浓度的5-azaC显著降低小麦胚性愈伤组织诱导率
小麦成熟胚在胚性愈伤组织诱导培养基上培养14天时,统计和分析了胚性愈伤组织诱导率。结果表明,5-azaC处理可降低CB037、Fielder和CS的胚性愈伤组织诱导率(图1)。CB037和CS胚性愈伤组织诱导率,在50 μmol/L 5-azaC浓度处理下分别为59.43%和23.89%,与对照相比,下降水平达到显著性差异;在10 μmol/L浓度处理下,胚性愈伤组织诱导率与对照相比无显著性差异。Fielder在5-azaC 10 μmol/L和50 μmol/L浓度处理下,胚性愈伤组织诱导率分别为39.13%和35.71%,与对照相比,下降程度均具有显著性差异。
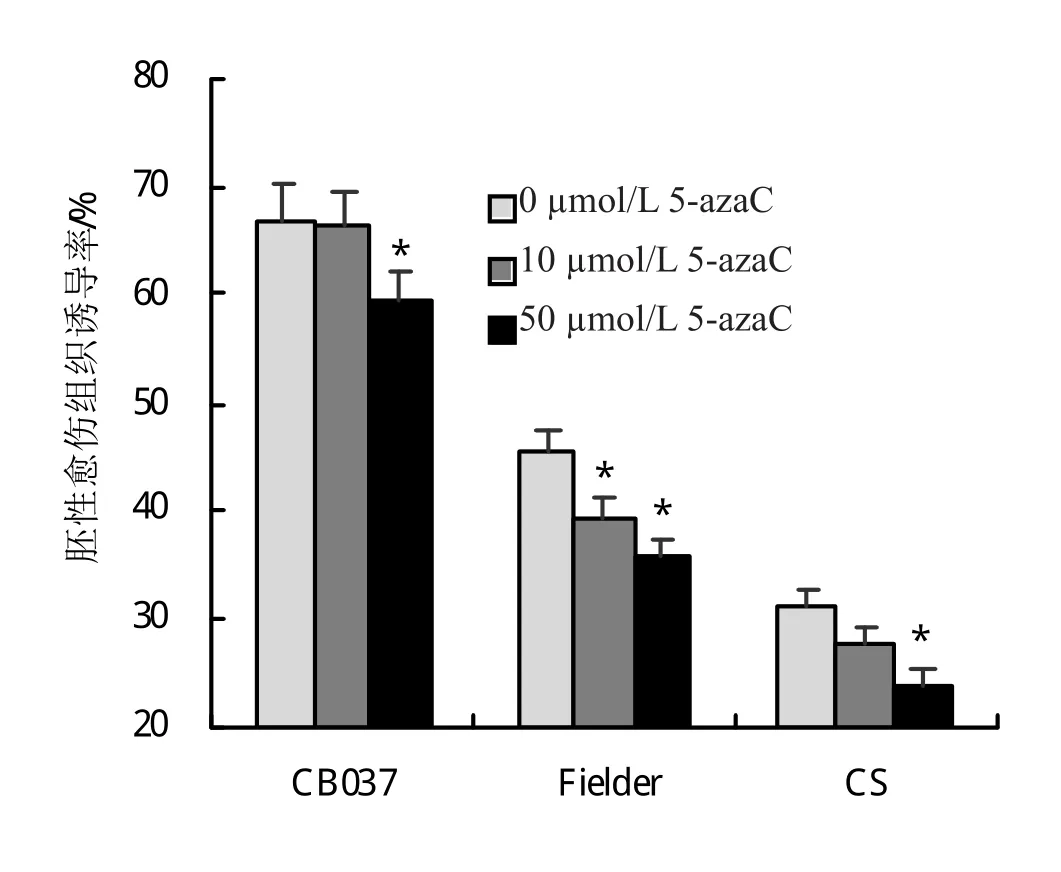
图1 不同浓度5-azaC处理降低CB037、Fielder和CS胚性愈伤组织诱导率
2.2 添加5-azaC降低CB037、Fielder和CS的愈伤组织分化率
为明确5-azaC对小麦成熟胚愈伤组织分化率的影响,在分化培养基上培养21天时统计长芽愈伤组织数目。结果发现,5-azaC的添加对CB037愈伤组织诱导率的影响最为显著,10 μmol/L浓度时愈伤组织诱导率为 40.60%,50 μmol/L时降至 32.08%,与对照47.46%相比,二者下降水平均达到极显著性差异(图2,图3A-C)。Fielder在50 μmol/L浓度处理时,与对照相比,具有显著性水平下降(图2,图3D-E)。对于CS愈伤组织诱导率而言,5-azaC的添加无明显影响(图2,图3F-G)。总体来说,5-azaC对小麦愈伤组织分化率的影响有浓度和基因型的差异。
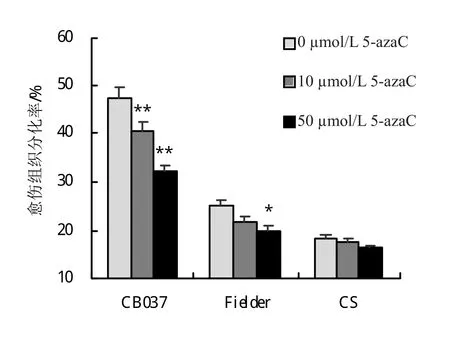
图2 不同浓度5-azaC处理降低CB037、Fielder和CS愈伤组织分化率
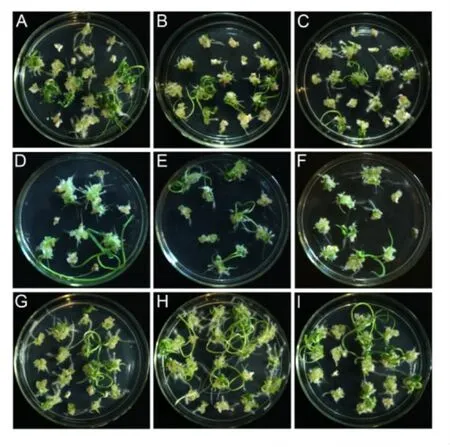
图3 不同浓度5-azaC降低不同小麦成熟胚愈伤组织分化率
2.3 添加5-azaC降低小麦成熟胚绿芽诱导率
为分析5-azaC的添加对小麦成熟胚绿芽诱导率的影响,统计了成熟胚绿芽数目。结果表明,10 μmol/L 5-azaC可降低Fielder的绿芽诱导率,并达到显著性差异水平,而对CB037和CS无明显影响。50 μmol/L 5-azaC可降低CB037的绿芽诱导率,由对照的79.62%降至54.72%,与对照相比,达到极显著差异水平;同时,亦降低Fielder的绿芽诱导率,由对照的31.15%降至27.14%,与对照相比,具有显著性差异;CS对5-azaC的添加不敏感,绿芽诱导率无显著变化(图4)。
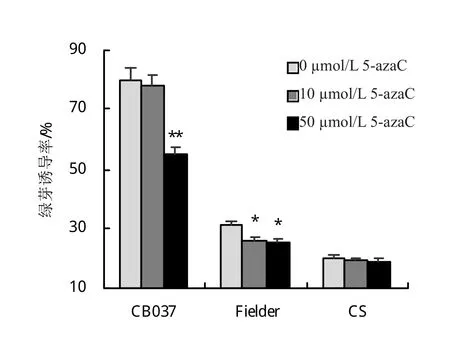
图4 不同浓度5-azaC处理降低CB037、Fielder和CS绿芽诱导率
3 讨论
体细胞胚胎发生的诱导和产生需要一定程度的DNA甲基化水平,5-azaC可以通过促进表观遗传变异来调节植物体细胞胚胎发生[10,12]。Grzybkowska等[22]以10 μmol/L 5-azaC处理拟南芥表现为强烈地抑制体细胞胚胎发生,同时外植体产生大量非胚性愈伤组织,而未处理的外植体则快速高效的形成体细胞胚胎。短柄草在5-azaC 50 μmol/L浓度处理时,胚性愈伤组织的诱导受到抑制[23]。本研究发现在愈伤组织诱导培养基中添加不同浓度的5-azaC可降低小麦成熟胚再生频率,且随着添加浓度的升高,降低效果越明显。该结果与前人研究结果基本一致。
在本研究中,5-azaC添加浓度为50 μmol/L时,显著降低CB037再生效率,胚性愈伤组织诱导率与对照相比,达到显著性差异水平;愈伤组织分化率和绿芽诱导率与对照相比,具有极显著性差异。Fielder胚性愈伤组织诱导率和绿芽诱导率与对照相比,在10 μmol/L和50 μmol/L时均有显著性差异的下降。而CS在50 μmol/L浓度时,仅胚性愈伤组织诱导率与对照相比有显著性差异的下降,在较低浓度时再生频率不受5-azaC的影响。由以上结果可知,5-azaC对小麦组织培养再生频率的影响有基因型的差异,且再生效率高的基因型所受抑制程度高于再生频率低的基因型,这可能与不同小麦基因型DNA甲基化水平不同有关系[24-25]。
前人研究发现5-azaC对离体丛生芽的抑制具有时间和剂量的累加效应,处理材料基因组DNA甲基化水平明显降低,且去处理后的继代过程中仍有部分位点保持低甲基化状态[11]。5-azaC在材料培养的第l天加入可明显抑制水曲柳体细胞胚胎发生,而第15~21天时加入则显著促进体细胞胚胎发生[8]。在油菜和大麦中,5-azaC通过降低整体甲基化水平促进小孢子胚胎诱导的起始,但同时也阻碍了愈伤组织分化时所需的重新DNA甲基化,导致处理时间延长后反而降低诱导率[12]。由此可见,外植体中甲基化水平与其再生频率具有重要关系,甲基化抑制剂添加的浓度与时间会影响外植体的再生频率。
4 结论
本研究在小麦成熟胚诱导培养基中添加5-azaC,结果发现CB037、Fielder和CS的再生频率降低。而且添加10 μmol/L 5-azaC对胚性愈伤组织诱导率、愈伤组织分化率和绿芽分化率的抑制要低于50 μmol/L。此外,5-azaC对小麦再生频率的影响有基因型差异,再生效率较高的CB037和Fielder所受抑制程度高于再生频率低的CS。植物组织培养所用外植体的甲基化水平影响再生频率,不同基因型DNA甲基化水平有差异,因此我们可以利用甲基化抑制剂优化培养基,提高不同基因型小麦的再生频率。

