LiCl-KCl熔盐体系中铀与铈电化学分离研究
王有群,曾德军,林如山,何 辉,
张志宾1,刘云海1,叶国安2
(1.东华理工大学 核资源与环境国家重点实验室,江西 南昌 330013;2.中国原子能科学研究院放射化学研究所,北京 102413)
LiCl-KCl熔盐体系中开展的电解精炼流程被认为是极具前景的干法后处理技术之一。该流程中首先采用惰性电极在LiCl-KCl共晶熔盐中分离铀和其他元素(超铀和镧系元素等),得到纯度较高的金属,随后用液态镉阴极(LCC)回收剩余的铀及超铀元素(Kuznetsov et al.,2006; Sakamura et al.,1998)。
镧系元素(Ln)是乏燃料裂片产物中含量相对较高的一类元素。同时,LiCl-KCl共晶熔盐中U3+与Ln3+(如La3+、Ce3+和Gd3+等)在惰性电极上的电化学行为相似(Kuznetsov et al., 2006)。虽然U3+/U与最不活泼的镧系元素Gd3+/Gd的电位差高于500 mV,温度723 K时理论分离因子大于1 010,理论上可将两者完全分离(Kuznetsov et al.,2006; Sakamura et al.,1998),但Sakamura等(1998)研究表明,当铀与镧系元素离子在固体阴极上时,分离因子(SF)实际仅为100~500。同时,Herrmann等(2010)对还原后的氧化物乏燃料电解精炼研究表明固体阴极上回收铀时,对Nd、Ce和La的去污因子仅分别为25、11和24。因此,研究LiCl-KCl熔盐体系中铀与镧系元素的电解分离有助于进一步掌握电解精炼流程的原理(Kuznetsov et al.,2005)。
在研究LiCl-KCl熔盐体系中U3+和Ce3+的电化学行为基础上,得到U3+和Ce3+的表观标准电位并确定最佳的分离电位和温度。随后,比较了恒电位电解LiCl-KCl熔盐中UCl4-CeCl3和UCl3-CeCl3的分离,使用扫描电镜及能量色散X-射线光谱(SEM & EDS,戴荧等,2018)和电感耦合等离子体质谱(ICP-MS)等分析产物的形貌及各元素的含量,计算U与Ce的分离因子。
1 实验部分
1.1 试剂与材料
盐酸、丙酮、KCl(优级纯,纯度99.8%)、AgCl(分析纯,纯度99.5%)购于国药集团;LiCl(纯度99.0%)购于上海中锂有限公司;无水CeCl3(纯度99.9%)、Ag丝(1 mm,纯度99.99%)购于Alfa-aesar(中国)有限公司。Pyrex玻璃(内径6 mm)购于Corning(美国)有限公司。
1.2 电化学测量和电解
电化学测量和电解均在低水氧含量手套箱(H2O和O2含量均低于2×10-6)中进行,装置如图1所示。LiCl-KCl共晶盐熔化之后缓慢插入Ag/AgCl/Pyrex玻璃参比电极(自制,其中AgCl的摩尔分数为2%)、石墨对电极和两根Mo电极,其中一根为测量电极,另一根螺旋状Mo丝为电解阴极。以Mo丝为工作电极,采用循环伏安法(CV)监测离子浓度变化;然后切换至螺旋状Mo丝进行恒电位电解分离。电解完成后,将电极提至液面以上,冷却至室温后取出。
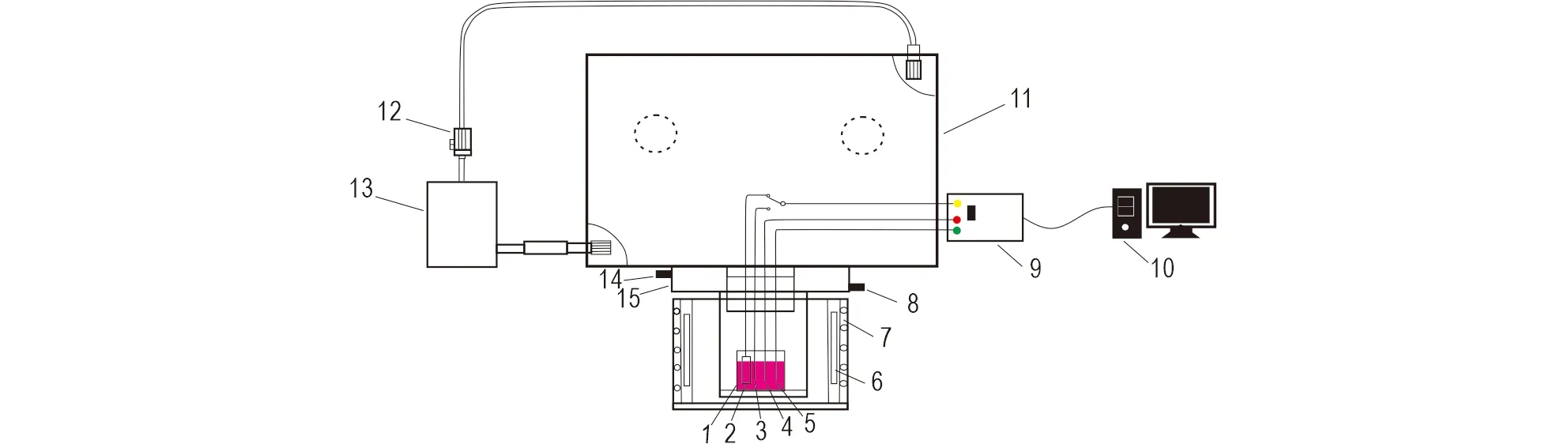
图1 熔盐电化学行为测量和电解装置示意图Fig.1 Schematic diagram of molten salt electrochemical behavior measurement and electrolysis system1.刚玉坩埚;2.螺旋状钼丝电极;3.参比电极;4.石墨对电极;6.电阻丝;7.耐火材料;8.冷却水进口;9.电化学工作站;10.电脑;11.手套箱;12.风机;13.Ar气净化装置;14.冷却水出口;15.冷却水盘
1.3 分析与表征
阴极沉积物置于水中超声除去熔盐,干燥。采用SEM观察微观形貌,并采用EDS分析元素组成;取50 mg不同形貌的沉积物(片状和枝晶状),3 mol/L HNO3溶解后稀释至10-9,采用ICP-MS测量U、Ce和Li等元素的含量,并计算U与Ce的分离因子(SF)。
2 结果与讨论
2.1 U和Ce的电化学行为及电位
2.1.1 方波伏安法
由于方波伏安法可消除电容和残余电流(Castrillejo et al.,2013; Serp et al.,2004),因此广泛应用于计算熔盐中离子的转移电子数(Castrillejo et al.,2005a,2005b; Chandra et al.,2011)。在温度733 K下,LiCl-KCl共晶熔盐体系中时,Ce3+和U4+在Mo电极上的频率为9 Hz的方波伏安曲线如图2所示。U4+于-0.300 V和-1.550 V处出现两个较为规则且呈Gauss分布的还原峰。根据半波电位的公式(Chandra et al., 2011)可得:
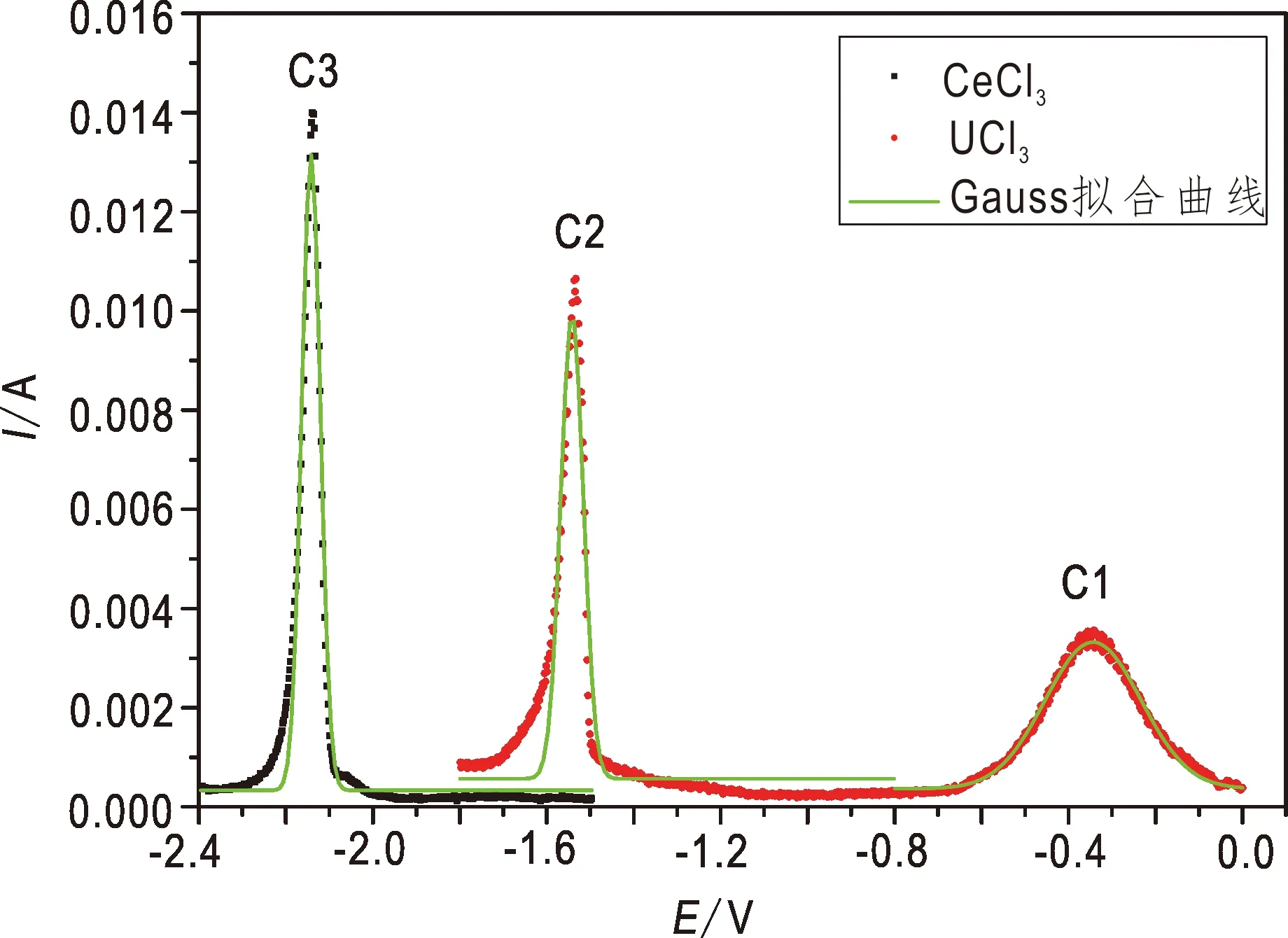
图2 LiCl-KCl熔盐体系中U4+和Ce3+在Mo电极上的方波伏安曲线Fig.2 Square wave voltammograms of U4+ and Ce3+ on the Mo electrode S为0.64 cm2;C(U4+) 为7.05×10-2 mol/L;C(Ce3+)为6.49×10-2 mol/L
(1)
式中,W1/2为半波电位宽度(V),T为温度(K),n为电子数,R为理想气体常数,通常取8.314 J/(mol K);F为 Faraday常数,一般取96 485 C/mol。计算得到C1和C2处转移的电子数n1(0.87≈1)和n4(3.08≈3),表明C1处由U4+还原为U3+:
U4++e=U3+
(2)
C2处由U3+还原为U的过程:
U3++3e=U
(3)
对于Ce3+,采取相同的方法计算得到n(3.2),表明Ce3+可一步还原为金属Ce。
2.1.2 开路计时电位法
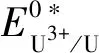
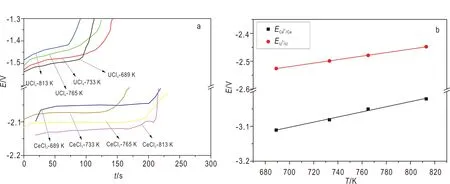
图3 LiCl-KCl熔盐体系中U4+与Ce3+在Mo电极上的OCP曲线(a)和U3+/U与Ce3+/Ce的表观标准电位与温度的关系(b)Fig.3 Open circuit chronopotentiograms of U4+ and Ce3+ on the Mo cathode in the LiCl-KCl eutetic(a), dependence of apparent standard potential of U3+/U and Ce3+/Ce on temperature(b)
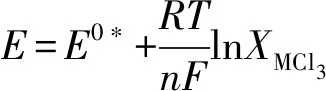
(4)
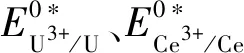
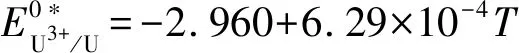
(5)
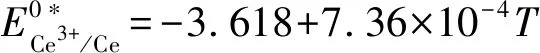
(6)
因此,温度为689 K时U3+/U和Ce3+/Ce的表观标准电位差最大(0.584 V),因此选择689 K作为最佳的电化学分离温度。
2.2 CeCl3-UCl4体系
LiCl-KCl熔盐体系中CeCl3-UCl4在Mo电极上的CV曲线(ν=500 mV/s)如图4a所示,电位负方向扫描时出现了-0.45 V、-1.60 V和-2.21 V三个还原峰,分别对应U4+/U3+、U3+/U(Masset et al., 2005)和Ce3+/Ce(Marsden et al., 2011)反应,而位于-1.85 V左右的峰未有对应的氧化峰,可能是由于Ce3+吸附引起的。U3+/U和Ce3+/Ce的峰电位相差约600 mV,分离U和Ce,设定电位为-1.70 V进行恒电位电解。
图4b为UCl4-CeCl3恒电位电解曲线。为防止U4+/U3+循环氧化还原消耗电量并获得一定量的UCl3,因此-1.0 V预电解1.15 h。-1.70 V恒电位电解时,1.1~1.5 h内电流先由-150 mA增大至-220 mA,1.5~6.8 h电流基本稳定于-220 mA,6.8~9.6 h电流由-220 mA减小至-25 mA即停止电解。隔一段时间,切换至测量回路,采用CV法(马建国等,2012;郭伟华等,2016)测定熔盐中各种离子的含量(Tylka et al.,2015)。由图4a可知,0~2.20 h内CV曲线中三个还原峰的峰电流基本不变。这可能是由于熔盐主体的电活性物质不断减小,但测量电极位于坩埚的边缘,周围CeCl3和UCl4浓度未有明显变化。随着电解的进行至9.6 h,-0.45 V和-1.60 V两个还原峰的峰电流逐渐减小,由20 mA和50 mA降至0 mA左右,表明U4+浓度逐渐降低。
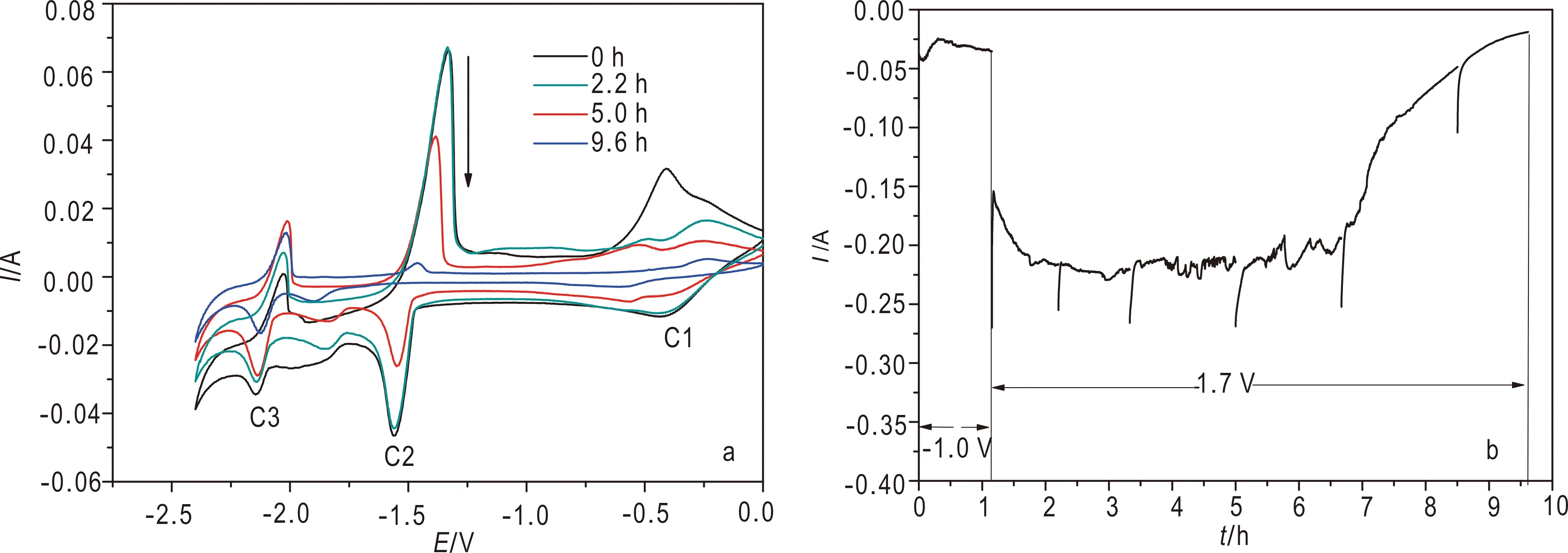
图4 CeCl3-UCl4混合熔盐的CV曲线 (a)和恒电位电解曲线 (b)Fig.4 Cyclic voltammogram of Ce3+-U4+ mixture at different times(a), Constant potential electrolysis curve of Ce3+-U4+ mixed molten salt(b)E=-1.00 V,t=1.15 h and E=-1.70 V vs. Ag/AgCl(2 mol%), t=8.5 h
SEM和EDS能谱(王云等,2018)如图5所示,EDS分析结果表明电解产物中主要含有U(41.25%)、Ce (32.96%)和Cl(21.26%),并含有少量Fe和Al。电解产物中含有33.0% Ce,表明CeCl3-UCl4体系中恒电位电解分离U和Ce较为困难。这与Kolodney(1982)电解含UCl4的熔盐只得到非金属外观的沉积物结果相似。这是由于UCl4电解产生的金属U与UCl4反应生成UCl3(Serrano et al., 2000),使UCl4和UCl3循环转化,从而导致生成金属铀晶体不断减小,因此电解UCl4得不到铀金属。
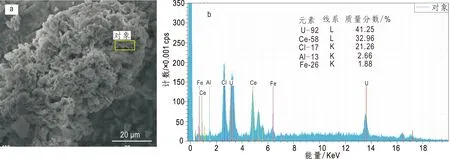
图5 UCl4-CeCl3直接电解的产物SEM(a)和EDS谱图(b)Fig.5 SEM(a) and EDS(b) pattern of product electrolyzed by UCl4-CeCl3 directly
2.3 CeCl3-UCl3体系
采用Li还原LiCl-KCl熔盐中UCl4生成U金属,金属U与UCl4反应可得到UCl3,总的反应为:
UCl4+Li=UCl3+LiCl
(7)
将金属Li投入熔盐中,剧烈搅拌使Li与UCl4反应后可得到紫红色的UCl3。此时,加入无水CeCl3即可得到UCl3-CeCl3混合熔盐。
由图3b可知,689 K时U3+/U和Ce3+/Ce的表观标准电位差最大(0.584 V),因此选择689 K作为最佳的电化学分离温度。采用循环伏安法以确定最佳电解电位和终点,LiCl-KCl熔盐体系中Ce3+和U3+混合之后于Mo电极上的循环伏安曲线(刘淑娟等,2006)如图6所示。该曲线共出现三个还原峰(C1、C2和C3),分别为U4+/U3+(-0.45 V)、U3+/U(-1.54 V)和Ce3+/Ce(-2.16 V)。由CV曲线可知,还原后的熔盐中0.45 V的还原峰电流小于5 mA,表明熔盐中U主要以U3+形式存在。为了实现Ce和U的分离,同时缩短电解时间,因此选择-1.70 V作为最佳的电解电位。电解过程中采用循环伏安法监测熔盐体系中Ce3+和U3+的浓度,由图6可知,随着电解的进行,C3的峰电流基本不变,而C2处峰电流逐渐减小,并于4.4 h时电流趋于0 A。
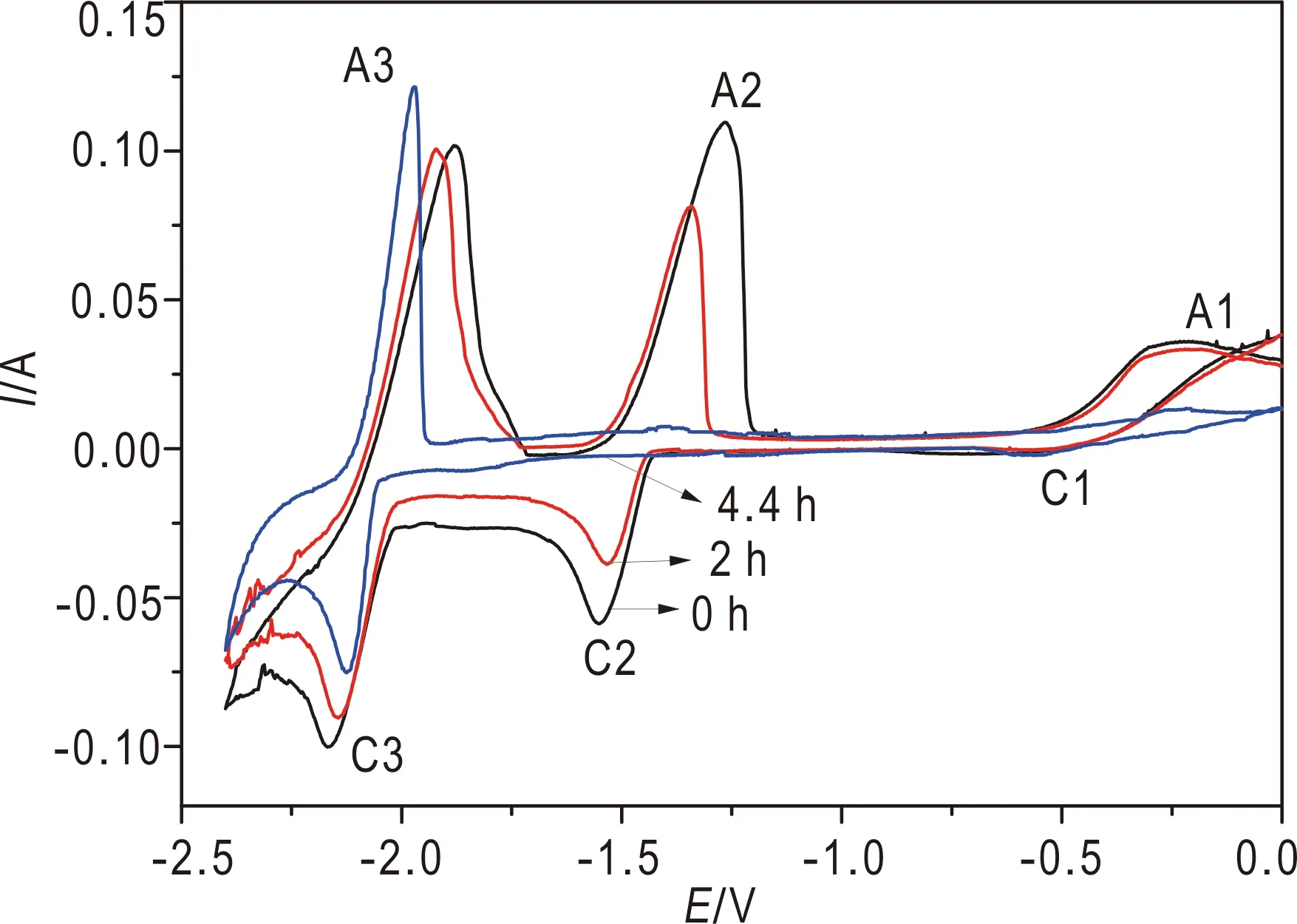
图6 不同时刻Ce3+-U3+混合熔盐的CV曲线Fig.6 CV curve of Ce3+-U3+ mixed molten salt at different times ν为500 mV/s;T为689 K;s为0.64 cm2
Ce3+-U3+混合熔盐的电解曲线如图7a所示,电流在1.25 h内由50 mA增大至250 mA,并在250 mA维持了1.0 h,随后电流减小至25 mA左右即停止电解。这是由于电解初期随着U沉积于Mo电极上,电极面积迅速增大,而U3+浓度降低较少,因此电流增大;电解中期,电极面积增大而U3+浓度减少,两者达到平衡,因此电流维持不变;电解后期,由于U3+含量急剧减小引起电流逐渐减小。
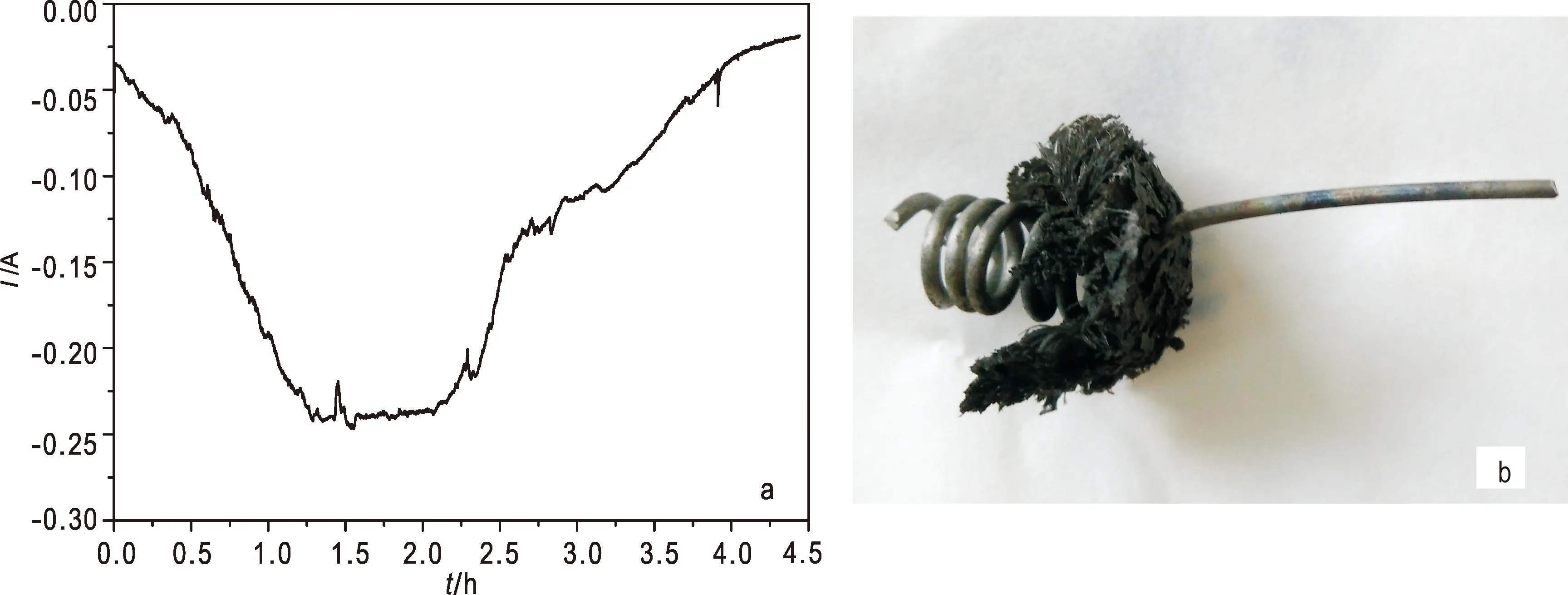
图7 LiCl-KCl熔盐体系中U3+和Ce3+的恒电位电解曲线(a)和清洗后的电解产物(b)Fig.7 Potentiostatic electrolysis curve of U3+ and Ce3+ in LiCl-KCl molten salt system(a), electrolyzed product after washing(b)
电解得到的阴极产物置于去离子水中超声清洗除盐,沉积物如图7b所示。沉积物表面具有金属光泽,置于空气中慢慢变黑色,可能是由于金属铀被空气中的O2氧化造成的(Serrano et al.,2000)。
取少量清洗后的沉积物于扫描电镜下观察形貌并采用EDS分析元素组成,结果如图8所示。电解沉积物主要以片状和枝晶为主。EDS分析结果表明金属中片状和枝晶状铀的含量分别为95.40%和94.86%。
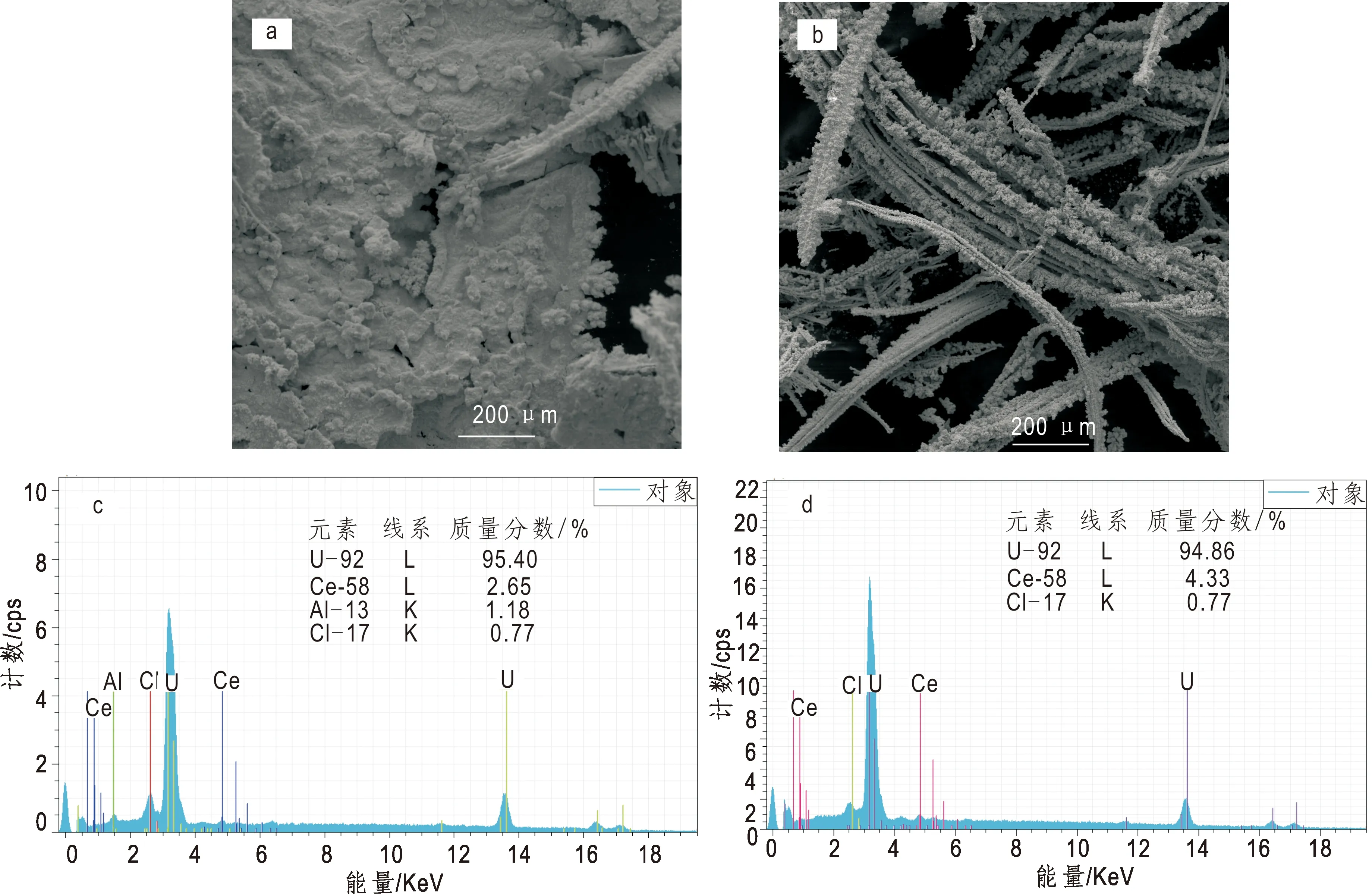
图8 片状(a,c)和枝晶状(b,d)电化学沉积物的SEM和EDS图Fig.8 SEM and EDS diagrams of flake (a,c) and dendritic electrochemical deposits(b,d)
沉积物ICP-MS分析结果如表1所示。片状和枝状金属中U含量分别为93.84%和92.65%,Ce含量分别为5.05%和5.54%。U对Ce的分离因子(SF)可由下式计算:
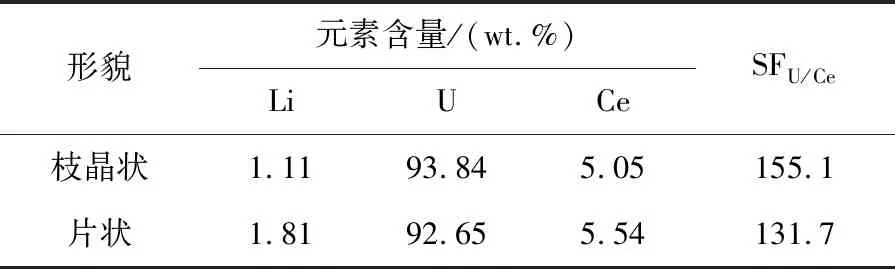
表1 ICP-AES测定的枝晶状和片状阴极沉积物中各元素含量Table 1 Content of each element in dendritic and flaky cathodic deposits determined by ICP-AES
(8)
假设沉积物中金属铀的活度为1,且盐相和沉积相为平衡时,SF与表观标准电位差ΔE0*(V)之间的关系(Conocar et al.,2006)为:
(9)
温度689 K时,U3+/U和Ce3+/Ce的表观标准电位分别为-1.988 V和-1.404 V,ΔE0*约为0.584 V,两者理论的SF值大于1012。计算得到U与Ce的SF值分别为155.1和131.7,远小于理论值。造成这一现象的主要原因是:①由于电解体系中无搅拌装置,易发生溶差极化造成Ce在U之前沉积于Mo电极上;②熔盐电沉积过程中,当铀的浓度较低时易发生电化学极化(Kobayashi et al.,1995);③铈与铀形成固溶体而发生欠电位沉积造成金属中铀活度系数远小于1(Chang et al.,2013)。
3 结论