临床和多相CTA原始图像的阿尔伯塔卒中项目早期CT评分不匹配对早期大脑中动脉供血区脑梗死的预测价值
雷寿平 郑建民
【摘要】 目的:探討临床和多相CTA原始图像的阿尔伯塔卒中项目早期CT评分不匹配对大脑中动脉供血区早期脑梗死的预测价值。方法:回顾性分析2018年1月-2020年1月在福建医科大学闽东医院神经内科住院的单侧大脑中动脉供血区梗死患者的临床资料。根据NIH中风量表(NIHSS)评分和住院后72 h评估早期神经功能恶化(END)情况,将患者分为END组和非END组。所有患者入院本院急诊科后均立即完成了头颅多相CTA检查,多相CTA原始图像的早期CT评分为阿尔伯塔卒中项目早期CT评分(MCTA原始影像-ASPECTS)。该项目的早期CT评分不匹配(NIHSS/MCTA-ASPECTS不匹配,NMM)定义为NIHSS评分≥8分,MCTA原始图像-ASPECTS≥8分。应用单因素和多元logistic回归分析脑梗死END的影响因素。结果:两组患者的性别、年龄、高血压、高脂血症、高尿酸血症、心房颤动、入院时NIHSS评分比较,差异均无统计学意义(P>0.05);两组的2型糖尿病、NMM、入院72 h NIHSS评分比较,差异均有统计学意义(P<0.05)。多因素logistic回归分析,NMM是大脑中动脉供血区END的独立预测因子(P<0.05)。结论:NIHSS/MCTA原始图像-ASPECTS得分的不匹配对大脑中动脉供血区脑梗死早期阶段的神经系统恶化的具有确定的预测价值。
【关键词】 阿尔伯塔卒中项目早期CT评分 脑梗死 早期神经系统恶化
[Abstract] Objective: To explore the predictive value of early CT score mismatch between the clinical and multiphase CTA original images of the Alberta stroke program for early cerebral infarction in the middle cerebral artery blood supply area. Method: The clinical data of patients with unilateral middle cerebral artery blood supply area infarction who were hospitalized in the Department of Neurology, Mindong Hospital, Fujian Medical University from January 2018 to January 2020 were retrospectively analyzed. According to the NIH Stroke Scale (NIHSS) score and the 72 h post-hospital assessment of early neurological deterioration (END), patients were divided into END group and non-END group. All patients completed the multi-phase CTA examination of the skull immediately after admission to the emergency department of this hospital. The early CT score of the original multi-phase CTA image was the early CT score of the Alberta Stroke Project (MCTA original image-ASPECTS). The item’s early CT score mismatch (NIHSS/MCTA-ASPECTS mismatch, NMM) is defined as NIHSS score ≥8 points, and MCTA original image-ASPECTS ≥8 points. Univariate and multivariate logistic regression were used to analyze the influencing factors of cerebral infarction END. Result: There were no significant differences in gender, age, hypertension, hyperlipidemia, hyperuricemia, atrial fibrillation, and NIHSS scores on admission between the two groups of patients (P>0.05); there were statistically significant differences in type 2 diabetes mellitus, NMM and 72 h NIHSS score between the two groups (P<0.05). Multivariate logistic regression analysis showed that NMM was an independent predictor of END in the middle cerebral artery supplying area (P<0.05). Conclusion: The mismatch of NIHSS/MCTA original image-ASPECTS scores has a confirmed predictive value for the early-stage of neurological deterioration in cerebral infarction in the middle cerebral artery blood supply area.
[Key words] ASPECTS Cerebral infarction Early nervous system deterioration
First-author’s address: Mindong Hospital Affiliated to Fujian Medical University, Ningde 355000, China
doi:10.3969/j.issn.1674-4985.2021.17.035
中风是中国的主要死因,也是世界上的第二大死因。同时,它是成人残疾的主要原因之一,并且发病率每年都在增加[1]。其中,急性缺血性卒中的颅内动脉病变中大脑中动脉病变的发生率最高,占66%~73.3%[2]。大脑中动脉血管疾病是早期神经系统恶化(END)(缺血性中风发作后的最初72 h内)的独立危险因素,其发生率高达1/3。它是脑梗死预后不良的独立预测因子[3]。鉴于此,它是早期神经系统恶化的敏感预测指标,因此必须采取有效而积极的预防措施以防止进一步的梗死。最初,文献[4]研究表明,采用非增强型CT脑扫描来评估早期缺血性细胞水肿的方法,即阿尔伯塔卒中项目早期CT评分(ASPECTS)。由于其时间依赖性,许多研究将其应用扩展到CTA和多相CT/MRI。与CT相比,使用MRI/DWI(弥散权重图像)检测早期缺血性改变具有更高的敏感性和一致性,并且DWI-ASPECTS评分与DWI上的病变体积有很强的相关性。文献[5]利用NIHSS和DWI-ASPECTS之间的不匹配来预测大脑中动脉供血区脑梗死的早期神经系统恶化。患有脑梗死且不匹配较少的患者容易恶化,这表明该不匹配可用作早期神经系统恶化的独立预测因子,并为急性缺血性中风患者提供精确的个性化治疗。然而,这样的研究仍然存在以下问题:当地诊所需要很长时间进行颅骨MRI检查。而且,它主要是由一个中心进行的,由于样本数量有限,结论应进一步讨论。众所周知,“时间就是大脑”,治疗中风的时机对其预后至关重要,因此找到一种快速有效的预测方法尤为重要。现在,中国大多数基层医院都可以进行多阶段CTA调查,为此笔者特进行本次研究现将相关研究结果报道如下。
1 资料与方法
1.1 一般资料 回顾性收集2018年1月-2020年1月福建医科大学附属闽东医院神经内科的87例因大脑中动脉供血区中风住院患者的详细临床信息,其中男52例,女35例,平均年龄(67.89±3.89)岁。纳入标准:经头部CT或MR确诊,无动脉或静脉溶栓治疗的单侧大脑中动脉供血区急性期的中风患者;年龄≥18岁;发病后24 h内住院。排除标准:入院时生命体征不稳定;无法配合;由于转院而信息不全的患者。
1.2 方法 (1)记录患者的基本生命体征(包括:入院收缩压、入院舒张压、糖尿病、高脂血症等),实验室检查和神经影像学数据在入院时评估NIHSS评分,并评估脑梗死的严重程度入院后72 h内两次。(2)多时相CTA检查的步骤如下:GE64排螺旋CT扫描仪。给患者建立了肘静脉通路,并使用高压注射器静脉推注非离子型造影剂68%碘伏。当主动脉弓造影剂的密度达到100 HU时,将自动触发扫描,参数为管电压120 kV和管电流250 mAs。将0.625 mm的切片厚度用于成像。總共以5 mL/s的速度注入80 mL造影剂,并用50 mL等渗盐水洗涤,进样流速为6 mL/s。第一步是从主动脉弓到根尖的扫描,图像获取时机发生在健康大脑的峰值动脉期,它是通过注射监控启动的,采集时间在7 s内完成,平均剂量为700~800 mGy/cm。第二阶段以4 s的延迟开始,从而将药物的位置重新定位到头骨的底部。其余两个阶段在3~4 s完成,三个阶段的间隔为8 s。(3)MCTA-ASPECTS:将大脑中动脉的血液供应分为10个区域,分别称为尾状核(C)、豆状核(L)、内囊(IC)和皮质M1、M2、M3、M4、M5、M6及岛叶(I)。总分10分,每个累积面积减少1分,大脑中动脉供血区的弥漫性缺血为0分[6-7]。(4)使用美国国立卫生研究院卒中量表(NIHSS)评估神经功能缺损的严重程度,以定义早期神经功能恶化(END)的情况。NIHSS在入院时和入院72 h进行评分,END定义为两个NIHSS得分≥2分的D值,根据得分将患者分为END组和非END组。(5)NIHSS/MCTA-ASPECTS不匹配定义为NIHSS得分≥8分,MCTA-ASPECTS≥8分,定义为NMM。根据标准,将患者分为NMM和匹配。
1.3 统计学处理 使用SPSS 24.0统计软件进行分析。计量资料用(x±s)表示,比较采用t检验;计数资料以率(%)表示,比较采用字2检验。对于上述检验中P<0.05的变量作为自变量,END作为因变量,进行logistic回归分析。以P<0.05为差异有统计学意义。
2 结果
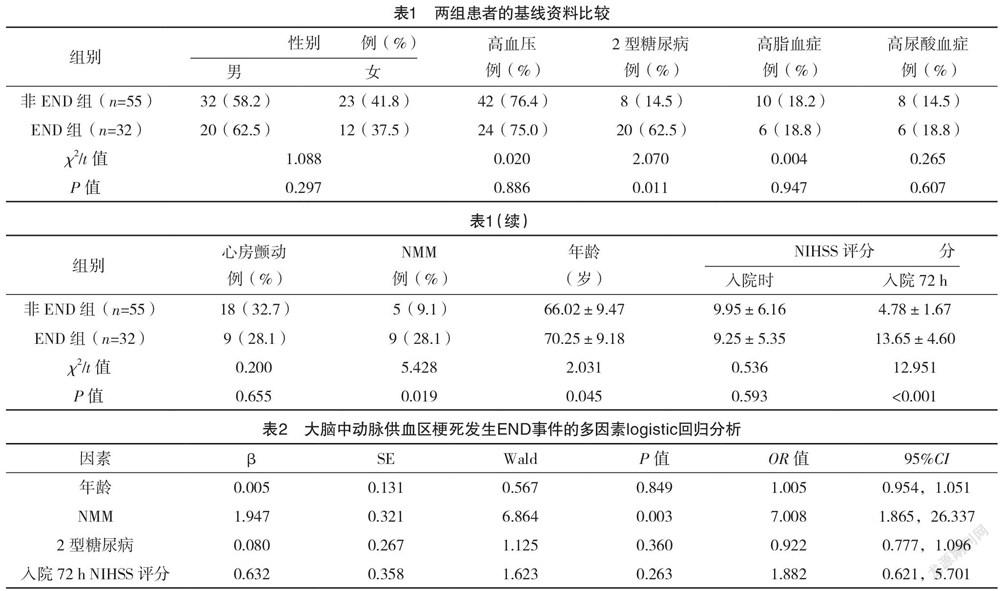
2.1 单因素分析 非END组55例患者,END组32例患者。两组患者的性别、年龄、高血压、高脂血症、高尿酸血症、心房颤动、入院时NIHSS评分比较,差异均无统计学意义(P>0.05);两组的2型糖尿病、NMM、入院72 h NIHSS评分、差异均有统计学意义(P<0.05)。见表1。
2.2 影响大脑中动脉供血区梗死发生END事件的多因素logistic回归分析 NMM是大脑中动脉供血区END的独立预测因子(P<0.05),见表2。
3 讨论
在许多试验中都报道了通过不增强的CT脑扫描对早期缺血性细胞水肿进行分级的方法(ASPECTS)[7]。非增强头颅CT(NCCT)是时间依赖性的,对于有早期缺血迹象的患者,缺血范围可能被低估了。后来,许多研究将这项研究扩展到了CTA和多模式CT/MRI。DWI序列比NCCT对早期缺血性改变(EIC)更敏感,尤其是对于中风征象不明显的患者。因此,DWI-ASPECTS可能会高估EIC与预后之间的关系[8]。不建议在短暂性脑缺血发作(TIA)或轻度卒中患者中使用DWI-ASPECTS,因为在发病6 h内瘫痪患者的NCCT和DWI-ASPECTS之间的差异并不显著。来自CTA源图像(ASP-SI)的ASPECTS与时间无关[9]。与NCCT/ASPECTS相比,CTA-SI在各个阶段的低密度阴影中具有较高的一致性。在急性缺血性中风的早期,NCCT/ASPECTS和CTA-SI有显著差异。随着时间的流逝,这种差异逐渐减小。因此,CTA-SI在暴露早期卒中以及NCCT和DWI中的异常变化方面具有时间优势。
此外,CTA-SI ASPECTS在中風发作的所有阶段均能更精确地达到最终的梗死范围。CTA-SI低密度成像与灌注图像上的脑血容量(CBV)减少和DWI中的病变有关,这与两者不可逆的梗死面积一致。立即在住院患者中完成MRI检查目前尚未在全国范围内普及,这很耗时[10]。
本研究在入院时完成基本的CT检查时使用了随机CT和CTA检查,并在不进行后处理的情况下完成了CTA-SI/ASPECTS评分。“时间就是大脑”,调查越早完成,预后就越好。END组32例,占87例单侧大脑中动脉供血区急性缺血性卒中的36.8%。这项研究的结果与Fang团队和其他研究报告的研究相似,END发生率为33%[5]。但是,该比率高于Hsu等[11]报道的24.1%。这项研究的数据显示,有16.1%的中风患者患有NMM,这与Fang和其他研究报告的19.1%相近。比文献[12]的26.5%要低。这种差异可能主要是由于不同研究中脑梗死部位的NIHSS和ASPECTS评分时间不同。这也可能与某些早期患者的EIC的DWI-ASPECTS高估有关。
研究表明,缺血半暗带和核心梗死区域在卒中早期更为常见,并逐渐减少[13]。动物研究实验还显示,这种失配在6 h内出现并逐渐消失,直到中风发作后48 h[14]。以上结果表明,应尽快进行NIHSS和CTA-SI/ASPECTS调查,以确定是否存在NMM,并为治疗急性脑梗死提供基础。例如,对于NMM患者,血管内再通也可以使患者受益[15]。根据logistic回归分析,NMM是大脑中动脉供血区脑梗死END的独立预测因子,比值比为7.008,表明NDM患者发生END的可能性是非END的7倍提示NMM是END的预测因子。
缺血性中风的范围可以根据缺血的程度分为三个病变区域。首先是最严重的局部缺血,血流量低。发生的梗死是不可逆的,称为核心梗死区。在第二个病变中,在核心梗死区域周围,血液供应受到的损害少于核心梗死,并且细胞功能受损。在进行侧支循环等代偿性血液供应的情况下,可以保证细胞结构不会受到损害。抢救出来的脑组织称为缺血半暗带。第三区域,即缺血半暗带的外围,大脑是局部缺血的,但仍能发挥功能,被定义为减少血流量的区域。其中,缺血半暗带加血流减少带统称为“非核心低灌注区”[16]。三个区域的血流减少可能会发生异常功能,反应临床症状严重程度的临床NIHSS评分可以代表脑梗死的核心区域(CTA-SI/ASPECT可以检测到梗死的核心)和非核心灌注不足区域的神经受损。因此,NIHSS的早期CT评分与阿尔伯塔中风研究的多相CTA原始图像之间的不匹配可能表明更大的非核心低灌注区域。脑梗死是一个与血液供应有关的动态过程,因此改善血液供应可以拯救缺血半暗带,并有助于改善临床预后[17]。血流量减少的脑组织从无功能状态发展,最终梗死可导致临床恶化[18-20]。
基于此理论,可以解释阿尔伯塔卒中项目早期CT评分结果的临床图像与CTA原始图像之间的不匹配。可以预测在大脑中动脉供血区发生的中风的早期神经系统恶化,因此具有较大的非核心低灌注区域的缺血性中风患者更可能受益于再灌注治疗,并且为个体化治疗提供了可靠的证据。
该研究的局限性是单中心研究,并且样本量小且病例数少。此外,这是一项回顾性研究,无法避免统计偏差。由于技术的发展,一站式CT检查现在正在越来越多的大都市中出现。住院患者能够在短时间内进行CT、CTA和CTP检查。缺血半暗带的一站式CT识别仅需要通过相关软件进行计算。而且,它是便携式的,简单的并且高度实用的。它为在医院实现个性化治疗提供了希望。一站式CT普及后可以通过替换一站式CT来改进这项研究,甚至可为尚未安装该设备的当地医院提供有价值的指导。
综上所述,笔者认为NIHSS/MCTA原始图像-ASPECTS评分的不匹配为大脑中动脉供血区脑梗死的早期阶段神经系统恶化提供了可信赖的预测价值,至于更多的评估,仍需要更大规模的研究。
参考文献
[1] Yang G,Wang Y,Zeng Y,et al.Rapid health transition in China, 1990-2010: findings from the Global Burden of Disease Study 2010[J].The Lancet,2013,381(9882):1987-2015.
[2] Johnson C O,Nguyen M,Roth G A,et al.Global, regional, and national burden of stroke, 1990-2016: a systematic analysis for the Global Burden of Disease Study 2016[J].The Lancet Neurology,2019,18(5):439-458.
[3] Kim J M,Bae J H,Park K Y,et al.Incidence and mechanism of early neurological deterioration after endovascular thrombectomy[J].Journal of Neurology,2019,266(3):609-615.
[4] Hadley G,Beard D J,Couch Y,et al.Rapamycin in ischemic stroke: Old drug, new tricks?[J].Journal of Cerebral Blood Flow & Metabolism,2019,39(1):20-35.
[5] FANG Chuanqin,WANG Juanjuan,DU Yanqun,et al.NIHSS/DWI-ASPECTS mismatch predicts early neurological deterioration in patients with middle cerebral artery cerebral infarction[J].Journal of Apoplexy and Nervous Diseases,2019,36(7):628-631.
[6] Demeestere J,Scheldeman L,Cornelissen S A,et al.ASPECTS versus CT perfusion to predict functional outcome after successful reperfusion in acute ischemic stroke[J].Stroke,2018,49(10):2361.
[7] Wilson A T,Dey S,Evans J W,et al.Minds treating brains: understanding the interpretation of non-contrast CT ASPECTS in acute ischemic stroke[J].Expert Review of Cardiovascular Therapy,2018,16(2):143-153.
[8] Menon B K.Neuroimaging in acute stroke[J].CONTINUUM: Lifelong Learning in Neurology,2020,26(2):287-309.
[9] Pallesen L P,Khomenko A,Dzialowski I,et al.CT-angiography source images indicate less fatal outcome despite coma of patients in the Basilar Artery International Cooperation Study[J].International Journal of Stroke,2017,12(2):145-151.
[10] Kobkitsuksakul C,Tritanon O,Suraratdecha V.Interobserver agreement between senior radiology resident, neuroradiology fellow, and experienced neuroradiologist in the rating of Alberta Stroke Program Early Computed Tomography Score (ASPECTS)[J].Diagnostic and Interventional Radiology,2018,24(2):104.
[11] Hsu C C T,Watkins T,Kato K,et al.Iodine-stained fragmented thromboembolism[J].The Neuroradiology Journal,2019,32(6):445-451.
[12] Dávalos A,Blanco M,Pedraza S,et al.The clinical-DWI mismatch: a new diagnostic approach to the brain tissue at risk of infarction[J].Neurology,2004,62(12):2187-2192.
[13] Vilela P,Rowley H A.Brain ischemia: CT and MRI techniques in acute ischemic stroke[J].European Journal of Radiology,2017,96:162-172.
[14] Kameda K,Uno J,Otsuji R,et al.Optimal thresholds for ischemic penumbra predicted by computed tomography perfusion in patients with acute ischemic stroke treated with mechanical thrombectomy[J].Journal of Neurointerventional Surgery,2018,10(3):279-284.
[15] Hilditch C A,Nicholson P,Murad M H,et al.Endovascular management of acute stroke in the elderly: a systematic review and meta-analysis[J].American Journal of Neuroradiology,2018,39(5):887-891.
[16] Alemseged F,Shah D G,Bivard A,et al.Cerebral blood volume lesion extent predicts functional outcome in patients with vertebral and basilar artery occlusion[J].International Journal of Stroke,2019,14(5):540-547.
[17] Nakamura S,Kitagawa K,Goto Y,et al.Incremental prognostic value of myocardial blood flow quantified with stress dynamic computed tomography perfusion imaging[J].JACC: Cardiovascular Imaging,2019,12(7 Part 2):1379-1387.
[18] Kaolawanich Y,Boonyasirinant T.Incremental prognostic value of aortic stiffness in addition to myocardial ischemia by cardiac magnetic resonance imaging[J].BMC Cardiovascular Disorders,2020,20(1):1-11.
[19] Fabiani I,Pugliese N R,La Carrubba S,et al.Incremental prognostic value of a complex left ventricular remodeling classification in asymptomatic for heart failure hypertensive patients[J].Journal of the American Society of Hypertension,2017,11(7):412-419.
[20] McGranaghan P,Düngen H D,Saxena A,et al.Incremental prognostic value of a novel metabolite-based biomarker score in congestive heart failure patients[J].ESC Heart Failure,2020,7(5):3029-3039.
(收稿日期:2021-04-20) (本文編辑:张爽)

