孔隙结构对水稻土温室气体排放的影响①
孙钰翔,张广斌,房 焕,张中彬,廖超林,周 虎*
孔隙结构对水稻土温室气体排放的影响①
孙钰翔1,2,张广斌2,房 焕3,张中彬2,廖超林1*,周 虎2*
(1湖南农业大学资源环境学院,长沙 410128;2土壤与农业可持续发展国家重点实验室(中国科学院南京土壤研究所),南京 210008; 3河海大学农业工程学院,南京 210098)
土壤结构影响水分和气体的运动和土壤生物活动,进而影响稻田温室气体排放。为探明土壤结构对水稻生长过程中温室气体排放的影响,选取江苏宜兴的湖白土和江西进贤的红壤性水稻土进行盆栽试验。设置不搅动(NP)、搅动(PD)和搅动后掰土回填(RP)3个处理。应用X射线CT成像技术分析不同处理土壤孔隙结构,通过静态箱法测定水稻生长过程中的温室气体排放。结果显示,PD处理降低了土壤大孔隙度和孔隙连通性,而NP及RP处理的大孔隙较多且连通度高。湖白土PD处理的CH4排放量分别是NP处理的2.5倍和RP处理的14.6倍,相关分析表明湖白土CH4的排放与大孔隙度呈显著负相关,表明大孔隙度升高会降低CH4排放。红壤性水稻土NP处理的CH4排放最高,可能是由于NP处理≤30 μm的孔隙度最低,促进了CH4的排放;PD处理提高了N2O排放,相关分析表明N2O排放总量和直径30 ~ 1 000 μm孔隙呈显著负相关。两种土壤RP处理全球增温潜势(GWP)强度以及CH4总排放量均显著低于NP和PD处理。研究结果表明土壤孔隙结构的改变影响稻田温室气体的排放,通过改变耕作方式调节土壤结构可能是稻田CH4和N2O减排的途径之一。
孔隙结构;显微CT;甲烷;氧化亚氮;全球增温潜势
全球气候变暖是国际社会普遍关注的问题,大气中的CO2、CH4和N2O等温室气体的浓度增高是造成气候变暖的主要原因。其中,CH4和N2O气体对温室效应的贡献率分别达15% 和5%[1]。稻田是CH4和N2O的主要排放源之一[2],中国作为世界上最大的水稻生产国,每年稻田CH4的排放量占世界稻田CH4总排放量的18%[3],N2O的排放量占农田总排放的7.0% ~ 11.0%[4]。因此,研究稻田CH4和N2O的排放规律,对于控制和降低农业生产中温室气体的排放,进而缓解温室效应有着重要的意义。
土壤孔隙结构在温室气体产生、运输和释放过程中起着重要作用[5-6]。土壤孔隙的数量、大小和形态等直接影响土壤中水分和气体的运动、土壤氧化还原电位以及土壤微生物的活动,进而影响CH4和N2O的产生与排放[7-8]。Regina等[9]指出土壤中的大孔隙(≥30 μm)越多或者微孔隙(≤2 μm)越少,年均CH4氧化速率越高。Mangalassery等[10]研究表明在沙壤土和黏壤土中土壤孔隙特征(例如总孔隙度和孔径)显著影响土壤中CH4的排放,但对N2O的排放没有影响。而Rochette等[11]认为土壤的孔隙度增加会对重黏土的N2O排放通量造成影响。
对于稻田土壤,耕作、打浆等土壤管理措施会破坏土壤的孔隙结构,改变土壤中微生物生境,从而直接或间接地影响稻田的CH4和N2O产生和扩散[12]。有研究指出减少对土壤的扰动,保护土壤结构,能够降低土壤CH4的排放[13],但是对N2O排放的影响结论不一[13-15]。以往的研究主要通过表观的测定来衡量耕作方式的改变对CH4和N2O排放的影响,但是土壤孔隙结构与温室气体排放的关系并不明确。本研究通过盆栽试验,模拟不同耕作方式下不同土壤孔隙结构,进而研究不同水稻土孔隙结构下CH4和N2O排放规律,为采取合理的稻田土壤管理措施、减少温室气体排放提供理论依据。
1 材料与方法
1.1 供试材料
供试水稻土为湖白土和红壤性水稻土。湖白土采自中国科学院常熟农业生态实验站宜兴基地(119°54′E、31°16′N),红壤性水稻土采自位于江西省进贤县的江西省红壤研究所实验地(116°20′E、28°15′N),样品均为耕层土壤(0 ~ 20 cm)。土壤样品在室温下风干,挑去根系后过5 mm筛备用。供试土壤的基本性质见表1。供试水稻品种为IR64,属于籼型常规水稻。

表1 供试土壤的基本性质
1.2 试验设计
采用PVC管(内径19.5 cm,高度40 cm)填装土柱。设置3个处理,分别为不搅动(NP)、搅动(PD)和搅动后掰土回填(RP),创造出不同孔隙结构。每个处理设置6个重复。其中,NP处理将过5 mm筛的风干土分层填装到土柱中,填装高度为30 cm,容重为1.1 g/cm3。PD处理将土壤样品填装到土柱中,填装方法与NP处理相同,然后加水饱和,浸泡48 h后用搅拌器(JB-1000型大功率搅拌器)搅动10 min(转速为500 r/min)。RP处理将土壤样品先填装于15 L的铁桶中,填装、饱和及搅拌同PD处理一致,然后排水,待土壤落干时,掰成<5 mm的土块,回填到土柱中,容重为1.1 g/cm3。
盆栽试验在中国科学院南京土壤研究所温室内进行。将水稻种子放置于培养皿中,保持湿润状态,在培养箱中(35 ℃)催芽2 d。选取出芽接近的种子进行直播(置于土壤表层),每个土柱播5颗种子,待水稻出苗后间苗,保留两株长势接近的植株。水稻出苗后土柱保持淹水(2 cm),每天浇水,保持各个处理淹水高度一致。水稻分蘖初期(种植35 d)施入分蘖肥(施用尿素3 kg/hm2),水稻分蘖后期(种植48 d)进行排水5 ~ 7 d,种植77 d后将地上部收获。
1.3 N2O和CH4的采集和测定
在水稻生长过程中采用静态箱-气相色谱法测定温室气体排放通量。采气箱为直径35 cm、高50 cm的PVC材质圆柱体(图1)。为了方便采气,每个土柱上配一个底座以供在收集气体时使气箱保持水封(图1)。在水稻的生育期内每7 d采集一次气体样品。采集时间为早上8:50—11:30,在罩箱后的0、12、24和36 min共取4次气样。静态箱密闭后用两通针将气体导入18 ml真空玻璃瓶中,每次采集时间不少于20 s,保证气体样品足量。采集气样的同时记录气箱温度。样品CH4和N2O浓度用带氢火焰离子化检测器(FID)和63Ni电子捕获检测器(ECD)的安捷伦气相色谱(Agilent 7890B)测定。根据4次样品中气体浓度的差值,通过线性拟合计算浓度增长斜率,根据以下公式计算气体排放通量[15]。
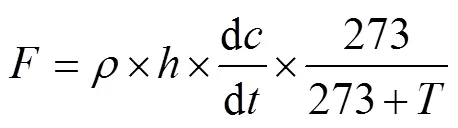
式中,为气体排放通量(单位:CH4为mg/(m2·h),N2O为μg/(m2·h)),为标准状态下气体的密度(CH4为0.714 kg/m3,N2O为1.25 kg/m3),是采样箱的净高度(m),d/d为单位时间内采样箱内气体的浓度变化率,为采样过程中采样箱内的平均温度(°C)。
温室气体全球增温潜势(GWP)按下式计算[2]。
GWP = CH4排放量×25+N2O排放量×298(2)
1.4 CT扫描与图像处理
在水稻种植前,用PVC环刀(直径3 cm,高度3 cm)采集表层土样。每个处理随机挑选3个土柱,每个土柱采集3个重复。利用X射线显微CT (NanotomS,GE,Sensing and Inspection Technologies,GmbH,Wunstorf,德国)扫描土柱。电压设置为90 kV,电流90 μA,曝光时间1.25 s,空间分辨率为0.016 mm。土柱固定于样品台上,从0到360° 匀速旋转,在此过程中采集1 000幅投影图像。利用Datosx2/Rec软件进行图像重建,之后利用VG Studio Max2.2软件生成2 302张8位灰度图像。利用ImageJ软件进行图像处理和分析。选择三维图像中部的直径和高度为1 800体元(28.8 mm)的圆柱区域作为感兴趣区域(region of interest, ROI),ROI实际大小为651 mm2× 28.8 mm。利用目视法进行图像二值化,然后利用BoneJ插件的Volume Fraction计算孔隙度,利用Thickness插件计算孔隙大小分布。将二值化图像导入Matlab中,根据公式(3)计算孔隙连通度[16]。
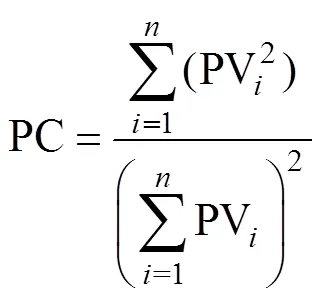
式中:PC为土壤孔隙连通度(其区间为0 ~ 1,当PC=1时表明孔隙都属于同一孔隙;当PC=0时则表明孔隙分散,互不相通),PV为孔隙体积,为孔隙数量。
1.5 数据处理与统计分析
利用SPSS 25对数据进行统计分析。处理之间参数显著性差异采用单因素方差分析(One-way ANOVA),应用最小差异显著法(LSD)进行多重比较,显著水平为<0.05。相关分析采用皮尔森(Pearson)双侧检验法。
2 结果
2.1 两种土壤不同处理的土壤孔隙结构
图2为不同处理土壤的二值图像(ROI区域内黑色部分代表土壤基质,白色部分代表孔隙)。与NP处理相比,PD处理孔隙减少,主要为圆形孔隙且连通性较差。而RP处理和NP处理没有差异。同湖白土相比,红壤性水稻土的PD处理大孔隙更少。
通过对CT图像的定量分析,可以得到图像分辨率范围内的大孔隙信息(表2)。湖白土的NP和RP处理之间的大孔隙度差异不显著,但均显著高于PD处理(<0.05)。红壤性水稻土大孔隙度各处理间为NP>RP>PD。两种土壤PD处理的孔隙连通度均显著低于其他处理(<0.05),说明搅动降低了大孔隙度及其连通性。湖白土NP处理直径≤30 μm、30 ~ 100 μm和100 ~ 500 μm孔隙的孔隙度均显著高于PD和RP处理(<0.05);RP处理直径500 ~ 1 000 μm孔隙的孔隙度显著高于NP和PD处理(<0.05)。对于红壤性水稻土,NP处理直径100 ~ 500 μm和≥1 000 μm孔隙的孔隙度显著高于RP和PD处理;RP处理直径500 ~ 1 000 μm孔隙的孔隙度显著高于NP和PD处理(<0.05)。
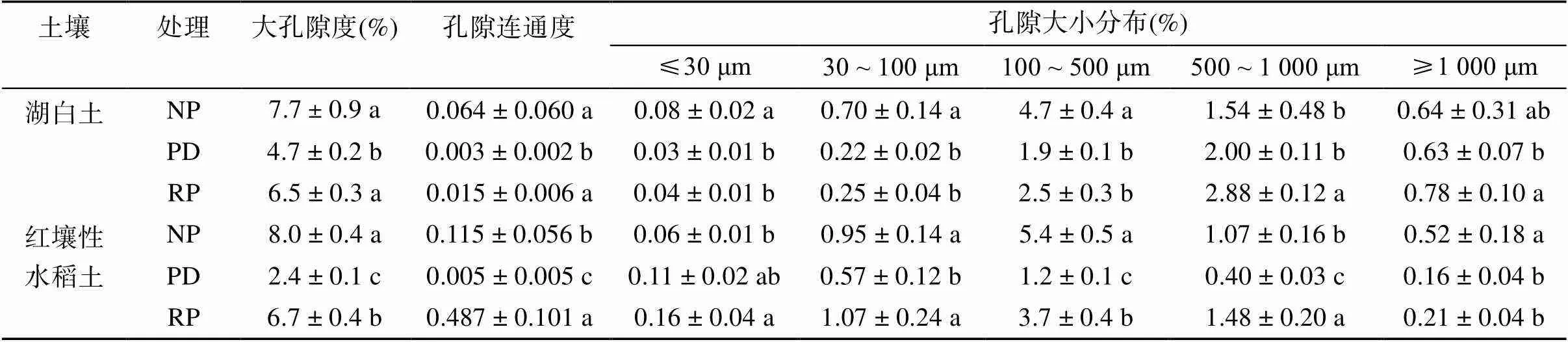
表2 不同处理土壤大孔隙度、孔隙连通度及孔隙大小分布
注:NP:不搅拌处理,PD:搅拌处理,RP:搅拌后掰土回填处理;同列小写字母不同表示同一土壤不同处理间差异显著(<0.05),下表同。
2.2 两种土壤不同处理的CH4排放通量
水稻生长期的CH4排放通量如图3。水稻播种后1 ~ 14 d(幼苗期)的CH4排放量较低,两种土壤各处理间均没有显著差异(>0.05)。56 ~ 77 d(排水期后重新淹水)的CH4排放量同样较低,红壤性水稻土各处理间没有显著差异,但是湖白土PD处理的排放量显著高于NP和RP处理(<0.05)。CH4排放主要集中在水稻生长的15 ~ 55 d(分蘖期到排水期),占整个观测期间排放量的 88.5% ~ 99.6%。湖白土NP、PD和RP处理均在培育第48 天(排水后第一次采样)CH4排放出现峰值,分别为4.83、6.93、0.56 mg/(m2·h)。15 ~ 48 d CH4排放通量表现为PD>(NP>RP);49 ~ 55 d为PD>(NP、RP)。红壤性水稻土CH4排放通量显著高于湖白土处理(<0.05),其15 ~ 55 d内趋势为(NP、PD)>RP。
两种土壤不同处理的CH4平均排放通量和总排放量见表3,相同处理下红壤性水稻土均显著高于湖白土(<0.05)。湖白土PD处理CH4平均排放通量和总排放量均显著高于NP处理,RP处理显著低于其他处理(<0.05);PD处理CH4的总排放量分别是NP和RP处理的2.5倍和14.6倍。而红壤性水稻土NP和PD处理间CH4平均排放通量和总排放量没有显著差异,均显著高于RP处理(<0.05);NP和PD处理的CH4总排放量分别是RP处理的17.4倍和13.7倍。
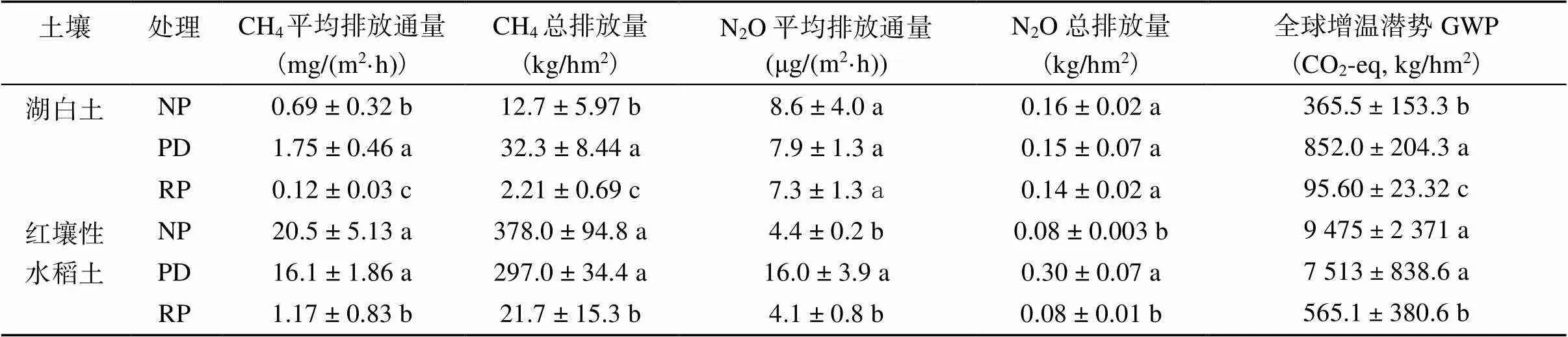
表3 不同处理水稻土CH4和N2O的平均排放通量和总排放量及全球增温潜势
2.3 两种土壤不同处理的N2O排放通量
N2O的排放峰不规则且变异性大(图4)。在种植后1 ~ 7 d各处理出现峰值,之后保持淹水状态时各处理的N2O排放较低。35 d施入肥料(尿素)后红壤性水稻土各处理均出现了一个短暂的峰值。排水后到复水(48 ~ 55 d)期间湖白土各处理的N2O排放量大,复水后(56 ~ 77 d)各处理N2O排放维持在较低水平。
湖白土各处理间N2O平均排放通量和总排放量均没有显著差异(表3)(<0.05),而红壤性水稻土PD处理则显著高于NP和RP处理(<0.05)(表3)。红壤性水稻土NP处理的N2O平均排放通量和总排放量均是湖白土NP处理的50%,而湖白土PD处理的N2O平均排放通量和总排放量均是红壤性水稻土PD处理的49%。
2.4 两种土壤不同处理的全球增温潜势
由表3可见,观测期内湖白土排放的CH4和N2O所产生的全球增温潜势(GWP)以PD处理的最高,为CO2-eq 852kg/hm2;红壤性水稻土NP处理最高,为CO2-eq 9 475 kg/hm2。不同处理的GWP大小同CH4总排放量顺序相同,湖白土为PD>NP>RP,红壤性水稻土为NP>PD>RP。由于种植期的N2O排放相对较少,因此CH4对全球增温潜势影响最大,占比为50.7% ~ 99.8%。在两种土壤上,RP处理的CH4和N2O排放总量及其全球增温潜势均为最低。
2.5 土壤孔隙结构与温室气体排放的关系
相关分析表明(表4),湖白土各处理的CH4排放总量与大孔隙度和500 ~ 1 000 μm孔隙显著负相关(<0.05);N2O排放总量与孔隙连通度和≤30 μm孔隙显著正相关(<0.05)。红壤性水稻土CH4排放总量与孔隙连通度和≤30 μm孔隙均呈极显著负相关(<0.01),与500 ~ 1 000 μm孔隙呈显著负相关(<0.05);N2O排放总量与大孔隙度、100 ~ 500 μm和500 ~ 1 000 μm孔隙呈极显著负相关(<0.01),与30 ~ 100 μm孔隙呈显著负相关(<0.05)。
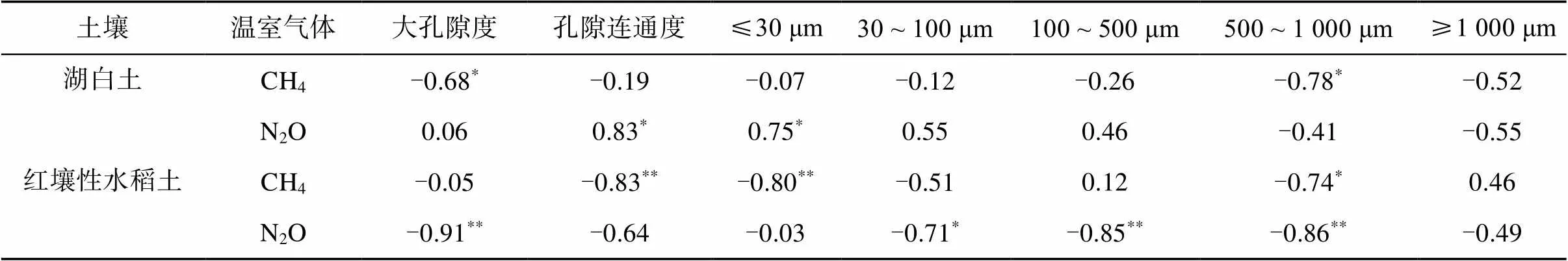
表4 孔隙连通度及孔隙大小分布与CH4和N2O总排放量的相关性
注:** 表示相关性达<0.01显著水平,* 表示相关性达<0.05显著水平。
3 讨论
稻田CH4和N2O的排放在水稻生长季内总体呈现不同的规律。本研究中水稻生长过程中CH4排放集中在水稻培育的15 ~ 55 d,约占整个生育季排放量的88.5% ~ 99.6%(图3)。该阶段稻田长期处于淹水状态,水层限制了空气和土壤中孔隙的气体交流,从而导致大气中的氧气难以进入土壤,造成土壤中形成缺氧的环境。厌氧环境为产甲烷古菌合成CH4创造了有利条件。同时厌氧环境减少了甲烷排放过程中甲烷氧化菌的氧化,因此CH4排放量高[17]。而本研究中N2O的排放峰不规则且变异性大(图4),这可能是因为土壤中产生的N2O很快消散到大气中而在土壤中没有明显的停留时间,具有较大的不确定性[18]。在排水后到复水期(48 ~ 55 d)湖白土各处理的N2O大量排放,这是因为干湿交替过程促进了N2O排放[19-20]。
土壤孔隙结构是土壤中水分和气体运动的通道和土壤微生物的生境,孔隙结构的改变可能影响土壤温室气体的产生与排放[5-8]。本研究通过模拟试验形成3种土壤孔隙结构。其中,PD处理破坏了大团聚体和大孔隙结构,形成了孤立的球形孔隙,显著降低了土壤的大孔隙度和孔隙连通度(表2),与李奕等[21]和Fang等[22]研究结果一致。NP处理由于土壤扰动少,保护了土壤团聚体和大孔隙结构,而RP处理搅动后掰土回填过程中形成了新的大孔隙,因此这两个处理的大孔隙度和孔隙连通性在两种土壤中均较高。不同扰动处理对红壤性水稻土和湖白土孔隙结构的影响存在差异,这可能是由土壤质地的差异造成的。
CH4排放与大孔隙度呈显著负相关(表4),说明土壤中的大孔隙度增加会降低CH4排放。湖白土PD处理大孔隙度显著低于其他处理(表2),土壤大孔隙的减小有利于厌氧环境的形成,促进土壤中CH4产生[10],因而PD处理的CH4总排放显著高于其他处理(<0.05)(表3)。另一方面,由于气体在大孔隙中扩散更快,土壤大孔隙度的增加使土壤中好氧微生物可利用更多的氧气作用于有机物,从而减少CH4的排放[7-9]。土壤大孔隙增加的同时也会增加土壤的孔隙连通度,土壤的孔隙连通度的增加也会改善土壤中通气性,因而抑制产甲烷古菌[23]。本研究中RP处理的孔隙连通度均显著高于PD处理,相关性分析也表明CH4排放与孔隙连通度呈极显著负相关(表4)。各处理中RP处理CH4总排放量显著低于NP和PD处理(<0.05)(表3),说明RP处理能够通过增加孔隙度和孔隙连通度降低CH4的排放。
与CH4不同,N2O排放在两种土壤中和土壤孔隙之间关系存在差异。红壤性水稻土PD处理N2O总排放量显著高于其他处理(表3),这可能是因为土壤搅动破坏了大孔隙和大团聚体,降低孔隙度形成缺氧环境,同时暴露了更多土壤有机物,造成较高的反硝化速率及时长,促进N2O的产生和排放[24-26]。而湖白土PD处理N2O排放并没有显著增加,可能是因为湖白土PD处理大孔隙度(4.7%)高于红壤性水稻土处理(2.4%),且与其他处理间的差异相对较小。此外,两种土壤质地存在较大差异,可能是造成N2O排放呈现不同规律的另一个原因[27-28]。Ball[7]指出通过增加土壤孔隙度,或许可以减少N2O排放,原因是随着孔隙的增大,能更多地运输氧气,水气条件能更好地满足好氧微生物生长[28],从而抑制了土壤中的硝化和反硝化作用,使得N2O排放降低。本研究中红壤性水稻土N2O排放总量与大孔隙度呈显著负相关(表4)也证实这一点。Kravchenko 等[29]研究也指出N2O排放和30 ~ 120 μm的孔隙度呈显著负相关,我们研究发现的N2O排放总量与直径30 ~ 100 μm的孔隙度呈显著负相关(表4)的结果与此一致。但是,本研究中湖白土并未呈现明显的规律,说明土壤结构对N2O排放的影响很复杂,需要针对具体的土壤进行深入分析。
由于水稻种植期常处于淹水状态,N2O排放相对较少,因此CH4对全球增温潜势影响最大,CH4对全球增温潜势贡献占比为50.7% ~ 99.8%。本研究中RP处理的全球增温潜势显著低于其他处理(表3),可能是因为RP处理显著增加了500 ~ 1 000 μm的孔隙(表2),抑制了土壤中CH4的排放,相关分析也表明两种水稻土500 ~ 1 000 μm的孔隙度和CH4总排放量均呈显著负相关。本研究证实,土壤孔隙结构发生变化会影响温室气体排放,土壤孔隙连通度和孔隙大小分布是影响土壤温室气体排放的重要因素之一。通过增大土壤大孔隙度是减缓温室气体排放的可能途径。今后需要深入研究土壤孔隙结构的改变影响温室气体排放的内在机制,为调控土壤结构进而减少温室气体排放提供理论依据。
4 结论
稻田土壤经搅动后大孔隙度和孔隙连通性降低,而重新填装处理的大孔隙较多且连通性高。湖白土搅拌处理促进了CH4排放,而红壤性水稻土搅拌处理则显著增加了N2O排放。两种水稻土重新填装处理的CH4和N2O排放和全球增温潜势(GWP)均是最低。湖白土CH4排放同土壤大孔隙度显著负相关,而红壤性水稻土N2O排放和大孔隙度显著负相关。结果表明土壤孔隙结构同水稻土温室气体排放具有密切关系,但是在不同土壤中呈现规律并不一致,内在机制需要进一步研究。
[1] Guo J P, Zhou C D. Greenhouse gas emissions and mitigation measures in Chinese agroecosystems[J]. Agricultural and Forest Meteorology, 2007, 142(2/3/4): 270–277.
[2] IPCC. Climate change 2013: The physical science basis. Contribution of working group I to the fifth assessment report of the intergovernmental panel on climate change[R]. Cambridge: Cambridge University Press, 2013.
[3] Zhang G B, Ma J, Yang Y T, et al. Variations of stable carbon isotopes of CH4emission from three typical rice fields in China[J]. Pedosphere, 2017, 27(1): 52–64.
[4] Zou J W, Huang Y, Zheng X H, et al. Quantifying direct N2O emissions in paddy fields during rice growing season in mainland China: Dependence on water regime[J]. Atmospheric Environment, 2007, 41(37): 8030–8042.
[5] Babujia L C, Hungria M, Franchini J C, et al. Microbial biomass and activity at various soil depths in a Brazilian oxisol after two decades of no-tillage and conventional tillage[J]. Soil Biology and Biochemistry, 2010, 42(12): 2174–2181.
[6] López-Garrido R, Deurer M, Madejón E, et al. Tillage influence on biophysical soil properties: The example of a long-term tillage experiment under Mediterranean rainfed conditions in South Spain[J]. Soil and Tillage Research, 2012, 118: 52–60.
[7] Ball B C. Soil structure and greenhouse gas emissions: A synthesis of 20 years of experimentation[J]. European Journal of Soil Science, 2013, 64(3): 357–373.
[8] Skiba U, Ball B. The effect of soil texture and soil drainage on emissions of nitric oxide and nitrous oxide[J]. Soil Use and Management, 2002, 18(1): 56–60.
[9] Regina K, Pihlatie M, Esala M, et al. Methane fluxes on boreal arable soils[J]. Agriculture, Ecosystems & Environment, 2007, 119(3/4): 346–352.
[10] Mangalassery S, Sjögersten S, Sparkes D L, et al. The effect of soil aggregate size on pore structure and its consequence on emission of greenhouse gases[J]. Soil and Tillage Research, 2013, 132: 39–46.
[11] Rochette P, Angers D A, Chantigny M H, et al. Nitrous oxide emissions respond differently to No-till in a loam and a heavy clay soil[J]. Soil Science Society of America Journal, 2008, 72(5): 1363–1369.
[12] Zheng X H, Han S H, Huang Y, et al. Re-quantifying the emission factors based on field measurements and estimating the direct N2O emission from Chinese croplands[J]. Global Biogeochemical Cycles, 2004, 18(2): 1–19.
[13] 白小琳, 张海林, 陈阜, 等. 耕作措施对双季稻田CH4与N2O排放的影响[J]. 农业工程学报, 2010, 26(1): 282–289.
[14] Yao Z S, Zhou Z X, Zheng X H, et al. Effects of organic matter incorporation on nitrous oxide emissions from rice-wheat rotation ecosystems in China[J]. Plant and Soil, 2010, 327(1/2): 315–330.
[15] 蔡祖聪, 徐华, 马静. 稻田生态系统CH4和N2O排放[M].合肥: 中国科学技术大学出版社, 2009.
[16] Bottinelli N, Zhou H, Capowiez Y, et al. Erratum to: Earthworm burrowing activity of two non-Lumbricidae earthworm species incubated in soils with contrasting organic carbon content (Vertisol vs. Ultisol)[J]. Biology and Fertility of Soils, 2018, 54(1): 173.
[17] Wang M X, Li J. CH4emission and oxidation in Chinese rice paddies[J]. Nutrient Cycling in Agroecosystems, 2002, 64(1/2): 43–55.
[18] Chapuis-Lardy L, Wrage N, Metay A, et al. Soils, a sink for N2O? A review[J]. Global Change Biology, 2007, 13(1): 1–17.
[19] 梁国庆, 周卫, 夏文建, 等. 优化施氮下稻-麦轮作体系土壤N2O排放研究[J]. 植物营养与肥料学报, 2010, 16(2): 304–311.
[20] 潘晓健, 刘平丽, 李露, 等. 氮肥和秸秆施用对稻麦轮作体系下土壤剖面N2O时空分布的影响[J]. 土壤学报, 2015, 52(2): 364–371.
[21] 李奕, 房焕, 彭显龙, 等. 模拟搅浆对水稻土结构和有机氮矿化的影响[J]. 土壤学报, 2019, 56(5): 1171–1179.
[22] Fang H, Rong H, Hallett P D, et al. Impact of soil puddling intensity on the root system architecture of rice (L.) seedlings[J]. Soil and Tillage Research, 2019, 193: 1–7.
[23] Brewer P E, Calderón F, Vigil M, et al. Impacts of moisture, soil respiration, and agricultural practices on methanogenesis in upland soils as measured with stable isotope pool dilution[J]. Soil Biology and Biochemistry, 2018, 127: 239–251.
[24] Žurovec O, Sitaula B K, Čustović H, et al. Effects of tillage practice on soil structure, N2O emissions and economics in cereal production under current socio-economic conditions in central Bosnia and Herzegovina[J]. PLoS One, 2017, 12(11): e0187681. DOI:10.1371/journal.pone.0187681.
[25] Abdalla M, Osborne B, Lanigan G, et al. Conservation tillage systems: a review of its consequences for greenhouse gas emissions[J]. Soil Use and Management, 2013, 29(2): 199–209.
[26] van der Weerden T J, Kelliher F M, de Klein C A M. Influence of pore size distribution and soil water content on nitrous oxide emissions[J]. Soil Research, 2012, 50(2): 125.
[27] Keiluweit M, Gee K, Denney A, et al. Anoxic microsites in upland soils dominantly controlled by clay content[J]. Soil Biology and Biochemistry, 2018, 118: 42–50.
[28] Kravchenko A N, Toosi E R, Guber A K, et al. Hotspots of soil N2O emission enhanced through water absorption by plant residue[J]. Nature Geoscience, 2017, 10(7): 496–500.
[29] Kravchenko A N, Guber A K, Quigley M Y, et al. X-ray computed tomography to predict soil N2O production via bacterial denitrification and N2O emission in contrasting bioenergy cropping systems[J]. GCB Bioenergy, 2018, 10(11): 894–909.
Effects of Pore Structure on Greenhouse Gas Emission of Paddy Soils
SUN Yuxiang1,2, ZHANG Guangbin2,FANG Huan3,ZHANG Zhongbin2,LIAO Chaolin1*, ZHOU Hu2*
(1 College of Resources and Environment, Hunan Agricultural University, Changsha 410128, China; 2 State Key Laboratory of Soil and Sustainable Agriculture, Institute of Soil Science, Chinese Academy of Sciences, Nanjing 210008; 3 College of Agricultural Engineering, Hohai University, Nanjing 210098)
Soil structure affects soil water and gas transportand soil biological activities, thus influence greenhouse gas (GHG) emission from soil. In this study, incubation experiment was conducted in two paddy soils (whitish paddy soil and red paddy soil) to study the effects of pore structures on GHG emissions under different treatments, i.e. non-puddling (NP), puddling (PD), and repacked after puddling (RP). Soil pore structure was determined by using the X-ray computed tomography and image analysis, and GHG emissions during rice growth period were measured by the static box method. The results showed that puddling significantly decreased soil macroporosity and pore connectivity, while NP and RP had more large pores with higher connectivity for both soils. PD promoted CH4emission from whitish paddy soil, which was 2.5 and 14.6 times of NP and RP, respectively. Correlation analysis showed CH4emission negatively correlated with macroporosity, indicating the increase of large porosity will reduce CH4emissions. NP had the highest CH4emission from red paddy soil, possibly due to the lowest porosity of ≤30 μm pores promoting CH4emission. NP significantly increased N2O emissions from red paddy soil, which was negatively correlated with the 30-1 000 μm pores. The global warming potential (GWP) of RP for both soils was significantly lower than other treatments. In conclusion, this study confirms that the change in soil pore structure greatly affected GHG emissions and maintaining a porous soil structure can reduce CH4emission and global warming potential.
Pore structure; Micro CT; CH4; N2O; GWP
S152
A
10.13758/j.cnki.tr.2021.01.021
孙钰翔, 张广斌, 房焕, 等. 孔隙结构对水稻土温室气体排放的影响. 土壤, 2021, 53(1): 154–160.
国家自然科学基金项目(41877022)和国家重点研发计划项目(2016YFD0300906)资助。
(clliao@163.cm; zhouhu@issas.ac.cn)
孙钰翔(1995—),男,湖南益阳人,硕士研究生,主要从事土壤物理结构与农田温室气体排放机理研究。E-mail: yxsun16@163.com

