ERAS 理念在肝癌手术患者中的应用研究
陈红健,张素青
(南通大学附属肿瘤医院肝胆胰外科,江苏南通 226361)
腹腔镜肝切除术是治疗肝癌的有效方式,通过切除病灶,并保留足够功能的肝组织,以改善患者临床症状,延长患者生存期[1]。但仍有部分患者经腹腔镜手术治疗后出现腹腔出血、胸腔积液等并发症,威胁患者术后安全。因此降低肝癌手术患者并发症风险对促进患者术后恢复具有积极意义。 加速康复外科(enhanced recovery after surgery,ERAS) 理念是指在术前、 术中及术后采取一系列循证医学证据的优化措施,以减轻患者围术期的身体、心理应激,起到促进患者康复、降低并发症风险的作用[2]。 鉴于此,该研究选择2017 年1 月—2020 年11 月该院收治的106 例肝癌患者为对象,着重分析ERAS 理念在肝癌手术患者中的应用效果。 报道如下。
1 资料与方法
1.1 一般资料
选择该院收治的106 例肝癌患者为研究对象。(1)纳入标准:①符合肝癌相关诊断标准[3];②肝功能Child-Pugh[4]分级为B 级、A 级。 ③肿瘤最大直径≤10 cm;④无静脉癌栓、无肝内及其他远处器官转移;⑤患者均在该院接受腹腔镜肝癌切除术治疗。 (2)排除标准:①既往合并胃肠道恶性肿瘤者;②联合脾切除或肠切除者;③预计生存期<3 个月者;④术中中转开腹手术者。 该研究经医学伦理委员会批准。
将患者按随机数字表法分为两组,每组53 例。观察组中男42 例,女11 例;肿瘤直径3~8 cm,平均直径(5.40±0.75)cm;年龄43~74 岁,平均年龄(58.50±5.07)岁;肿瘤位置:左叶42 例,右叶11 例。 对照组中男43 例, 女10 例; 肿瘤直径2~9 cm, 平均直径(5.50±0.74)cm; 年龄44~75 岁, 平均年龄 (59.50±5.01)岁;肿瘤位置:左叶41 例,右叶12 例。 两组患者一般资料比较,差异无统计学意义(P>0.05),有可对比性。
1.2 方法
对照组采用常规干预。术前常规8 h 禁水、禁食,留置导尿管及胃肠减压;术中毛毯保温;术后阿片类药物自控镇痛,禁食禁饮24 h,肛门排气后拔出胃管,试饮食;术后第3 天停止导尿,鼓励患者下床活动。
观察组采取ERAS 理念干预, 具体如下。 (1)术前,待患者入院后,进行呼吸功能评估,并采取吹气球、深呼吸等方式开展呼吸肌训练,并指导患者进行床上排便锻炼;术前6~8 h,指导患者口服肠内营养液500 mL,术前2 h 口服10%葡萄糖250 mL,并进行术前预防性镇痛。(2)术中,对患者双下肢使用弹力袜及间歇充气加压泵,促进下肢静脉血液回流;采用保温毯、温水冲洗腹腔、输液预加热等方式,使患者术中体温保持在36~37℃;控制性输液,输液速度维持在4~6 mL/(kg·h);不常规留置引流管,切口及穿刺口给予盐酸罗哌卡因注射液 (Aspen Pharmacare Australia Pty Ltd,规格:10 mL:75 mg,国药准字H20140764)浸润麻醉。(3)术后给予患者硬膜外自控镇痛,密切观察患者生命体征变化,如患者有胃管、尿管则于术后12 h内拔除,腹腔引流管则于术后24~48 h 内复查床旁腹腔彩超排除胆漏、出血等并发症后,尽早拔除;术后6 h 辅助患者取半卧位,术后12 h 内行床上锻炼,并依据患者恢复情况,逐步增加活动量,术后1 d 即下床活动,依据患者情况,制定相应活动量,并逐步增加活动时间及次数;待患者麻醉清醒、生命体征稳定后,即给予5~10 mL 温开水湿润口腔,1 h/次; 术后第1 天尝试低脂流质饮食并每天咀嚼口香糖3 次,术后2 d根据患者恢复情况,增加饮食直至恢复至普食。
两组均连续干预2 周。
1.3 评价指标
(1)术中指标:记录患者手术时间、术中出血量。
(2)术后康复指标:记录患者首次排气、首次排便、首次下床活动时间。
(3)术后恢复质量及日常生活自理能力评分:于患者出院前,使用15 项恢复质量(15-item quality of recov ery questionnaire,QOR-15)[5]、Barthel 指数(Barthel index, BI)[6]量表评估患者恢复质量及生活自理能力。 其中QOR 共计15 个条目,其中1~10 为正向条目,每个条目0~10 分,11~15 为负向条目,每个条目10~0 分,总分为150 分, 分数越高表示术后恢复质量越高;BI包括进食、洗澡、修饰等10 个条目,总分为100 分,分数越高表示自理能力越好。
(4)记录患者住院期间并发症发生情况。
1.4 统计方法
采用SPSS 25.0 统计学软件进行数据分析,计量资料采用(±s)表示,两组间比较采用独立样本t 检验;计数资料用率(%)表示,采用χ2检验。 检验水准α=0.05,以P<0.05 为差异有统计学意义。
2 结 果
2.1 比较两组术中指标
两组的手术时间、术中出血量比较,组间差异无统计学意义(P>0.05)。 见表1。
表1 两组术中指标比较(±s)
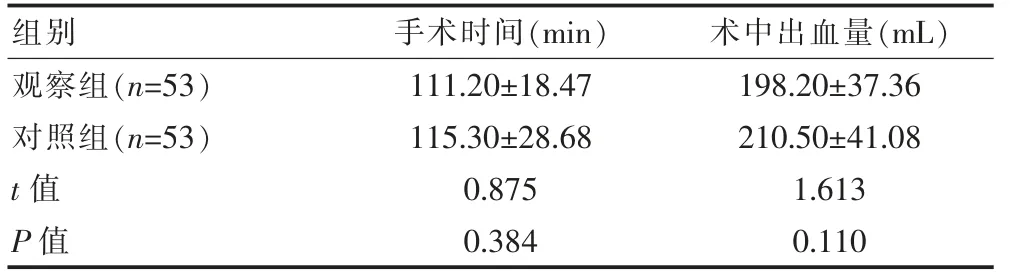
表1 两组术中指标比较(±s)
组别手术时间(min) 术中出血量(mL)观察组(n=53)对照组(n=53)t 值P 值111.20±18.47 115.30±28.68 0.875 0.384 198.20±37.36 210.50±41.08 1.613 0.110
2.2 比较两组术后康复指标
观察组的首次排气、首次排便、首次下床活动时间均短于对照组,组间差异有统计学意义(P<0.05)。见表2。
表2 两组术后康复指标比较[(±s),h]
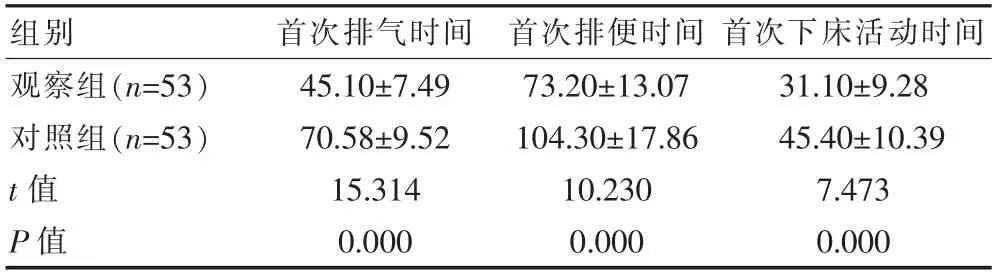
表2 两组术后康复指标比较[(±s),h]
组别首次排气时间首次排便时间 首次下床活动时间观察组(n=53)对照组(n=53)t 值P 值45.10±7.49 70.58±9.52 15.314 0.000 73.20±13.07 104.30±17.86 10.230 0.000 31.10±9.28 45.40±10.39 7.473 0.000
2.3 比较两组术后恢复质量及日常生活自理能力
出院时, 观察组的QOR-15、BI 评分均高于对照组,组间差异有统计学意义(P<0.05)。 见表3。
表3 两组术后恢复质量及日常生活自理能力评分比较[(±s),分]
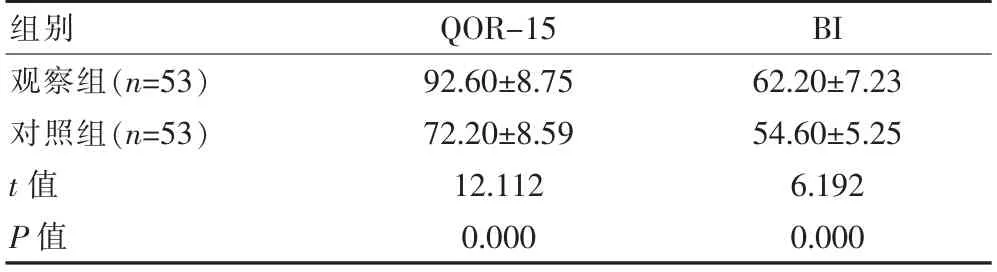
表3 两组术后恢复质量及日常生活自理能力评分比较[(±s),分]
组别QOR-15 BI观察组(n=53)对照组(n=53)t 值P 值92.60±8.75 72.20±8.59 12.112 0.000 62.20±7.23 54.60±5.25 6.192 0.000
2.4 比较两组并发症发生率
住院期间, 观察组的并发症发生率为3.77%(2/53),其中1 例肺部感染,1 例术后腹腔出血;对照组的并发症发生率为18.87%(10/53),其中,4 例肺部感染,3 例下肢肌间静脉血栓,3 例术后腹腔出血, 观察组的并发症发生率低于对照组, 差异有统计学意义(χ2=6.014,P=0.014)。
3 讨 论
肝癌主要从肝炎、肝硬化发展而来,腹腔镜肝切除术虽可通过切除病灶提高患者生存质量,但术后面临残余肝脏代偿及恢复问题,导致患者术后康复周期较长,引发多种并发症,威胁患者生命健康[7]。因此,肝癌患者术后需配合有效的干预措施,促进患者康复。
该研究结果显示,观察组首次排气、排便及下床活动时间均短于对照组(P<0.05),表明ERAS 理念能够有效促进患者术后康复,缩短康复时间。 分析其原因在于,术前灌肠、胃肠减压等操作不仅增加患者疼痛,还会导致肠道菌群移位,水电解质紊乱,不利于患者术后胃肠功能恢复。 而ERAS 理念于患者术前2 h口服葡萄糖溶液,不仅可减轻患者饥渴感,增加肝糖原储备,减少术后胰岛素抵抗风险,同时可促进患者术后胃肠功能恢复,缩短排气、排便时间。 ERAS 理念干预在术前即对患者展开心肺功能训练,在提升患者身体能力的同时,可减轻术前紧张、恐惧情绪,增加患者抗应激能力,利于患者术后康复[8]。 此外,ERAS 理念在术后6 h 即辅助患者展开创伤训练,有利于缩短患者下床活动时间。
该研究结果还显示,出院时,观察组的QOR-15、BI 评分均高于对照组,并发症发生率低于对照组(P<0.05), 表明ERAS 理念能够有效提升肝癌患者术后恢复质量及生活自理能力, 且可降低并发症发生风险。 分析其原因在于,ERAS 理念围绕术前、术中及术后, 并参照循证医学为患者制定一系列干预措施,可保证干预的有效性, 从而提高患者术后康复质量[9]。ERAS 理念通过术前心肺功能锻炼及术后早期下床活动,可有效改善患者通气功能,降低肺部并发症发生风险;术中采取保暖措施,有利于维持患者体温,减少苏醒时寒战、躁动及术后并发症风险。此外,术后早期经口进食, 可减轻患者因饥饿引起的应激反应,加快肠蠕动,增进患者食欲,促进患者体能恢复。 ERAS理念为患者制定术后早期活动计划,在促进患者身体机能恢复的同时, 还可使患者参与到康复过程中,从而提升患者自理能力。
综上所述,ERAS 理念能够缩短肝癌手术患者术后康复时间, 提高术后恢复质量及日常生活自理能力,降低并发症发生风险。

