枯草芽孢杆菌S-16产抗菌蛋白发酵条件优化及蛋白分离纯化
路妍 杨鑫 吴文庆 连紫倩 扈景晗 周洪友
摘要:以抑菌率为指标,采用单因素试验和响应面法对枯草芽孢杆菌S-16菌株产抗菌蛋白的发酵条件进行优化。结果表明,以可溶性淀粉为碳源,大豆蛋白胨为氮源,初始pH值为7.5的LB液体培养基,接种量为4.74%,在温度为34 ℃条件下振荡培养 53 h,转速为 200 r/min为菌株最佳发酵条件。在此条件下纯化得到的抗菌蛋白分子量约为35 ku,对向日葵核盘菌抑菌率达58.6%,比优化前提高了3.19倍。稳定性试验结果表明,抗菌蛋白0~80 ℃、pH值为2~10时均有抑菌活性,说明该蛋白具有很好的热稳定性和酸碱稳定性。
关键词:枯草芽孢杆菌;抗菌蛋白;核盘菌;响应面法;纯化;发酵条件优化
中图分类号: S432.4+4 文献标志码: A文章编号:1002-1302(2021)02-0063-08
收稿日期:2020-05-14
基金项目:内蒙古自然科学基金(编号:2017BS0303);内蒙古高等学校科学研究项目(编号:NJZY17069)
作者简介:路妍(1982—),女,内蒙古呼和浩特人,博士,讲师,从事植物真菌病害研究。E-mail:luyan820918@126.com。
通信作者:周洪友,博士,教授,从事植物病害生物防治研究。E-mail:hongyouzhou2002@aliyun.com。
向日葵菌核病是由核盘菌[Sclerotinia sclerotiorum (Lib.) de Bary]引起的真菌病害,是世界范围向日葵生产上危害重大并且具有毁灭性的病害之一[1-3]。向日葵核盘菌是一种兼性寄生菌,寄主范围广,侵染形式多样,带菌的种子和菌核为初侵染来源,可侵染向日葵的根、茎、叶、花盘等各个部位,造成植株局部或整体腐烂死亡,在我国发病最严重的是盘腐和根茎腐[4]。菌核病的有效控制包括使用以下1种或多种方法的组合:抗病品种、栽培控制和化学控制。种植抗病品种是控制土传病害最经济且有效的措施,但至今没有发现对菌核病免疫和高抗的向日葵材料[1,5]。目前对于该病害的防治主要依靠化学农药,然而杀菌剂的大量使用导致了潜在危害人类和环境的有毒化合物的积累,也导致了病原体耐药性的增强[6]。鉴于此,研究和应用生物防治是一种很有前途的方法。根际细菌是控制土传植物病原菌的优良药剂[7],细菌种类如芽孢杆菌、假单胞菌、沙雷氏菌和节杆菌等已被证明能控制真菌病害[8]。
枯草芽孢杆菌(Bacillus subtilis)是一种广泛存在于自然生态系统的非致病根际土壤细菌,具有发达的分泌系统、很强的环境适应能力和抗逆能力,具有促进植物生长和生物防治的双重功效。能够产生多种次生代谢产物,包括蛋白质[9]、脂肽类[10]和挥发性物质[11]等。这些物质通过抑制病原菌的生长,抑制孢子的萌发以及诱导激发植物自身的防御系统发挥抑菌作用[12]。抗菌蛋白是枯草芽孢杆菌分泌的主要活性物质,关于抗菌蛋白功能的研究也受到人们广泛关注。刘伊强等从枯草芽孢杆菌TG26中分离的抗菌蛋白对禾谷镰孢菌(Gibberella zeae)有较强的抑菌活性[13]。刘永峰等从枯草芽孢杆菌Bs-916中分离的抗菌蛋白对水稻纹枯病病菌(Rhizoctonia solani)和水稻恶苗病病菌(Fusarium moniliforme)具有较强的抑菌活性[14]。彭兵等从枯草芽孢杆菌菌株A发酵液中分离得到一种抗真菌活性蛋白FV,可抑制玉米小斑病病菌(Helminthosporium maydis)孢子萌发和附着胞形成,并影响菌丝细胞的形态结构[15]。研究表明,枯草芽孢杆菌及其分泌物对多种土传病害的田间防效显著。例如,Sha等在几个不同地点进行的2年田间试验中,使用枯草芽孢杆菌SYX04和SYX20可将水稻叶瘟病发病率降低73.5%~83.5%,穗瘟病发病率降低64.0%~85.6%[16]。马新等用枯草芽孢杆菌的微囊剂防治番茄立枯病,防效明显,可达到7276%。枯草芽孢杆菌B908(百抗)对水稻纹枯病的大田防效达70%以上[17]。陈延熙等研制的增产菌,其有效成分是枯草芽孢杆菌,在全国10多个省(市、区)50多种作物中使用增产率达10%~50%,主要用于防治水稻稻瘟病、小麦纹枯病、油菜菌核病等土传病害[18]。然而,由于抗菌蛋白是枯草芽孢杆菌的次级代谢产物,产量低,使其在生物防治中的应用受到很大限制[17]。
提高抗菌代谢物的产量对后续抗菌机制的研究和抗菌蛋白制剂的研制至关重要。因此,对发酵条件的优化是非常有必要的。响应面法已经成功应用于多种微生物培养条件的优化。王全等采用响应面法对解淀粉芽孢杆菌(Bacillus amyloliquefaciens)的发酵条件进行优化,优化后抗菌蛋白对棉花黄萎病菌(Verticillium dahliae Kleb.)的抑菌圈面积从优化前的171.95 mm2 提高至 320.3 mm2[19]。杨洁等采用响应面法将枯草芽孢杆菌E1R-j分泌的抗菌脂肽产量提高了2倍[20]。全鑫等利用响应面法优化全蚀病生防菌YB-81的发酵条件,优化后该菌株对全蚀病病菌的抑制率达到872%,较优化前提高了32.5%[21]。
本研究选用从向日葵根际土壤中分离得到的1株枯草芽孢杆菌菌株S-16。前期研究发现,该菌株的无菌培养滤液对向日葵核盘菌具有拮抗作用,而且大田防效明显。本研究利用单因素法和响应面法对菌株发酵产生抗菌蛋白的条件进行优化,旨在提高抗菌蛋白的产量,并在此条件下分离纯化抗菌蛋白,为后续生物农药的研发和应用提供理论基础。
1材料与方法
1.1试验材料
1.1.1供试菌种枯草芽孢杆菌(Bacillus subtilis)S-16和向日葵核盘菌(Sclerotinia sclerotiorum),均由内蒙古农业大学植物病理實验室提供。
1.1.2培养基LB基础培养基:5 g/L酵母粉,10 g/L 蛋白胨,10 g/L NaCl,pH值为7.0。
1.2试验方法
1.2.1种子液制备及其生长曲线绘制用灭菌牙签挑取枯草芽孢杆菌菌株S-16单菌落,接种于LB固体培养基上,在温度为28 ℃条件下活化培养24 h后备用。将活化培养好的单菌落接入LB液体培养基(6 mL/100 mL),置于37 ℃摇床培养,转速为 200 r/min。分别于0、12、24、36、48、72 h取样测定D600 nm,并绘制生长曲线以确定种子液的最佳接种时间。
1.2.2发酵上清液制备将培养好的种子液按6%(体积比)的接种量接入LB液体基础培养基(150 mL/250 mL),置于37 ℃,200 r/min摇床培养48 h。发酵液于4 ℃,4 800 r/min离心20 min,然后用细菌过滤器(直径为0.22 μm)过滤后,收集上清液。
1.2.3发酵液最佳硫酸铵浓度的确定及抗菌蛋白的制备发酵上清液用不同饱和度的(NH4)2SO4分级盐析,(NH4)2SO4饱和度分别为30%、40%、50%、60%、70%、80%、90%、100%,在4 ℃冰箱中静置24 h。于4 ℃,12 000 r/min离心 20 min后,弃上清液,将沉淀用磷酸盐缓冲液(0.02 mol/L,pH值为6.8)溶解,经透析袋透析48 h去盐,取出样品,于 4 ℃,12 000 r/min离心20 min后去除沉淀,收集上清液,即为蛋白质粗提液。由于70%饱和度下蛋白质沉淀量最大,因此,后续试验均选择70% (NH4)2SO4来沉淀上清液。
1.2.4单因素试验设计本试验以王祺等报道的枯草芽孢杆菌S-16的培养条件为基础[22],选取影响微生物发酵的7个主要因素:培养基碳源、培养基氮源、培养温度、培养时间、初始pH值、接种量和摇床转速进行单因素试验,考察各因素对粗蛋白抑菌活性的影响,从而确定响应面试验的因素及水平。每个试验处理设置3次重复,结果采用统计软件SPSS进行分析。不同因素的梯度条件见表1。
1.2.5响应面法设计基于单因素试验结果,采用中心组合试验Box-Behnken设计方案,以发酵温度(℃)、时间(h)和接种量(%)为自变量因素,以抑菌率(Y)为响应值。自变量分别用X1、 X2、X3 来表示,变量水平用1、0、-1表示(表2)。按方程xi=(Xi-X0)/ΔX 对自变量进行编码,其中,xi表示变量的编码值,Xi表示变量的真实值,X0表示试验中心点变量的真实值,ΔX表示变量的步长变化。
1.2.6稳定性试验
1.2.6.1温度对抗菌蛋白活性的影响取4支 10 mL 的离心管,每支离心管加入5 mL抗菌蛋白,分别置于0、10、20、30、40、60、80、100 ℃水浴中处理1 h,以未处理的样品置于室温作对照,冷却后若液体有挥发,用无菌水补液至5 mL,然后采用平板对峙法,以核盘菌为指示菌分别测定其抑菌活性。
1.2.6.2pH值对抗菌蛋白活性的影响取10支离心管,每支管中加入5 mL抗菌蛋白,用HCl(1 mol/L)和NaOH(1 mol/L)将其pH值分别调为2.0、3.0、4.5、5.5、6.5、6.8、7.5、8.0、9.0、10.0,置于室温培养2 h后,在温度为 4 ℃条件下过夜,次日再分别将 pH 值调至 7,以未处理的蛋白粗提液为对照,然后采用“1.2.6.1”节中的平板对峙法测定其抗菌活性。
1.2.6.3紫外线对抗菌蛋白活性的影响取5个培养皿,开盖,向每个培养皿中加入10 mL抗菌蛋白,在距离紫外灯20 cm處分别处理15、30、60、120 min,以日光灯处理为对照,然后采用“1.2.6.1”节中的平板对峙法测定其抗菌活性。
1.3数据分析
试验数据利用SPSS 17.0统计软件和Design-Expert( version 8.0.6)软件进行处理分析。
1.4抗菌蛋白的分离纯化
将培养好的种子液按照优化后的培养条件培养,用细菌过滤器(直径为0.22 μm)过滤后,收集上清液。按照“1.2.3”节的方法提取蛋白质。将获得的粗蛋白进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)(12%分离胶,4%浓缩胶)检测。预先在透析袋中加入1 mL电洗脱缓冲液(50 mmol/L Tris、50 mmol/L 甘氨酸、0.1% SDS,pH值 8.9),再用刀片切下目的蛋白条带,放入透析袋中。将收集有目的蛋白条带胶块的透析袋放在BioRad 电泳槽的上槽中,上、下槽均加入电洗脱缓冲液,在BioRad小型电泳槽中稳压100 V电泳 2 h,洗脱目的蛋白。最后取出透析袋中的胶块,经过透析和冻干,得到纯化的目的蛋白,通过SDS-PAGE检测纯化结果。
1.5抗菌蛋白对核盘菌的抑制作用
采用平板对峙法,用7 mm打孔器,将活化好的核盘菌在边缘打取菌饼,接于马铃薯葡萄糖琼脂(PDA)培养基平板中央。培养至菌落直径大小为 2 cm 时,在距离中央3 cm处用打孔器(7 mm)打取2个孔,取灭菌后的3片滤纸片蘸取抗菌蛋白,放入其中一个孔中,另取滤纸片3片蘸取磷酸缓冲液,放入等距的另外一个孔中作为空白对照,每个处理重复3次,培养3 d,每天用十字交叉法测定1次抑菌圈直径,连续测定3 d,取平均值,计算抑菌率。
2结果与分析
2.1种子液生长曲线
由图1可知,在12~48 h菌体数量增加速度较快,处于对数生长期,48 h后进入稳定期,菌体数量基本保持稳定。因此,选取摇床培养48 h的菌液,用无菌水调D600 nm至1.8作为种子液。
2.2单因素试验
2.2.1不同发酵温度对粗蛋白抑菌活性的影响由图2可知,随着温度升高,抑菌率呈先升后降的趋势,当培养温度为30 ℃时,抑菌活性最强,抑菌率为53%。说明温度过低或过高均不适合细菌的生长繁殖及分泌蛋白的产生。显著性测验结果表明,发酵温度对抗菌蛋白的产生影响极显著(P<0.01)。
2.2.2不同碳源对粗蛋白抑菌活性的影响由图3可知,各碳源的抑菌率表现为可溶性淀粉>酵母提取物>葡萄糖>蔗糖>乳糖。结果表明,以可溶性淀粉为碳源时,粗蛋白的抑菌能力最强,抑菌率为52.2%,明显高于其他碳源,因此可溶性淀粉为最佳碳源。显著性测验结果表明,不同碳源对粗蛋白的抑菌活性影响不显著。
2.2.3不同氮源对粗蛋白抑菌活性的影响由图4可知,各氮源的抑菌率表现为大豆蛋白胨>胰蛋白胨>硝酸铵>硫酸铵。以大豆蛋白胨为氮源时,粗蛋白的抑菌能力最强,抑菌率为513%,明显高于其他氮源,因此大豆蛋白胨为最佳氮源。显著性测验结果显示,不同氮源对粗蛋白的抑菌活性影响不显著。
2.2.4不同pH值对粗蛋白抑菌活性的影响由图5可知,粗蛋白抑菌活性随着pH值升高呈先增加后下降的趋势。pH值在5.0~7.5之间,蛋白产量逐渐增加, 且pH值在7.5 时抑菌活性达到最高,
抑菌率为51.7%;随着pH值的增加,蛋白产量逐渐降低。结果表明,蛋白质分泌在过酸过碱条件下影响较大。显著性测验结果表明,pH值在6.0~8.0时对粗蛋白的抑菌活性影响不显著。
2.2.5不同接种量对粗蛋白抑菌活性的影响由图6可知,以2%为最低接种量,粗蛋白抑菌活性随着接种量的增加呈先增加后逐渐降低的趋势,接种量在4%时抑菌率最大,为54%。结果表明,接种量为4%时,粗蛋白的抑菌活性最大。显著性测验结果表明,接种量对粗蛋白的抑菌活性影响极显著(P<0.01)。
2.2.6不同转速对粗蛋白抑菌活性的影响由图7可知,粗蛋白抑菌活性受到摇床转速的影响,在转速为200 r/min 时,抑菌率最大,为52.5%。显著性测验结果表明,摇床转速对粗蛋白的抑菌活性影响不显著。
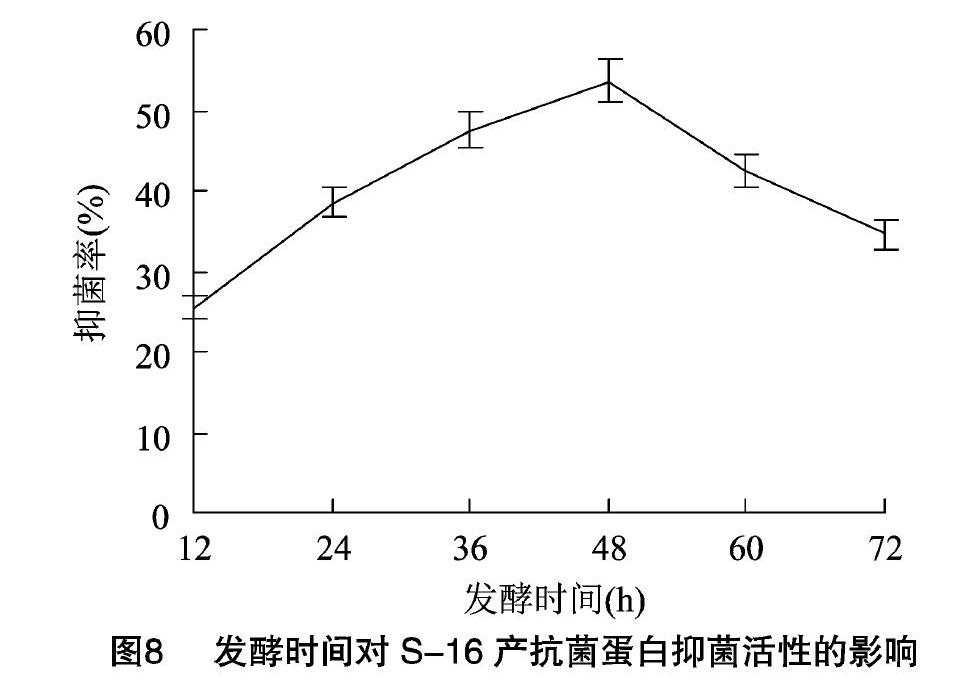
2.2.7不同发酵时间对粗蛋白抑菌活性的影响由图8可知,在发酵初期,菌株没有产生大量代谢物。随着发酵时间的不断延长,粗蛋白抑菌活性不断增加,并在48 h时达到最大,抑菌率为53.3%,48 h 后抑菌活性开始降低。显著性测验结果表明,发酵时间对粗蛋白的抑菌活性影响极显著(P<001)。
2.3响应面优化试验
2.3.1响应面试验设计与结果分析根据单因素试验结果,对发酵条件影响显著的因素有发酵温度、接种量、发酵时间;因此,选择上述3个因素进行响应面试验。
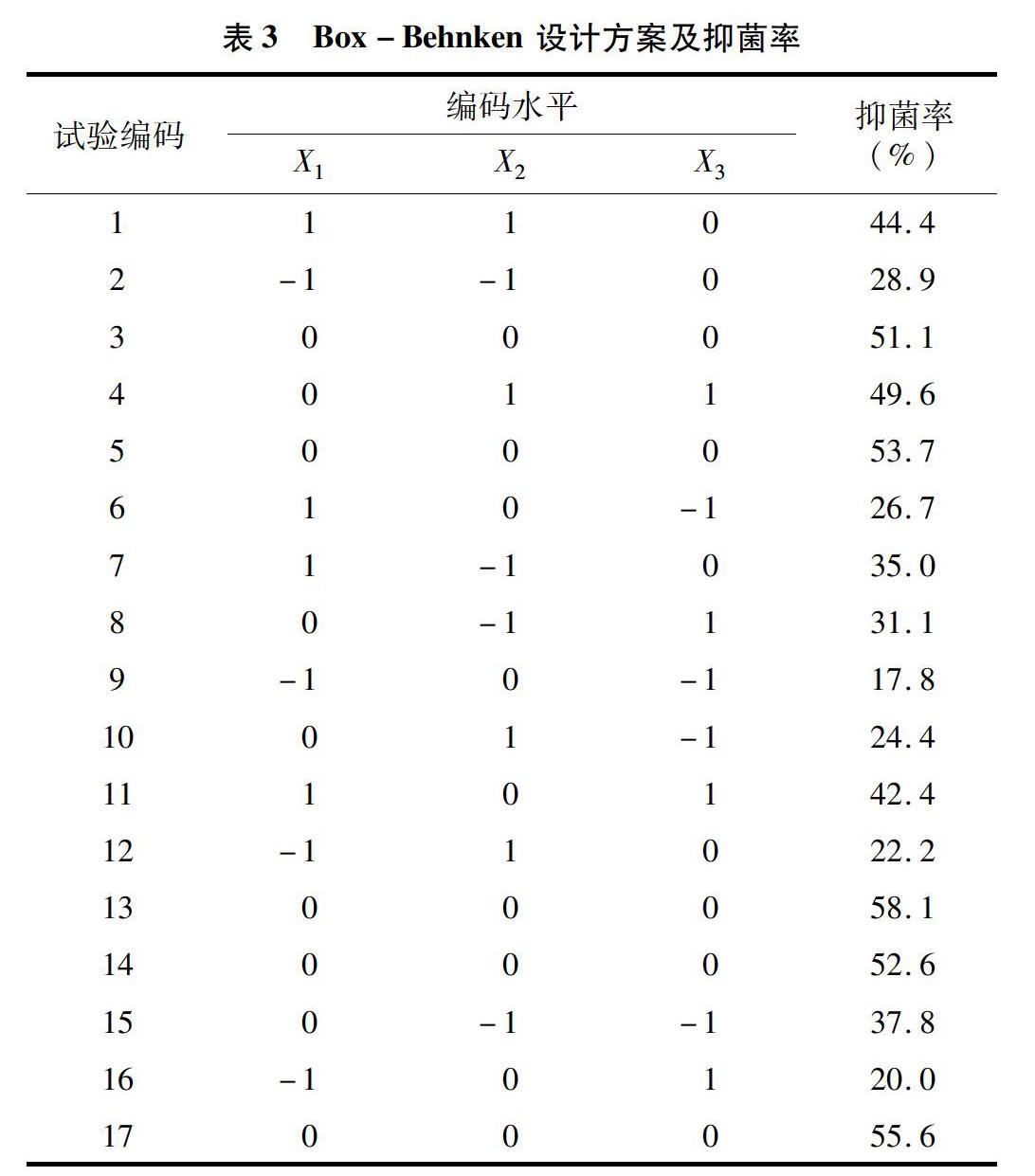
2.3.2模型的建立和方差分析在单因素试验的基础上,利用Design-Expert ( version 8.0.6) 软件对表3中试验数据进行多元回归分析,获得抑菌率(Y)对发酵温度(X1)、时间(X2)和接种量(X3)的二次多项回归模型为Y=55.6+10.575×X1+0.4×X2+6.55×X3-2225×X1X2+4.475×X1X3+13075×X2X3-15412 5×X21-1.3125×X22-13.462 5×X23。
从表4中可知,模型F值为72.66,P<0.01,达到极显著水平,可用此模型预测枯草芽孢杆菌抗菌蛋白发酵条件对抑菌率的影响。回归方程系数显著性检验结果:X1(温度)和X3(接种量)的一次项影响极显著(P<0.01),X1、X2和X3的二次项影响极显著(P<0.01),交互项X1X2(温度和时间组合)和X2X3(接种量和时间组合)影响极显著(P<001),X1X3(温度和接种量组合)影響显著(P<005)。由F值得出,试验各因素对抑菌活性影响的主次顺序表现为X1>X3>X2,即温度>接种量>时间。
2.3.3响应面分析结果根据二次多项模型并利用Design-Expert软件绘制出响应面分析结果(图9、图10、图11),每个响应面分别表示2个独立变量之间的相互作用,第3个变量保持在0水平,图9是发酵温度与时间对抑菌率的交互效应,图10是发酵温度和接种量对抑菌率的交互效应,图11是发酵时间和接种量对抑菌率的交互效应。利用响应面优化器,得到优化后的发酵条件:发酵时间为53 h,发酵温度为34.0 ℃,接种量为4.74%,预测最大抑菌率为56.5%。
2.4回归模型的验证试验
为验证预测值,用以上最优培养条件重复试验5次,抑菌率分别为51.5%、58.6%、57.7%、562%、54.1%,平均值为55.6%,与预测值有较好的拟合性,证明利用响应曲面法优化抗菌蛋白发酵条件是可行的。在最优培养条件下,抗菌蛋白最高抑菌活性可达58.6%,比试验设计初期的抗菌蛋白最低抑菌活性提高3.19倍。
2.5稳定性试验
2.5.1温度对抑菌蛋白活性的影响由图12可知,抗菌蛋白在0~30 ℃抑菌活性与对照相比变化很小,其中20 ℃时抑菌活性最接近对照;抗菌蛋白在 40~50 ℃处理 30 min 后,其抑菌效果与对照比,变化不大;蛋白经80 ℃水浴处理 30 min后,与对照相比其抑菌活性下降21%,但仍有抑菌作用,且抑菌率接近30%;经 100 ℃ 水浴处理 30 min后抑菌活性明显下降。结果表明,该抗菌蛋白在0~80 ℃时具有良好的热稳定性,温度适应范围广。
2.5.2pH值对抑菌蛋白活性的影响由图13可知,处理后的抗菌蛋白与对照相比,pH值在6.5~
8.0范围内抑菌活性有微小变化,pH值为2.0、10.0时仍分别保留原有活性的35.2%、47.1%。结果表明,该抗菌蛋白的pH值适应范围较宽,同时也说明其具有良好的酸碱稳定性。由此说明,该蛋白在实际应用中,对土壤酸碱环境适应范围较广。
2.5.3紫外线对蛋白抑菌活性的影响由图14可知,经过不同时间紫外线照射处理后,抗菌蛋白抑菌作用有明显变化,未经紫外线照射时,抗菌蛋白对核盘菌的抑制效果最好,抑菌率达到最大,为551%。经过紫外线照射后,短时间内抑菌圈减小不明显,抑菌活性稍有减弱,但随着时间的增长,抑菌活性越来越低,经过120 min紫外照射后其抑菌活性基本消失。
2.6抗菌蛋白的分离纯化
对分离纯化的抗菌蛋白经SDS-PAGE检测表明,在分子量约35 ku处有1条单一条带(图15)。
2.7抗菌蛋白对核盘菌的抑菌活性
采用平板对峙法培养3 d后,观察发现,纯化的抗菌蛋白对核盘菌有明显的抑菌效果,采用优化后的培养条件比优化前抑菌圈的直径明显增加,抑菌率增加了3.19倍(图16)。
3结论与讨论
向日葵是我国东北和内蒙古中西部地区的主
要经济作物,近年来连作现象普遍,使土壤中养分消耗过度,病虫害越来越严重。化学农药施用量不断增加,土壤污染严重,地力难恢复,亟待采用合理的栽培方法,科学的防治措施,以便提高作物产量,推进向日葵产业的可持续发展。大量研究表明,枯草芽孢杆菌能够促进植物生长发育,增加产量,能够改善盐碱地土壤理化性状,使土壤微生物数量增多。此外,由于枯草芽孢杆菌无致病性,并且可以分泌多种酶和抗生素,可以起到防病促生产的作用[23-25]。
本研究所用枯草芽孢杆菌S-16菌株经过室内抑菌测验、盆栽试验、种子处理试验已验证其对向日葵菌核病有较好的抑制作用,并且发现该菌株可在向日葵根际土壤中大量定殖[22,26]。抗菌蛋白是芽孢杆菌的次生代谢产物,其产量通常受到培养基营养成分、发酵条件和高度复杂的代谢调节机制的影响。本研究旨在探究提高抗菌蛋白产量的最佳发酵条件,以纯化出目的蛋白。许多研究表明,合理地使用优化方法可以显著提高微生物代谢物的产量[27-31]。本试验首先选择7个对抗菌蛋白抑菌活性有影响的因素进行单因素试验,结果筛选出3个因素对抑菌活性有显著影响,分别是发酵温度、发酵时间、接种量。然后,进一步针对上述3个因素做响应面试验,最终得出该菌株产生抗菌蛋白的最佳发酵条件:可溶性淀粉为碳源,大豆蛋白胨为氮源,初始pH值为7.5,接种量为474%,培养温度为34 ℃,培养时间为 53 h,转速为 200 r/min,并且通过验证,在此最佳发酵条件下,抗菌蛋白的抑菌活性比之前提高3.19倍。
据报道,枯草芽孢杆菌抗菌蛋白具有抗真菌和细菌等特性,其抗菌谱广、稳定性高、对热不敏感[32]。在本研究中,S-16菌株所产抗菌蛋白经热稳定性测验发现,在0~80 ℃热稳定性良好,在 100 ℃ 条件下处理 30 min,抑菌活性明显下降,且该抗菌蛋白具有较宽的pH值适应范围,说明其酸碱稳定性好。另外,该蛋白经紫外线照射30 min以内,对抑菌活性影响小,处理1、2 h,抑菌活性明显下降。根据上述试验数据,说明该蛋白对温度、pH值和短时间的紫外线不敏感。这些结果将为抗菌蛋白后续的抗菌机制研究和生防制剂的研制提供理论依据,也将为其应用于向日葵菌核病的生物防治提供参考。
参考文献:
[1]Li Z Q,Wang Y C,Chen Y,et al. Genetic diversity and differentiation of Sclerotinia sclerotiorum populations in sunflower[J]. Phytoparasitica,2009,37(1):77-85.
[2]Gulya T,Harveson R,Mathew F,et al. Comprehensive disease survey of U.S. sunflower:disease trends,research priorities and unanticipated impacts[J]. Plant Disease,2019,103(4):601-618.
[3]Yue B,Radi S A,Vick B,et al. Identifying quantitative trait loci for resistance to Sclerotinia head rot in two USDA sunflower germplasms[J]. Phytopathology,2008,98(8):926-931.
[4]董金皋. 农业植物病理学[M]. 2版.北京:中国农业出版社,2007:190-191.
[5]孟庆林,马立功,刘佳,等. 向日葵菌核病田间接种方法及品种抗病性研究[J]. 中國油料作物学报,2014,36(1):113-116.
[6]Talukder Z,Long Y,Seiler G J,et al. Introgression and monitoring of wild Helianthus praecox Alien segments associated with Sclerotinia basal stalk rot resistance in sunflower using genotyping-by-sequencing[J]. PLoS One,2019,14(3):e0213065.
[7]Ashwini N,Srividya S. Potentiality of Bacillus subtilis as biocontrol agent for management of anthracnose disease of chilli caused by Colletotrichum gloeosporioides OGC1[J]. Biotech,2014,4(2):127-136.
[8]Joseph B,Patra R R,Lawrence R. Characterization of plant growth promoting rhizobacteria associated with chickpea(Cicer arietinum L.)[J]. International Journal of Plant Production,2007,1(2):141-151.
[9]Zhao X Y,Zhao X M,Wei Y M,et al. Isolation and identification of a novel antifungal protein from a rhizobacterium Bacillus subtilis strain F3[J]. Journal of Phytopathology,2013,161(1):43-48.
[10]徐杨,王楠,李伟,等. 海洋枯草芽孢杆菌3512A抗真菌脂肽的分离纯化及结构特性鉴定[J]. 中国生物防治,2009,25(4):328-333.
[11]Fiddaman P J,Rossall S. The production of antifungal volatiles by Bacillus subtilis[J]. The Journal of Applied Bacteriology,1993,74(2):119-126.
[12]刘雪,穆常青,蒋细良,等. 枯草芽孢杆菌代谢物质的研究进展及其在植病生防中的应用[J]. 中国生物防治,2006,22(增刊1):179-184.
[13]刘伊强,王雅平. 拮抗菌TG26的鉴定及其抗菌蛋白BI的纯化和部分特性[J]. 植物学报,1994,36(3):197-203.
[14]刘永锋,陈志谊,周明国,等. 枯草芽抱杆菌Bs-916的抑菌活性及其抑菌物质初探[J]. 农药学学报,2007,9(1):92-95.
[15]彭兵,张树斌,贾宇,等. 枯草芽孢杆菌菌株A抗菌蛋白的分离纯化及抗真菌机理[J]. 中国农业科学,2011,44(1):67-74.
[16]Sha Y,Wang Q,Li Y. Suppression of Magnaporthe oryzae and interaction between Bacillus subtilis and rice plants in the control of rice blast[J]. Springer Plus,2016,5(1):1238.
[17]马新,黄永,程娟,等. 枯草芽孢杆菌微囊剂的制备及其对番茄立枯病的防治效果[J]. 农药学学报,2015,17(4):462-468.
[18]陈延熙,陈壁,唐文华. 增产菌(PGPR)增产效果的田间试验[C]//全国微生物生态学术讨论会. 1985.
[19]王全,王占利,高同国,等. 响应面法对解淀粉芽孢杆菌(Bacillus amyloliquefaciens)12-7产抗菌蛋白条件的优化[J]. 棉花学报,2016,28(3):283-290.
[20]杨洁,姬婧媛,康振生,等. 枯草芽孢杆菌E1R-j产抗菌脂肽发酵条件的优化[J]. 西北农业学报,2012,21(7):54-60.
[21]全鑫,杨艳艳,杨丽荣,等. 利用响应面法优化全蚀病生防菌YB-81的发酵条件[J]. 天津农业科学,2014,20(9):57-61.
[22]王祺,张一名,赵君,等. 枯草芽孢杆菌S-16抑菌活性物质的理化性质及培养条件的研究[J]. 中国生物防治学报,2015,31(3):439-444.
[23]Franco-Sierra N D,Posada L F,Santa-María G,et al. Bacillus subtilis EA-CB0575 genome reveals clues for plant growth promotion and potential for sustainable agriculture[J]. Functional & Integrative Genomics,2020,20(4):575-589.
[24]Hashem A,Tabassum B,Fathi Abd Allah E. Bacillus subtilis:a plant-growth promoting rhizobacterium that also impacts biotic stress[J]. Saudi Journal of Biological Sciences,2019,26(6):1291-1297.
[25]Sohaib M,Zahir Z A,Khan M Y,et al. Comparative evaluation of different carrier-based multi-strain bacterial formulations to mitigate the salt stress in wheat[J]. Saudi Journal of Biological Sciences,2020,27(3):777-787.
[26]张一名,甄熙,石林君,等. 生防菌S-16的定殖动态以及对向日葵菌核病的生防效果研究[J]. 河北农业科学,2012,16(1):36-38,75.
[27]Shu G W,Shi X Y,Chen H,et al. Optimization of goat milk with ACE inhibitory peptides fermented by Lactobacillus bulgaricus LB6 using response surface methodology[J]. Molecules,2017,22(11):2001.
[28]Wu W J,Ahn B Y. Statistical optimization of medium components by response surface methodology to enhance menaquinone-7 (vitamin K2) production by Bacillus subtilis[J]. Journal of Microbiology and Biotechnology,2018,28(6):902-908.
[29]Wang H B,Huang J G,Sun L,et al. An efficient process for co-production of γ-aminobutyric acid and probiotic Bacillus subtilis cells[J]. Food Science and Biotechnology,2019,28(1):155-163.
[30]Singh P,Shera S,Banik J,et al. Optimization of cultural conditions using response surface methodology versus artificial neural network and modeling of L-glutaminase production by Bacillus cereus MTCC1305[J]. Bioresource Technology,2013,137:261-269.
[31]劉珍珠,樊振,刘欢欢,等. 枯草芽孢杆菌的筛选及其与光合细菌复配对养殖水体的净化[J]. 江苏农业科学,2020,48(6):164-167.
[32]于杰,张荣意,谭志琼,等. 枯草芽孢杆菌B25抗真菌作用及抗菌蛋白的分离纯化[J]. 基因组学与应用生物学,2016,35(3):629-634.郭亚军,赵明,陈小军,等. 三氟苯嘧啶在稻田中的降解动态和残留分析[J]. 江苏农业科学,2021,49(2):71-75,80.

