不同埋藏方式及杀菌剂处理对黄土高原3 种植物种子存活的影响
侯金伟,陈焘,南志标
(兰州大学草地农业生态系统国家重点实验室,兰州大学草地微生物研究中心,兰州大学草地农业科技学院,甘肃兰州730020)
土壤种子库是指存在于土壤表面以及土壤中的全部种子的总和,其在植被更新与生态恢复等过程中发挥着重要作用[1-3]。然而,除了少数种子能够成功萌发外,土壤种子库中大多数种子在生物以及非生物因素的作用下最终死亡[4-6]。大量研究表明,除年龄老化导致生理死亡外,由捕食者和病原真菌侵染导致的死亡是土壤种子库衰减的重要原因[7-10]。一般认为,土壤表面或上层种子更容易受捕食者的影响,而土壤中的种子更容易受病原真菌的影响[11]。目前,国外已有大量研究探讨了病原真菌对土壤种子库的影响[8-10],但是国内尚未见报道。
另外,负密度依赖假说[12-13]表明,种子的存活以及幼苗的建植与土壤种子的密度密切相关,即在热带雨林中,靠近母株周围幼苗不易存活,这可能是由于母株周围种子密度高,更容易受到专一病原真菌的侵染。目前,大量野外试验验证了该假说在森林生态系统中的有效性[14-18],然而在草地中是否也存在负密度依赖假说,有待于进一步的验证[19]。这主要是因为草地中不同植物根系交织在一起,很难在种群水平确定病原真菌对幼苗或种子的负效应。
本研究采用“种子埋藏-取回”的方法,即将一定数目的种子通过杀菌剂处理,并且以不同方式(单种或者不同种混合,以改变同种植物种子埋藏密度)装入尼龙网袋后埋入土壤中,定期取回并观察种子的存活情况,探讨病原真菌对土壤种子存活的影响,以期为草地保护以及退化草地修复提供理论依据。
1 材料与方法
1.1 研究区概况
研究地位于甘肃省环县甜水堡镇大梁洼村—兰州大学草业科学野外试验站,地处鄂尔多斯台地前沿的陕、甘、宁交接地段(37.12° N,106.82° E,海拔为1650 m)。年均气温 7.1 ℃,≥10 ℃的年均积温2487.3 ℃,无霜期123 d,年日照时数2766.4 h,日照率62% 以上。多年平均降水量360 mm ,约70%的降水集中于6-9 月;年均蒸发量1993.3 mm,8 级大风每年有38~85 d,多集中在冬春季,风沙严重,属黄土高原沟壑区典型的大陆型季风气候。该地区优势植物为茵陈蒿(Artemisia capillaris)、长芒草(Stipa bungeana)和胡枝子(Lespedeza davurica)[20]。其他常见植物有白草(Lespedeza davurica)、砂珍棘豆(Oxytropis racemosa)、阿尔泰狗娃花(Heteropappus alta⁃icm)、狗尾草(Setaria viridis)、野胡麻(Dodartia orientalis)、多裂委陵菜(Potentilla multifida)、二裂委陵菜(Po⁃tentilla bifurca)、乳浆大戟(Euphorbia esula)等。草地 4 月中下旬返青,6 月下旬至 8 月下旬进入旺盛生长期,9 月中下旬开始枯黄。研究区在2001 年以前为公共放牧地,连续放牧多年,退化严重。
1.2 种子收集
本试验选取胡枝子、狗尾草和长芒草3 种植物种子作为试验材料(表1)。于2004 年6 月中旬(长芒草)和11月初(胡枝子和狗尾草)在试验站周围采集3 种植物种子。收获的种子带回实验室晾干、清选干净后保存于4 ℃冰箱,备用。
1.3 试验设计
本试验设4 个处理,即3 物种×2 杀菌剂拌种(拌种和对照)×2 埋藏方式(单种和混合)× 2 埋藏时间(1 和3 个月),共24 个处理组合,每个处理组合重复10次,完全随机区组设计。
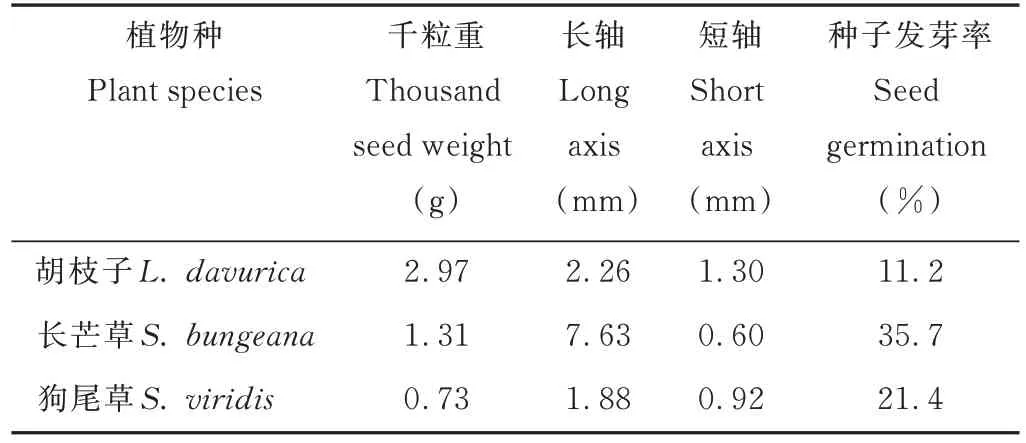
表1 供试植物种子参数Table 1 Seed parameters of tested plant species
供试杀菌剂选用福美双,是一种保护性广谱杀菌剂,广泛应用于农田与草地病害防治。经预试验确定,胡枝子、狗尾草与长芒草杀菌剂拌种的适宜(指不影响种子发芽率的前提下,所能采用的最大杀菌剂剂量)浓度(质量百分比)为0.7%,0.2%和0.9%。
用0.28 mm 的尼龙网(网眼大小能保证供试种子不外漏)制作10 cm×10 cm 种子袋。单种埋藏处理时每种子袋装入60 粒同种种子,混合埋藏处理时每种子袋3 种种子各20 粒,共60 粒。每种植物挑选健康、饱满的种子用于试验。杀菌剂处理的种子在装入种子袋前用相应的杀菌剂进行拌种处理,以加无菌水搅拌同样时间的种子作为对照。
1.4 种子袋埋藏与取回
在试验站周围选取一块地势平坦、植被组成较为均一的草地作为试验小区。试验小区内按照完全随机区组设计布置样点。于2005 年6 月初,在每个预设样点埋入备好的种子袋,埋深约5 cm,做好标识。种子袋之间间距约30 cm,共240 个种子袋。
在2005 年7 月初和9 月初分别取回种子袋,每次取回120 袋,带回实验室进行处理。埋藏种子取回后,以下面几种状态存在:已萌发种子,完整种子,死亡种子和丢失种子[21]。统计每袋中各类种子数量,并且计算种子田间发芽率和死亡率。相关计算公式如下:

1.5 室内发芽试验
对未萌发的完整种子进行萌发试验。将种子用75%酒精处理1 min,0.1%NaClO 处理5 min,无菌水润洗后均匀摆放于直径12 cm 的培养皿(内铺双层滤纸)中,置于20 ℃培养箱内进行发芽。每天适当浇水保持滤纸湿润;逐日统计,连续2 d 无发芽认为发芽结束,计算种子室内发芽率。计算公式如下:

1.6 数据统计与分析
植物种、埋藏方式、杀菌剂处理和埋藏时间对种子田间发芽率、死亡率以及室内萌发率的影响采用广义线性混合模型(generalized linear mixed models)分析。在后检验中,不同处理之间的差异采用非参数检验(Kruskal-Wallis test)进行检测。在统计分析之前,所有百分数数据进行平方根反正弦转换。所有统计分析和制图采用R 3.5.1 完成[22]。
2 结果与分析
2.1 种子田间发芽率
广义线性混合模型分析表明,植物种和埋藏时间对种子田间发芽率的影响最大,埋藏方式也有一定程度的影响,均达到显著水平;杀菌剂处理对种子田间发芽率没有显著影响(表2)。另外,植物种和埋藏时间对种子田间发芽率的影响存在交互作用(表2)。3 种植物中,长芒草种子的田间发芽率最高,平均约为51.9%,显著高于胡枝子和狗尾草,二者分别为14.6%和26.1%(图1a~c)。随着埋藏时间的增加,3 种植物种子田间发芽率显著增加(图1a~c)。另外,狗尾草种子混合埋藏后田间种子发芽率较单种埋藏有所提高,但未达到显著差异;另外两种植物不同埋藏方式对种子田间发芽率没有显著影响(图1c)。
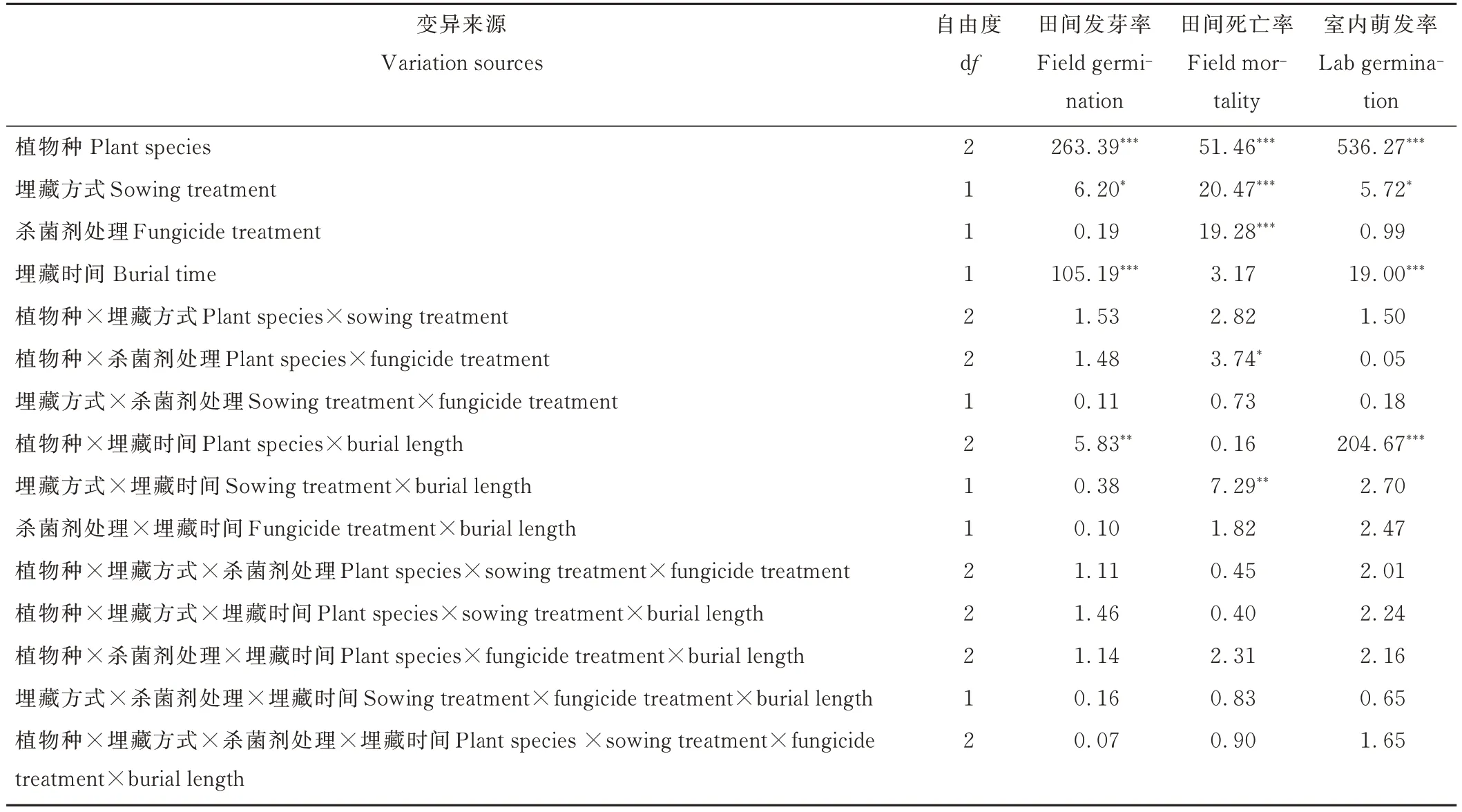
表2 植物种、埋藏方式、杀菌剂处理和埋藏时间对种子田间发芽率、死亡率以及取回后室内萌发率影响的广义线性混合模型分析Table 2 Results from generalized linear mixed models for the effects of plant species,sowing treatment,fungicide treatment,and burial time and their interactions on field germination,field mortality,and lab germination of burial seeds
2.2 种子田间死亡率
广义线性混合模型分析表明,植物种、埋藏方式和杀菌剂处理对种子田间死亡率有显著影响,埋藏时间对种子田间死亡率没有显著影响(表2)。另外,植物种和杀菌剂处理、埋藏方式和埋藏时间对种子田间死亡率的影响存在交互作用(表2)。3 种植物中,胡枝子种子的田间死亡率最低,平均约为1%,长芒草和狗尾草种子的田间死亡率分别为5.1%和4.4%(图1d~f)。埋藏1 个月后,杀菌剂未处理和单种埋藏条件下长芒草和狗尾草种子的田间死亡率分别为12.5%和11.0%,显著高于其他处理组合下两种植物种子的死亡率(图1e,f)。然而埋藏3 个月后,长芒草和狗尾草种子田间死亡率在不同处理组合之间没有显著差异(图1e,f)。与之相比,胡枝子种子在埋藏1 和3 个月时,其种子死亡率在不同处理组合之间均无显著差异(图1d)。
2.3 种子室内萌发率
广义线性混合模型分析表明,植物种、埋藏时间和埋藏方式对种子室内萌发率均有显著影响,但是效应依次减弱。而且,植物种和埋藏时间对种子室内萌发率的影响存在交互作用(表2)。杀菌剂处理对种子室内萌发率没有显著影响(表2)。3 种植物中,长芒草种子的室内萌发率最高,平均约为64.3%,显著高于狗尾草和胡枝子,二者的室内萌发率分别为29.2%和5.9%(图1g~i)。随着埋藏时间的增加,胡枝子和狗尾草种子的室内萌发率显著下降,而长芒草种子的室内萌发率却显著增加(图1g~i)。在埋藏1 个月后,杀菌剂处理且混合埋藏条件下胡枝子和长芒草种子的室内萌发率较高,显著高于杀菌剂未处理且单种埋藏的种子(图1g,h)。在埋藏3 个月后,杀菌剂处理且混合埋藏条件下狗尾草种子的室内萌发率最高,显著高于杀菌剂未处理且单种埋藏的狗尾草种子(图 1i)。
3 讨论
3.1 不同埋藏方式及杀菌剂拌种对种子田间发芽率的影响
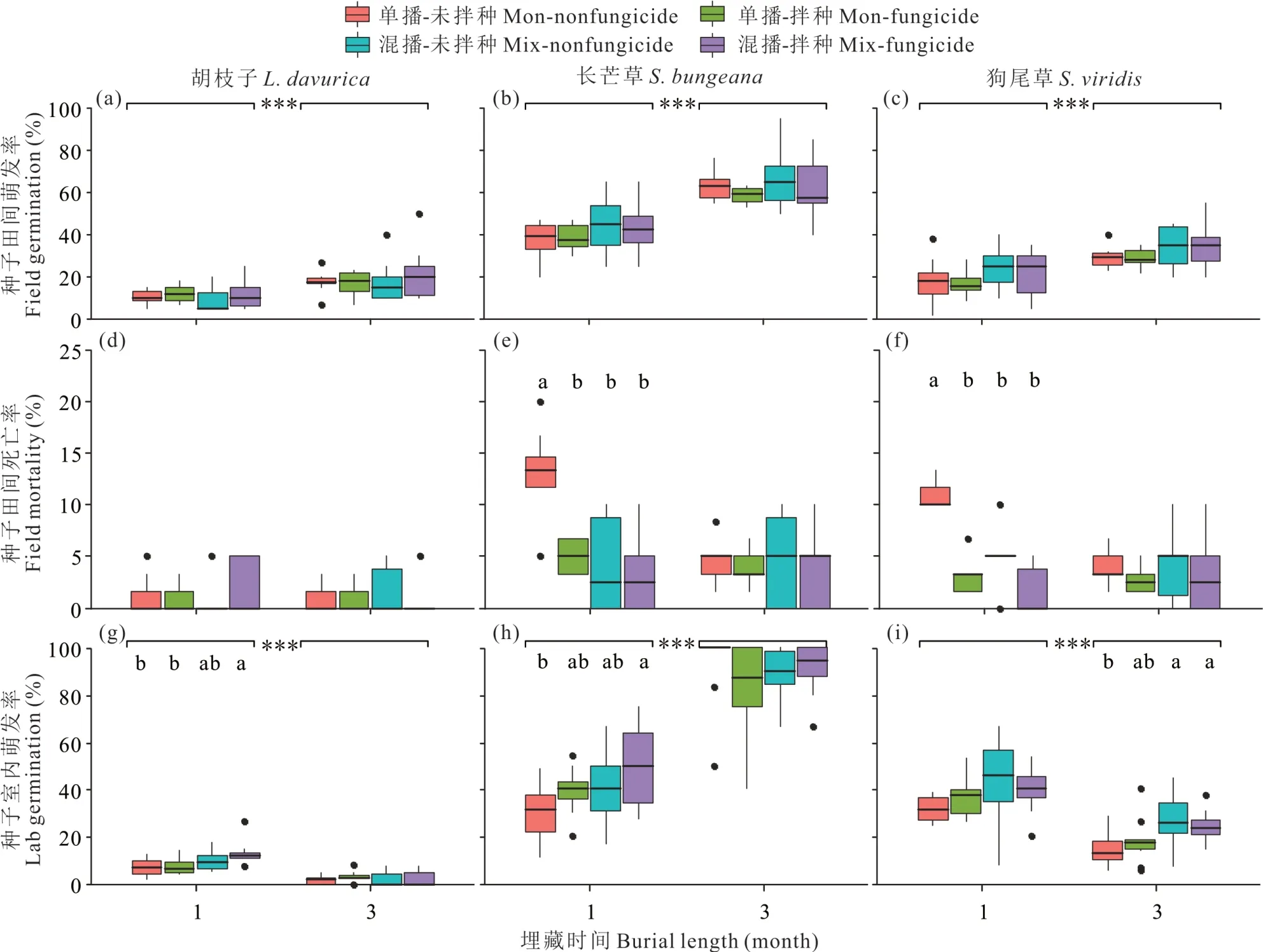
图1 不同播种方式、杀菌剂处理以及埋藏时间对胡枝子、长芒草、狗尾草种子田间发芽率、死亡率以及取回后种子在室内萌发率的影响Fig. 1 Field germination and mortality in the burial period and lab germination after retrieval of seeds L. davurica,S. bungeana and S. viridis following fungicide treatment and buried in the field for 1 and 3 months in monoculture or mixture(n=10)
病原真菌侵染种子后,可通过释放毒素或损伤种子膜结构,进而杀死或抑制种子的萌发[23-24]。Kirkpatrick等[25]研究发现,在马铃薯(Solanum tuberosum)葡萄糖琼脂上接种交链孢(Alternariaspp.)后,一年生植物苘麻(Abutilon theophrasti)种子的发芽率降低了约92%。Chen 等[26]的研究也发现,在水琼脂培养基上接种三线镰刀菌(Fusarium tricinctum)后,后者菌丝体快速侵入萌发的长芒草和胡枝子种子,抑制了胚根的生长,从而在萌发初期杀死种子,降低了种子的萌发率。本研究发现不同埋藏方式下杀菌剂处理对3 种植物种子的田间发芽率没有显著影响。这一结果与Schafer 等[21]的研究结果一致,即杀菌剂处理并没有提高无芒雀麦(Bromus inermis)和草地早熟禾(Poa pratensis)等一年生植物种子的萌发率。在另一项研究中,Leishman 等[6]研究发现,杀菌剂处理仅提高了天蓝苜蓿(Medicago lupulina)种子的田间发芽率,而对另外3 种植物田旋花(Convolvulus arvensis)、百脉根(Lotus corniculatus)和欧洲黑莓(Rubus fruticosus)种子的萌发率没有显著影响。由此可见,在田间条件下,影响种子萌发的因素要比室内条件复杂的多,除了病原真菌外,其他生物以及非生物因素(温度变化、干湿交替等)也会影响种子的萌发[27-29],从而抵消了病原真菌的效应。另外,本研究发现,3 种植物的田间发芽率随着埋藏时间的增加显著提高,可能是由于土壤水热条件变化以及土壤颗粒的作用打破了部分种子的休眠[27-29],从而提高了种子的萌发率。
3.2 不同埋藏方式及杀菌剂拌种对种子田间死亡率的影响
大量野外埋藏试验表明,添加杀菌剂能够提高埋藏种子的存活率[6,9,30-31]。本研究发现不同埋藏方式及杀菌剂处理对3 种植物种子的田间死亡率影响不一。在埋藏1 个月时,单种埋藏及未添加杀菌剂条件下,长芒草和狗尾草种子的死亡率最高,而混合埋藏或者杀菌剂处理后两种植物种子的死亡率均显著降低。这一结果在一定程度上支持了负密度依赖假说,即单种埋藏条件下,由于同种植物种子密度较大,更容易受到病原真菌的侵染,而混合埋藏降低了单种植物种子的密度,从而降低了专一病原真菌在同种植物种子间的传播,因此降低了种子的田间死亡率。然而,本研究在胡枝子种子上并未观察到这一结果。事实上,胡枝子种子在田间的死亡率很低,平均不到1%。究其原因,可能与种子休眠特性有关。胡枝子属于豆科植物,其种子具有很强的物理休眠。研究发现种皮是否透水是病原真菌入侵种子的关键[32]。处于物理休眠的胡枝子种子由于种皮不透水,因此可以有效抵御病原真菌的入侵。与之相比,长芒草和狗尾草种子虽具有生理休眠,但是室内常温条件下储藏一段时间可有效破除种子休眠,因此更容易受到病原真菌的侵染而死亡[26]。
3.3 不同埋藏方式及杀菌剂拌种对种子室内萌发率的影响
埋藏种子取回后进行发芽试验,其萌发率高低可在一定程度上反映种子埋藏后的生活力状况。本研究发现杀菌剂处理后3 种植物种子室内萌发率有所提高,而且混合埋藏下种子室内萌发率高于单种埋藏,说明杀菌剂处理或者混合埋藏可提高种子的生活力。O’Hanlon-Manners 等[10]研究发现,杀菌剂处理后,白桦树(Betula papyr⁃ifera)种子在室内的萌发率显著提高,本研究结果与此一致。在Mitschunas 等[31]的研究中,杀菌剂处理后多年生草本植物鸭茅(Dactylis glomerata)和牛至(Origanum vulgare)种子生活力分别增加了42%和57%。但是也有研究发现,杀菌剂处理对种子生活力的影响因种而异。如Leishman 等[6]研究发现,杀菌剂处理提高了天蓝苜蓿和欧洲黑莓种子的生活力,但是对田旋花和百脉根种子的生活力没有显著影响。另外,本研究发现3 种植物种子室内萌发率随埋藏时间变化不同。长芒草种子室内发芽率随埋藏时间显著提高,而胡枝子和狗尾草则随埋藏时间显著下降。可能的原因是长芒草种子属于短暂种子库[33],在野外埋藏一段时间后种子休眠基本上破除,因此取回后萌发率较高。与之相比,胡枝子和狗尾草更容易形成持久种子库[34],具有明显的萌发循环,因此需要更长的时间破除休眠。
4 结论
1)杀菌剂处理显著降低了长芒草和狗尾草种子的田间死亡率,而对胡枝子种子的死亡率没有显著影响,表明杀菌剂处理能显著降低土壤种子的死亡率,但是效应因植物种而异,可能与种子的休眠方式有关。
2)较单种埋藏相比,混合埋藏显著降低了长芒草和狗尾草种子的田间死亡率,表明降低同种植物种子密度能够降低种子的死亡率,可能是由于混合埋藏稀释了病原真菌的效应。

