不同转移部位对广泛期小细胞肺癌患者治疗预后的影响
刘 倩,乔 梦,毛士琦,杨 硕,刘弋维,赵 超,李雪飞,任胜祥,周彩存
1.同济大学附属上海市肺科医院肿瘤科,上海 200433;
2.同济大学附属上海市肺科医院肺癌免疫研究室,上海 200433
肺癌是全球发病率和死亡率最高的恶性肿瘤,其中小细胞肺癌(small cell lung cancer,SCLC)是肺癌中恶性程度最高的病理学类型,占肺癌的15%,具有恶性程度高、进展快、易转移、预后差等特征[1]。临床上常采用美国退伍军人肺癌协会分期系统将SCLC分为局限期小细胞肺癌(limited-stage small cell lung cancer,LSSCLC)和广泛期小细胞肺癌(extensive-stage small cell lung cancer,ES-SCLC)。既往研究[2]显示,60%~75%的SCLC诊断时即为ES-SCLC,ES-SCLC患者约70%存在远处器官转移,常见的转移器官包括骨、脑、肝及对侧肺[3]。有研究指出,肺癌发生远处器官转移没有特定规律,可能与趋化因子、细胞黏附和血管生成等因素有关[4],肺癌患者转移部位与患者预后相关[5]。
掌握ES-SCLC的转移特点,对于准确分期、临床决策及预后预测具有重要的指导意义。本研究回顾性分析ES-SCLC患者基线远处器官转移的特点,并比较不同远处转移部位和转移器官个数对患者总生存期(overall survival,OS)及无进展生存期(progression-free survival,PFS)的影响。
1 资料和方法
1.1 临床资料
根据美国退伍军人肺癌协会分期系统,收集2014年5月—2019年2月于同济大学附属上海市肺科医院住院治疗的ES-SCLC患者的临床资料,所有患者的诊断均经过病理学及影像学检查证实。重点登记患者的年龄、性别、体能状态(performance status,PS)评分、吸烟状况、并发症状况、初次诊断时转移情况、治疗情况、生存时间及状态等相关临床数据。
1.2 治疗方法
本研究入组的206例患者根据指南[6]接受标准一线治疗方案治疗,包括以依托泊苷或伊立替康为基础的化疗;直至疾病进展或出现不可耐受的毒性。胸部放疗放射野主要为胸部原发病灶±纵隔及双锁骨上区淋巴结,部分患者还进行了预防性脑放疗,远处器官转移患者不同程度地接受了局部治疗。
1.3 随访
采用电话随访及病案查询收集整理数据,末次随访时间为2019年12月25日,本研究观察终点为死亡或随访截止。OS定义为从确诊日期开始至患者死亡或末次随访时间,以月为单位。PFS定义为从确诊日期开始至患者发生疾病进展或死亡的时间。
1.4 统计学处理
采用SPSS 20.0软件对数据进行分析。OS及PFS等生存分析采用Kaplan-Meier法,不同分组之间比较采用log-rank检验,P<0.05为差异有统计学意义。应用GraphPad Prism 8绘制生存曲线。
2 研究结果
2.1 基线特征
本研究分析了206例ES-SCLC患者,基线临床特征详见表1。大部分患者为男性(187例,90.8%)、吸烟(148例,71.8%)、PS评分0~1分(203例,98.5%)、无并发症(141例,68.4%)及TNM分期较晚的患者。按转移个数分组发现,绝大部分患者(68.9%)诊断时即存在远处器官转移,其中1个远处器官转移和大于/等于2个远处器官转移的分别有91例(44.2%)和51例(24.8%),无远处器官转移的有64例(31.1%)。远处转移器官包括:脑转移49例(23.8%),骨转移59例(28.6%),肝转移31例(15.0%),对侧肺转移24例(11.7%),其他器官转移(包括肾上腺、胸膜、心包、皮下、肾脏、膀胱、胰腺等)51例(24.8%)。206例患者中,198例接受依托泊苷联合铂类药物化疗,3例接受依托泊苷单药化疗,5例接受伊立替康联合铂类药物化疗。比较依托泊苷联合顺铂(95例)与卡铂(103例)方案疗效是否有差异,结果发现,两者疗效相当,客观缓解率分别为69.4%和68.9%,疾病控制率分别为90.6%和89.3%。206例患者中接受胸部放疗的患者共77例,接受胸部放疗的患者生存期较未接受胸部放疗患者延长,但比较基线有无胸部放疗患者基本特征发现,接受胸部放疗患者年龄相对偏小(P=0.043),转移个数更少(P=0.018),所以胸部放疗对预后的影响可能存在偏倚。
2.2 OS分析
全组206例患者中位OS为14.40个月,无远处器官转移组患者中位OS明显长于1个远处器官转移组及大于/等于2个器官转移组(20.13个月vs14.33个月vs11.70个月,P=0.007 9)。不同器官转移OS也不同,脑转移、骨转移、对侧肺转移、肝转移及其他器官转移组的中位OS分别为14.83、11.70、14.47、11.10及12.47个月(P=0.031 1),骨转移、肝转移及其他器官转移患者预后比脑转移与对侧肺转移差。有无肝转移(11.10个月vs14.67个月,P=0.001 5)及有无骨转移(11.70个月vs14.83个月,P=0.028 3)中位OS差异有统计学意义。而有无脑转移(14.83个月vs13.83个月,P=0.496 5)及有无对侧肺转移(14.40个月vs13.90个月,P=0.515 5)中位OS差异无统计学意义(图1)。
2.3 PFS分析
全组206例患者中位PFS为5.2个月,无远处器官转移组患者中位PFS长于1个远处器官转移组及大于等于2个器官转移组(6.27个月vs5.37个月vs4.43个月,P=0.027 0)。不同器官转移PFS也不同,脑转移、骨转移、对侧肺转移、肝转移及其他器官转移组的中位PFS分别为5.07、4.07、7.10、3.87及4.80个月(P=0.033 6),骨转移及肝转移患者预后比脑转移、对侧肺转移及其他器官转移差。有无肝转移比较(3.87个月vs5.50个月,P=0.005 6)及有无骨转移(4.07个月vs6.17个月,P=0.000 3)中位PFS差异有统计学意义。而有无脑转移(5.07个月vs5.43个月,P=0.697 5)及有无对侧肺转移(7.10个月vs5.07个月,P=0.433 2)中位PFS差异无统计学意义(图2)。

表1 入组患者基线临床特征Tab.1 Baseline clinical characteristics of included patients
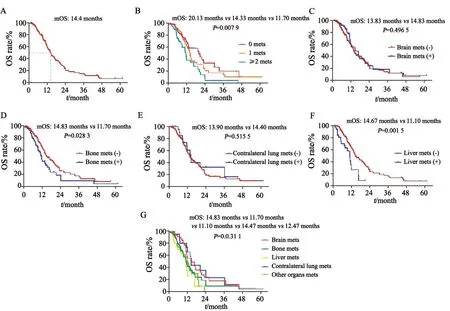
图1 全组206例患者的OS分析Fig.1 OS analysis of 206 patients
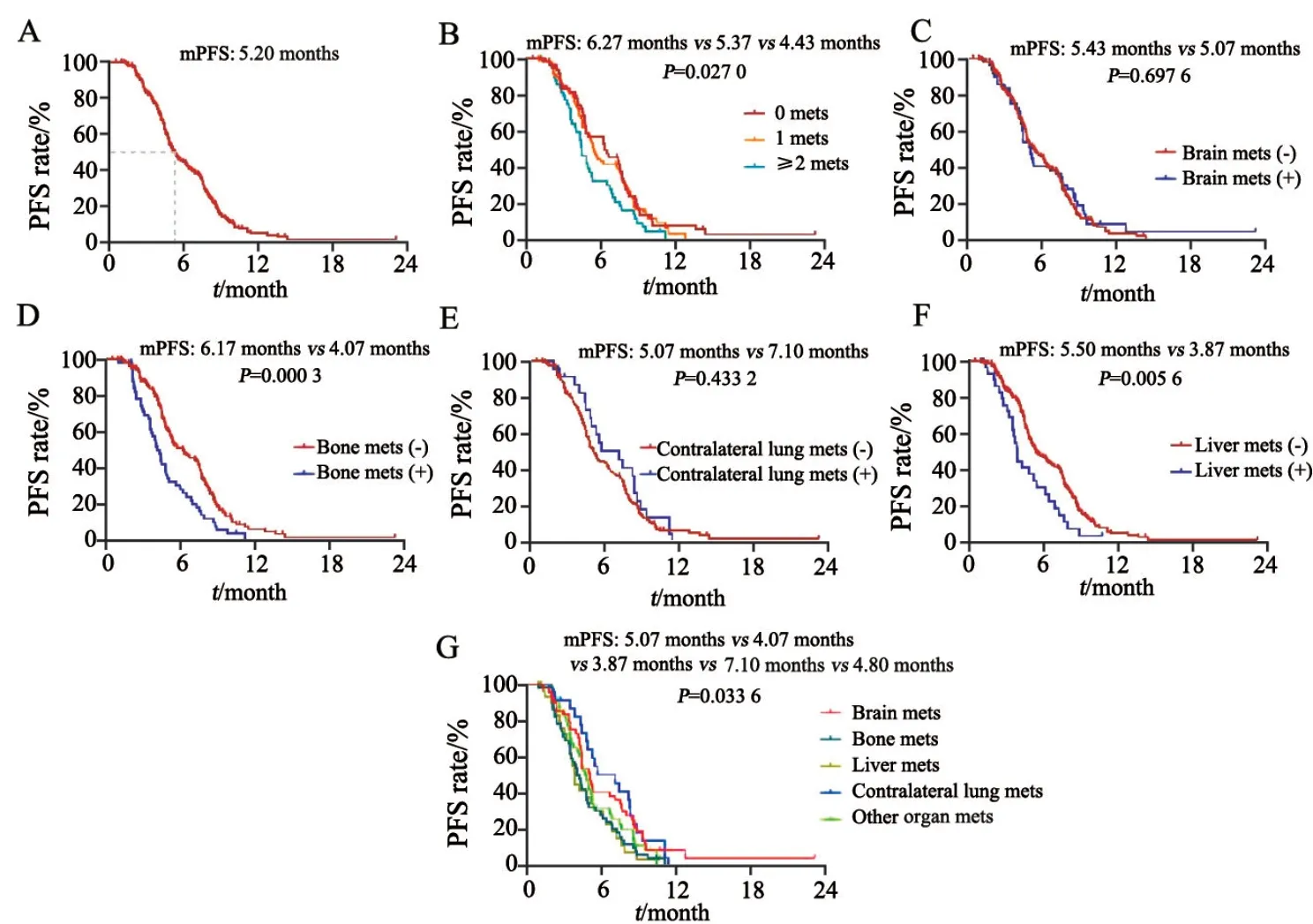
图2 全组206例患者的PFS分析Fig.2 PFS analysis of 206 patients
3 讨 论
SCLC是肺癌中恶性程度最高、最容易发生转移的病理学类型,约占肺癌发生率的15%,约70%的SCLC患者诊断时已发生远处转移,LSSCLC患者5年生存率在10%左右,而ES-SCLC患者5年生存率不到1%[1]。ES-SCLC患者出现远处器官转移的模式包括单病灶、单器官、多病灶和多器官等,不同的转移部位预后生存存在差异[7-8]。本研究回顾性分析了不同转移器官及转移器官个数对ES-SCLC患者预后生存及化疗效果的影响,结果显示,基线转移器官越多,预后越差。诊断初期伴有骨转移、肝转移的患者预后较无骨转移、肝转移差,而有无脑转移及对侧肺转移对患者预后生存未见明显影响。对于不同远处器官转移,骨转移与肝转移预后比脑转移和对侧肺转移差。与此同时本研究发现,转移器官个数越多,化疗效果越差,肝转移及骨转移化疗效果较无肝转移、骨转移患者更差。
肿瘤转移是肿瘤细胞从原发部位经淋巴管、血管或体腔等途径,转移到其他部位继续生长。主要涉及发病部位肿瘤细胞相互解离、肿瘤血管形成、细胞外基质和血管基底膜的降解、肿瘤细胞迁移进入血管或淋巴管、肿瘤随血液循环种植在靶器官等过程[9-10]。肺癌较常见的转移部位包括脑、骨、肝、肺[11]。本研究中,ES-SCLC患者远处转移较常见的器官有骨转移(28.6%)、脑转移(23.8%)、肝转移(15.0%)及对侧肺转移(11.7%),与多数既往研究报道[3,11]基本一致。本研究无远处转移的患者中位OS达到20.13个月,明显高于有远处器官转移患者(单器官转移为14.33个月,多器官转移为11.70个月),与Nakazawa等[3]的研究结果一致。多器官转移患者预后相对较差的原因可能是肿瘤负荷高于单器官转移,且并发症相对较多,化疗效果较差,中位PFS较短,从而影响OS。
除了转移器官个数与患者预后生存及化疗效果相关外,不同的器官转移对患者预后及疗效的影响也有不同。本研究发现,所有发生远处器官转移的患者中,肝转移预后及疗效最差,与无肝转移的患者比较,肝转移患者中位OS减少了3.57个月(P=0.001 5),这与罗婧等[12]的研究结果类似,虽然两项研究纳入人群及分析方式略有不同,但是得出的结果均是肝转移患者预后差。肝转移预后差的一个可能原因是肝脏是人体双重血运的器官,当出现转移灶,极易发生血行播散继而出现其他器官的转移,促使患者临床症状逐渐加重,病情迅速恶化,PS评分变差[13]。第二个原因在于肝脏是人体最大的解毒和代谢器官,一旦发生肝转移,肝功能可能受损,进而影响患者后续的治疗[14-15],这也与本研究发现的肝转移患者化疗效果差,肝转移组中位PFS与无肝转移组相比减少了1.63个月(P=0.005 6)相符。
另外一个与患者预后显著相关的远处转移器官是骨。既往研究[16]报道,骨转移在ES-SCLC患者中的发生率为30%~40%,大部分为脊柱转移,骨转移个数越多,预后越差,中位OS为10.4个月。本研究的骨转移发生率是28.6%,要更低一些,可能与本研究只统计了基线骨转移患者而在治疗过程中发生的骨转移未予统计有关。本研究发现,骨转移患者中位OS低于无骨转移患者(11.70个月vs14.83个月,P=0.028 3),这一结果与之前的研究[17]一致。其生存时间受多种因素的影响,骨转移与骨骼相关事件增加有关,包括骨痛、高钙血症、病理性骨折、脊髓压迫症等,严重影响患者的生活质量,使疗效变差,生存期缩短。Charpidou等[17]对363例患者的研究显示,无骨转移患者比骨转移患者的OS长(HR=0.76,P=0.024)。SCLC通常伴有激素分泌异常,内源性皮质醇过量可以导致骨脱矿和椎体骨折[18-19],促使骨转移,合并病理性骨折患者的OS更差。
本研究基线脑转移患者的发生率是23.8%,基线有无脑转移患者中位生存时间未见明显差异。Karim等[20]研究报道,10%~14%的SCLC患者初诊时即有脑转移,而我们的基线脑转移患者比例偏高,可能与目前检查技术提高使检出率增高有关。ES-SCLC基线脑转移患者均不同程度地采用脑放疗,而无脑转移的患者也会采用预防性脑放疗。一旦发现脑转移,也会接受包括全脑放疗、调强放疗及立体定向放疗在内的姑息或根治性放疗。既往研究[21]报道,各种方式的全脑或局部脑放疗均可延长脑转移患者的OS,治疗手段多元化也可在一定程度上延长患者生存期,所以基线有无脑转移对患者OS无明显影响。本研究发现,对侧肺转移患者的中位OS为14.5个月,有无对侧肺转移患者中位OS及PFS也未见明显差异,可能与人的呼吸储备功能及胸部放疗有关[22]。
本研究存在以下不足。首先,由于本研究是回顾性研究,可能存在难以避免的偏倚,如化疗方案及周期数不同、检查手段不一致、患者基础疾病不同等因素均会对本研究结果造成影响。其次,对于同一个器官转移的患者,是单发转移灶还是多发转移灶,病灶个数未明确记录,可能会影响预后判断。再者,本研究仅分析了基线器官转移情况与患者OS的关系,而SCLC患者治疗过程中出现的复发转移也可能影响患者的生存。此外,最新研究[23]显示,化疗联合抗程序性死亡配体-1(programmed death ligand-1,PD-L1)免疫治疗已经成为新的广泛期SCLC标准一线治疗方案,本研究结果能否在免疫治疗时代同样适用,还需要更多的研究。
综上,ES-SCLC患者出现远处转移与预后有关,且不同转移部位及不同转移器官个数预后存在显著差异。对于确诊ES-SCLC的患者,应尽早进行全身情况评估,明确分期,有利于更准确地判断其预后。

