miR-375靶向YAP1调控上皮-间质转化参与乳腺癌细胞曲妥珠单抗的耐药
1.福建省肿瘤医院,福建医科大学附属肿瘤医院中心实验室,福建 福州 350014;
2.福建省肿瘤医院,福建医科大学附属肿瘤医院乳腺外科,福建 福州 350014
较早使用具有抑制人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)功能的曲妥珠单抗,对多种HER2高表达的肿瘤有抗癌效应,联合化疗药物一同使用可以使患者无进展生存期得到显著延长[1-2]。然而,20多年的临床研究[1]表明,曲妥珠单抗有效率仅为12%~34%,中位缓解期约9个月,而且许多患者在接受曲妥珠单抗治疗的12个月内出现疾病进展,快速产生的耐药性严重妨碍了曲妥珠单抗的抗癌疗效及应用。
肿瘤上皮-间质转化(epithelial-mesenchymal transition,EMT)与耐药发生的关系是一个新的研究方向。特别是近期有若干研究[3-4]显示,曲妥珠单抗耐药发生过程中细胞出现EMT现象,且HER2阳性细胞发生EMT与其对曲妥珠单抗耐药性的关系的机制研究处于起步阶段。我们课题组在前期的研究[5]中发现,miR-375在曲妥珠单抗耐药的乳腺癌细胞株中明显下调,并且可通过靶向胰岛素样生长因子1受体(insulin-like growth factor-1 receptor,IGF1R)逆转乳腺癌细胞株对曲妥珠单抗的耐药性。然而,miRNA通常是在肿瘤发生的过程中通过多靶点、多信号通路发挥其作用的,miR-375是否会靶向影响EMT信号通路上的分子而发挥作用尚不清楚。因此,本研究将通过预测miR-375与EMT相关分子Yes相关蛋白1(Yes-associated protein 1,YAP1)的相互作用,分析两者的靶向关系,初步探讨miR-375通过调控EMT相关基因在乳腺癌细胞对曲妥珠单抗的耐药性中发挥的作用及分子机制。
1 材料和方法
1.1 细胞系、组织标本及主要试剂
HER2阳性乳腺癌细胞系SK-BR-3、人胚肾293T细胞(HEK-293T)均购自美国典型培养物保藏中心,人乳腺癌曲妥珠单抗耐药细胞株SK-BR-3R为空军军医大学白文栋博士诱导并赠送[6],诱导方法为HER2阳性乳腺癌细胞系SKBR-3用含5 μg/mL的曲妥珠单抗及10%胎牛血清的RPMI-1640培养液压力筛选6个月,所存活细胞即认定为耐药细胞株。
选取2017年1—6月在福建省肿瘤医院乳腺外科手术切除的25例乳腺癌患者肿瘤组织标本,冻存于液氮罐中。组织标本术后经病理学检查确诊为乳腺癌。所有患者均签署知情同意书,本方案经福建省肿瘤医院伦理委员会批准。
聚合酶链反应(polymerase chain reaction,PCR)引物、重组载体、miR-375 mimic及其对照均购自上海吉玛制药技术有限公司,LipofectamineTM2000购自美国Invitrogen公司,反转录试剂盒购自德国Qiagen有限公司,MTT试剂盒购自上海江林生物科技公司,蛋白抗体一抗[YAP1、波形蛋白(vimentin)、E-钙黏蛋白(E-cadherin)、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)]均购自美国CST公司,二抗(辣根过氧化物酶标记)购自武汉艾美捷科技有限公司。注射用曲妥珠单抗(440 mg/瓶)购自美国Roche公司(批号N3742),配制方法:无菌称取曲妥珠单抗5 mg,溶解于1 mL稀释液中,配制成5 mg/mL的母液待用,使用时用含10%胎牛血清的RPMI-1640培养液稀释至5 μg/mL的工作浓度即可。
1.2 细胞培养及转染
乳腺癌耐药细胞株SK-BR-3R由含曲妥珠单抗(5 μg/mL)和10%胎牛血清的RPMI-1640培养液培养,SK-BR-3及HEK-293T细胞系由10%胎牛血清的RPMI-1640培养液培养。当细胞贴壁60%时,更换为无血清RPMI-1640培养基培养1 h,加入5 μL LipofectamineTM2000和20 nmol/L的miR-375 mimic(或NC mimic或pcDNA3.1-YAP1-MUT)。转染6 h后更换含10%血清的RPMI-1640培养液培养48 h,进行后续实验。
1.3 MTT实验检测细胞增殖能力
取各组细胞,制成细胞悬液(密度为8×104个/mL)后,接种于96孔板(200 μL/孔)上,再加入含曲妥珠单抗浓度分别为0、1、2、3、4、5 μg/mL的细胞培养液各100 μL,每个质量浓度设4个复孔。分别培养1、2、3 d后,加入0.5%MTT 4 h后,上酶标仪检测,根据测得的吸光度(D)值绘制生长曲线。
1.4 H-E染色细胞形态学观察
细胞爬片后,用磷酸盐缓冲液(phosphatebuffered saline,PBS)洗3次。加入95%乙醇溶液,固定20 min,PBS洗3次。加入苏木精染液,染色2~3 min,放在自来水下,进行冲洗。使用伊红进行浸染,1 min后,放在自来水下,进行冲洗。自然晾晒,至风干后,加入中性树胶进行封片。显微镜下拍照。
1.5 平板克隆形成实验
将各组细胞接种于6孔板(500个/孔组和2 000个/孔组)上,将以上细胞置于37 ℃、CO2体积分数为5%的培养箱中培养至肉眼可见的克隆为止,加入甲醇,固定15 min,用吉姆萨染色20 min,自来水冲洗并拍照。
1.6 实时荧光定量PCR(real-time fluorescence quantitative PCR,RTFQ-PCR)检测miR-375及EMT相关基因的表达水平
各组细胞或组织提取RNA,紫外分光光度计检测其纯度、浓度和完整性,用反转录试剂盒合成cDNA,进行RTFQ-PCR检测。miR-375正义链为5’-TTTGTTCG TTCGGCTCGCGTGA-3’,反义链为通用引物(由美国Invitrogen公司反转录试剂盒提供);E-cadherin正义链为5’-AGTCACTGACA CCAACGATAAT-3’,反义链为5’-ATCGTTG TTCACTGGATTTGTG-3’;Vimentin正义链为5’-AGTCCACTGAGTACCGGAGAC-3’,反义链为5’-CATTTCACGCATCTGGCGTTC-3’;YAP1正义链为5’-TAGCCCTGCGTAGCCAGT TA-3’,反义链为5’-TCATGCTTAGTCCACT GTCTGT-3’;反应条件95 ℃ 5 min;95 ℃15 s,60 ℃ 30 s,72 ℃ 1 min,共38个循环。采用2-ΔΔCt法计算各基因mRNA的相对表达量。
1.7 蛋白质印迹法(Western blot)
取各组细胞,提取细胞总蛋白,取蛋白每孔上样100 μg,进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecylsulphate polyacrylamide gel electrophoresis,SDS-PAGE)1 h,将分离获得的蛋白条带电转至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜上,用5%的脱脂奶粉封闭,分别加入鼠抗人vimentin、E-cadherin、GAPDH和YAP1的一抗(体积稀释比例均为1∶1 000),4 ℃过夜。洗膜后加入羊抗鼠二抗(体积稀释比例为1∶10 000),加入电化学发光(electrochemical luminescence,ECL)发光剂显影,用凝胶成像仪保存图像并分析各条带的灰度值,以GAPDH作内参计算相对表达量。
1.8 双荧光素酶报告基因实验
应用生物信息学软件TargetScan、miRDB对miR-375的靶基因进行预测,对靶基因YAP1进行分析。将miR-375 mimic和pGL3-YAP1重组载体共转染HEK-293T细胞,分别为:miR-375 mimic与YAP1-WT、NC与YAP1-WT以及miR-375 mimic与YAP1-MUT、NC与YAP1-MUT。培养48 h后,加入PBS裂解,离心后取上清液加入白色不透明的96孔板上,避光应用双荧光素酶检测系统计算相对荧光素酶活性。
1.9 统计学处理
采用SPSS 23.0软件进行统计学处理。每组实验重复3次,计量资料以x±s表示。多组间比较采用单因素方差分析,两两比较采用LSD-t检验。两组间比较采用独立样本t检验,相关性采用Person相关系数描述。P<0.05为差异有统计学意义。
2 结果
2.1 miR-375在乳腺癌曲妥珠单抗耐药细胞株中低表达
MTT实验检测显示,在曲妥珠单抗药物的存在下,与亲本的SK-BR-3细胞系相比,耐药株SK-BR-3R具有良好的生长特征,D值在两种细胞株中差异有统计学意义(P<0.01);并且平板克隆形成实验显示,耐药株SK-BR-3R具有更强的克隆形成能力(P<0.01)。以上结果提示,SKBR-3R对曲妥珠单抗具有稳定的耐药性,并且具有更强的增殖能力。RTFQ-PCR检测结果显示,与亲本SK-BR-3细胞系相比,miR-375的表达水平显著降低(P<0.001,图1)。
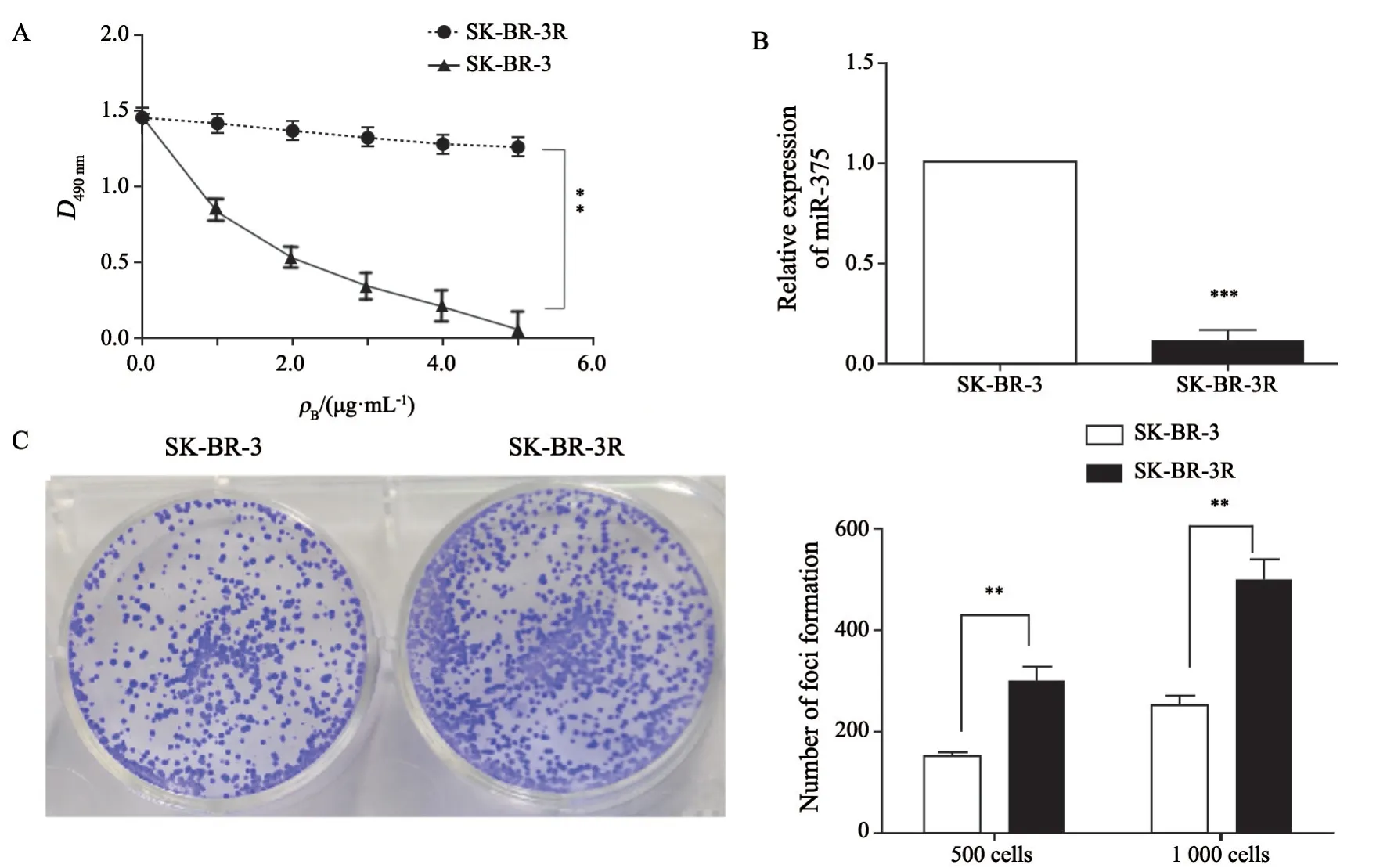
图1 SK-BR-3R细胞株对曲妥珠单抗的药物敏感性的变化及miR-375的低表达Fig.1 Change of trastuzumab sensitivity in SK-BR-3R cells and low-expression of miR-375
2.2 乳腺癌曲妥珠单抗耐药细胞株发生EMT
Western blot与RTFQ-PCR实验结果显示,与亲本SK-BR-3细胞系相比,耐药株SK-BR-3R中EMT标志蛋白vimentin在蛋白水平和mRNA水平上的表达量均上调(P<0.01),而E-cadherin在蛋白水平和mRNA水平上的表达量均下调(P<0.01,图2A、B)。而对两种细胞株的H-E染色结果显示,与亲本细胞系相比,耐药细胞株SK-BR-3R在细胞形态学上发生了明显改变(图2C)。以上结果提示,与亲本细胞系相比,乳腺癌曲妥珠单抗耐药细胞株SK-BR-3R具备了EMT的特征。
2.3 转染miR-375 mimic对乳腺癌曲妥珠单抗耐药细胞株药物敏感性的影响
对耐药株分别转染miR-375 mimic和NC后,分别检测其mRNA的表达量,以及对曲妥珠单抗的耐药性和平板克隆形成能力。与NC组比较,RTFQ-PCR检测结果显示,miR-375 mimic组在SK-BR-3R细胞中miR-375表达显著升高(P<0.001,图3A);MTT实验检测结果显示,转染了miR-375 mimic的耐药细胞株在曲妥珠单抗存在的情况下,其增殖能力显著下降(P<0.01,图3B);而平板克隆形成实验显示,其克隆形成能力也显著下降(P<0.01,图3C)。以上结果提示,与NC组相比,上调miR-375的表达量可以增加耐药细胞株对曲妥珠单抗的药物敏感性,并且其增殖能力受到显著抑制。
2.4 转染miR-375 mimic可逆转乳腺癌曲妥珠单抗耐药细胞株的EMT

图2 SK-BR-3R细胞株具有EMT特征Fig.2 EMT characteristics of SK-BR-3R cells
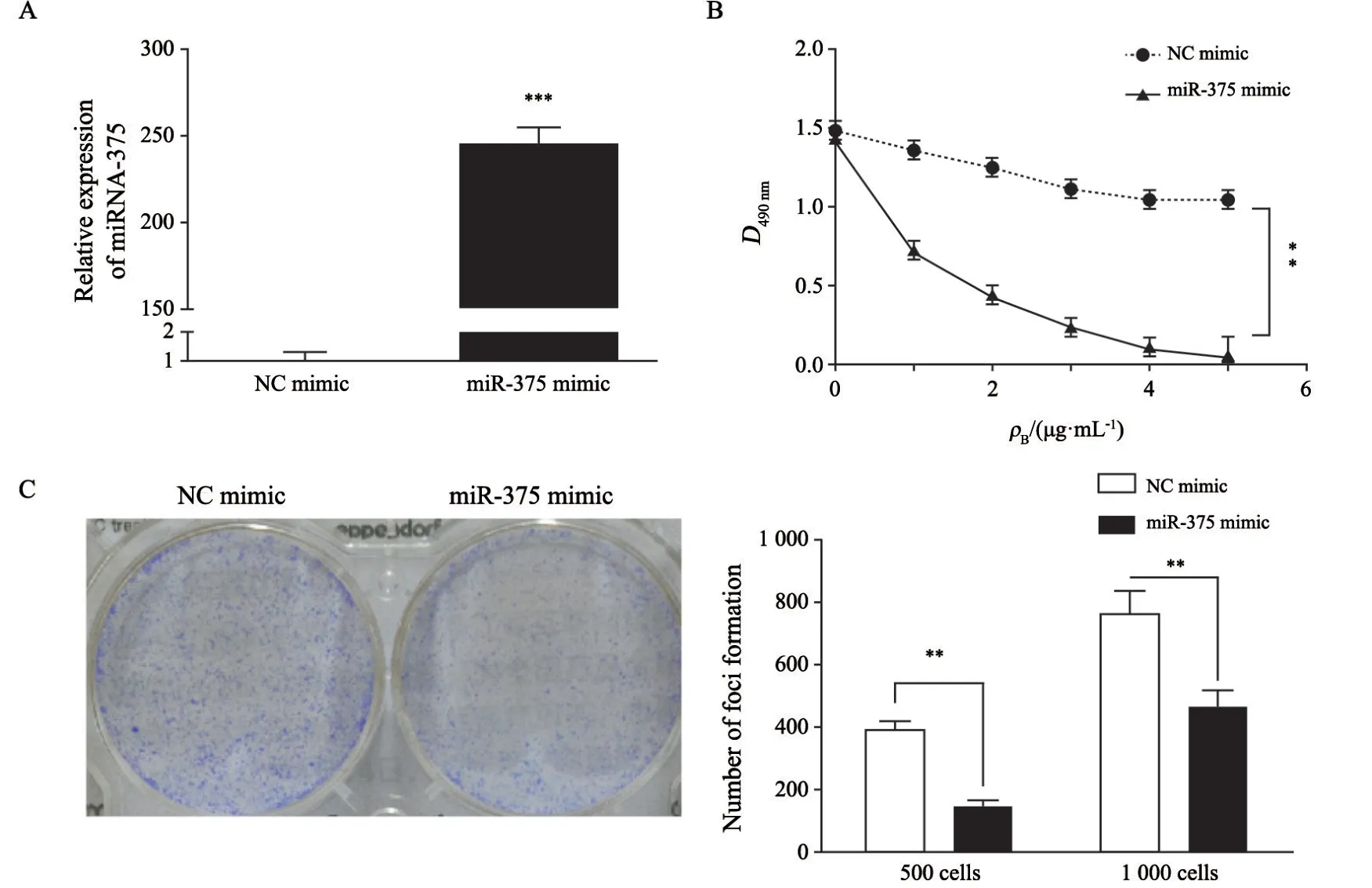
图3 转染miR-375对SK-BR-3R细胞曲妥珠单抗药物敏感性的影响Fig.3 Effect of miR-375 on trastuzumab sensitivity in SK-BR-3R cells
进一步采用Western blot对EMT标志蛋白进行检测,与NC组比较,miR-375 mimic组的vimentin表达量明显下调(P<0.05),同时E-cadherin表达量明显上调(P<0.05,图4A)。RTFQ-PCR实验检测结果显示,在mRNA水平上,vimentin表达量明显下调(P<0.01),同时E-cadherin表达量明显上调(P<0.01,图4B)。以上结果提示,上调miR-375的表达量可以逆转曲妥珠单抗耐药细胞的EMT特性。

图4 转染miR-375对SK-BR-3R细胞EMT 特征的影响Fig.4 Effect of miR-375 on EMT in SK-BR-3R cells
2.5 YAP1与miR-375的靶向关系
通过生物信息学软件TargetScan、miRDB预测miR-375的靶基因,发现其与EMT相关基因YAP1的3’-UTR存在结合位点(图5A)。荧光素酶报告基因实验显示,miR-375 mimic与YAP1-WT共转染组的细胞荧光信号显著低于NC组(P<0.01),而miR-375 mimic与YAP1-MUT共转染组的细胞荧光信号与NC组比较差异无统计学意义(P>0.05,图5B)。以上结果提示,miR-375能够特异性地与YAP1的3’-UTR发生靶向结合。
对25例乳腺癌患者组织标本通过RTFQ-PCR进行了miR-375和YAP1表达量的检测,Person相关分析显示,乳腺癌组织中miR-375和YAP1在mRNA水平上呈负相关(r=-0.586 8,P=0.002 6,图5C)。
2.6 miR-375靶向YAP1对细胞药物敏感性以及EMT特性的影响
对耐药株进行miR-375 mimic和pcDNA3.1-YAP1-MUT共转染,通过Western blot检测,与miR-375 mimic组相比,在共转染的耐药株中,EMT标志蛋白vimentin和E-cadherin的表达均得到了恢复(P<0.05,图6A),并且其对曲妥珠单抗的药物敏感性(P<0.01,图6B)和平板克隆形成能力也得到了恢复(P<0.05,图6C)。以上结果提示,miR-375是靶向YAP1来发挥作用的。
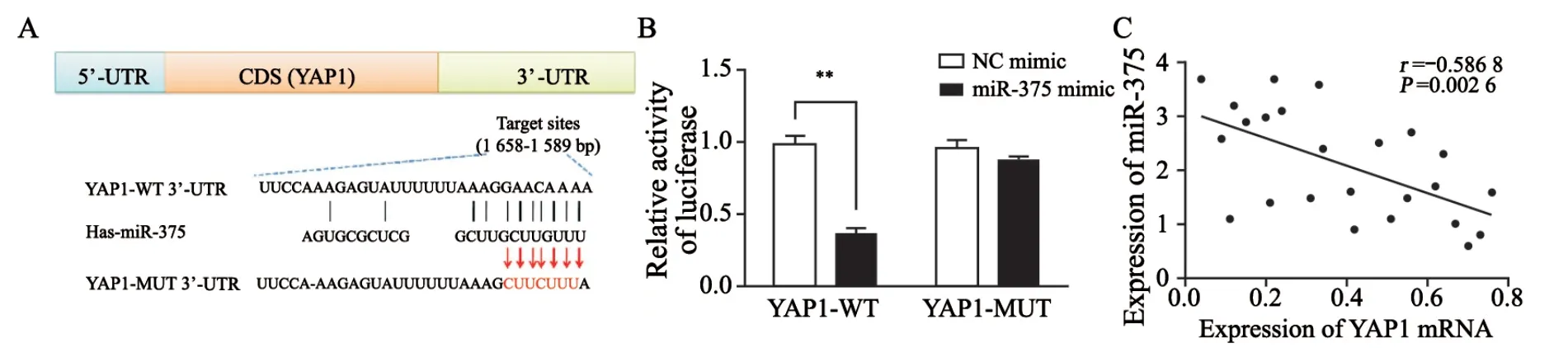
图5 miR-375靶向下调YAP1的表达Fig.5 miR-375 down-regulated the expression of YAP1
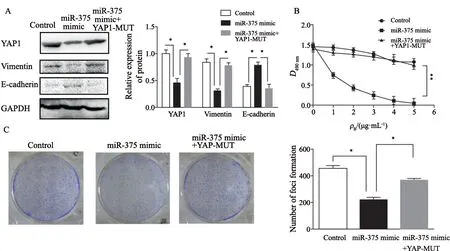
图6 miR-375靶向YAP1对SK-BR-3R 细胞药物敏感性及EMT特征的影响Fig.6 Effect of miR-375 targeting YAP1 on trastuzumab sensitivity and EMT characteristics in SK-BR-3R cells
3 讨 论
抗体药物已被广泛用于各种肿瘤治疗。临床发现,不少初始治疗有效的单抗很快就会因发生耐药而失效,导致抗癌疗效不持续,复发转移频发,患者的5年生存率未得到改善,研究抗体药物的耐受机制及如何使其逆转是当前抗癌领域的重点。本研究从miRNA角度出发,探讨miR-375通过靶向调控YAP1基因,促进细胞EMT特性的逆转,进而参与调控乳腺癌细胞对曲妥珠单抗的药物敏感性。
miR-375作为一种肿瘤抑制miRNA,已被证实在多种肿瘤中表达下调,并且通过靶向许多重要癌基因如AEG-1、IGF1R和PDK1来发挥其核心抑癌特性[7-9]。在肿瘤中,miR-375的改变是由多种机制引发的,包括转录因子失调、启动子异常甲基化等[10-11],其在组织中的低表达或低循环可能提示许多恶性肿瘤较差的预后。miR-375因其在体内外抑制肿瘤生长的特性进一步为发展中的靶向治疗提供了方向。本研究发现,在乳腺癌曲妥珠耐药细胞株中,miR-375发生了明显的下调,这与前期的miR-375与肿瘤相关的报道[7-9]一致。
EMT已知在肿瘤的发展、转移和药物耐受中扮演着重要角色。尽管EMT和肿瘤转移中的因果关系存在争议,EMT在肿瘤耐药方面已被不断认知,包含了在肿瘤细胞药物耐受过程中许多EMT相关通路。发生EMT的细胞同时被证明具有肿瘤干细胞样特征,如药物外排和抗凋亡影响[12-14]。因此,靶向EMT已经被认为是攻克药物耐受的一个新途径。Wu等[4]研究发现,在HER2阳性肿瘤耐药细胞株中伴随有EMT样改变并与Wnt/β-catenin信号通路激活相关,提示在曲妥珠单抗耐药的过程中,EMT可能发挥作用。本研究结果显示,与亲本敏感细胞系相比,耐药细胞株的间质标志蛋白vimentin水平上调,而上皮标志蛋白E-cadherin水平下调,提示乳腺癌细胞对曲妥珠单抗耐药的同时具有EMT特性,与Wu等[4]的研究结果相一致。
YAP1作为在Hippo通路中扮演重要角色的转录共激活因子,已被证实是一个促肿瘤靶点[15]。作为一个致癌基因,YAP1基因的mRNA在许多肿瘤细胞内均高表达,并与肿瘤的形成有较强的相关性[16]。越来越多的研究证明,YAP1可以在体外诱导许多细胞株发生EMT[17-20],并且成为乳腺癌转移有力的推动者[21]。miR-375和YAP1的靶向关系在多种肿瘤中已经被报道[22-23]。本研究发现,在乳腺癌患者肿瘤组织中两者呈负相关,且荧光素酶报告基因实验显示,miR-375 mimic和YAP1-WT共转染组细胞荧光信号显著低于其他组,提示YAP1和miR-375存在靶向调控关系。在乳腺癌耐药细胞株中分析miR-375靶向YAP1的生物学功能发现,miR-375通过靶向调控YAP1而参与曲妥珠单抗耐药细胞株的EMT和药物敏感性的变化。
综上所述,miR-375作为一种肿瘤抑制因子,可通过靶向YAP1的表达对曲妥珠单抗耐药细胞株的EMT进行调控,从而逆转其EMT特性和药物敏感性。从EMT角度来探讨HER2阳性乳腺癌细胞耐药的发生,有望为临床解决曲妥珠单抗的耐药提供新的途径和治疗靶点。

