D-氨基酸对混合菌生物腐蚀的缓蚀行为影响分析
胥聪敏 王文渊 刘 利 宋鹏迪 高豪然 陈月清
1.西安石油大学·材料科学与工程学院 2.中国石油长庆油田公司第六采气厂
0 引言
微生物腐蚀(MIC)在油气工业中普遍存在,常常以厌氧的硫酸盐还原菌(SRB)和好氧的铁细菌(IOB)为主[1-3]。由MIC 所引起的危害造成了巨大的经济损失[4],目前欧美等国家主要的防治方法是投加化学杀菌剂四羟甲基硫酸磷(THPS),其具有良好的性能、较高的热稳定性,是一种广泛应用于油气工业的绿色杀菌剂[5-8]。SRB 以及IOB 会附着在金属表面形成生物膜,生物膜通过防御机制保护固着在金属表面的细菌,使得处理固着的细菌比浮游细菌更加困难,杀菌剂的使用量往往高出十倍甚至上千倍以上[9],促使细菌产生抗药性,并且处理成本大大提高[10]。因此,对生物膜的处理就成了减缓MIC 的关键。
为了解决这一问题,学者们发现D-氨基酸具有抑制人体致病菌生物膜的形成以及促进成熟生物膜解体的功能,其可用作杀菌剂增强剂来减缓剂量的提升。Kolodkin-Gal 等[11]提出了一种不同的解释D-氨基酸分解生物膜的机理,他们认为D-氨基酸是通过干预枯草芽孢杆菌的蛋白合成来间接抑制生物膜的形成。Wade 等[12]研究发现即使低浓度的D-氨基酸也能分解生物膜。Kao 等[13]测试了D-氨基酸(如D-酪氨酸、D-蛋氨酸、D-色氨酸和D-亮氨酸)对铜绿假单胞菌生物膜形成的影响,发现D-氨基酸只能减缓生物膜的形成,而不能完全阻止生物膜的形成。Li 等[14]发现D-氨基酸混合物单独用于防止和去除油田中难以降解的生物膜效果有限。因此,D-氨基酸处理难以降解生物膜时,需要杀菌剂协助。Xu 等[15]研究了D-氨基酸、THPS 和螯合剂的协同作用,结果表明,这3 种混合物在防止SRB 生物膜形成和去除已形成的SRB 生物膜方面效果显著。
以上研究均表明D-氨基酸对杀菌剂具有明显的增强效果,但所选的菌种却较为单一,无法很好地表征出油气田的实际工作环境。针对以上问题,笔者采用从油气田采出水中培养出来的SRB 与IOB 混合菌种来探究D-氨基酸的杀菌增强效果与减缓金属腐蚀的行为,以期为油气田实际工况下的微生物腐蚀控制提供理论支撑和工程实践指导。
1 试验
1.1 试验材料及菌种
采用碳钢为试验材料,其化学组成如表1 所示。经线切割加工成40 mm×10 mm×2 mm 的片状试样,片状试样用金相砂纸沿横纵向交替打磨至1000 号,打磨完后用95%的无水乙醇清洗,丙酮脱脂,试样处理完后放入干燥皿中备用。实验所采用的杀菌剂为四羟甲基硫酸磷(THPS);D-氨基酸为D-络氨酸(D-tyrosine);菌种来自国内某油气田,通过富集、分离、提纯所得。

表1 碳钢的化学组成表
1.2 溶液配制及腐蚀介质
参照胥聪敏等[16-17]的培养基标准制备方法分别对SRB、IOB 进行培养,SRB 培养基成分为:1.0 gNH4Cl、0.1 gCaCl2·2H2O、0.5 gK2HPO4、2.0 gNa2SO4、2.0 gMgSO4·7H2O、1.0 g 酵母膏、60% 乳酸钠溶液6 mL;IOB 培养基成分为:1.0 gMgSO4·7H2O、1.0 g(NH4)2SO4、1.0 gK2HPO4、0.4 gCaCl2·2H2O、1.0 gNa2NO3、10.0 g 柠檬酸铁铵,分别加蒸馏水至1 000 mL,并在121 ℃下高温灭菌20 min,最后在无菌操作台对SRB、IOB 进行接种。
在150 mL 的消毒密封瓶子中倒入各45 mL 的SRB 与IOB 培养基,各取2.5 mL 富集培养了72 h的SRB 与IOB 菌种接入溶液中,并依次注入不同浓度的杀菌剂与D-tyrosine,在37 ℃±1 ℃的培养箱中进行腐蚀。
1.3 试验方法
1.3.1 失重法
在挂入试样后,开始进行计时,至160 h 后将试样取出,先用小刀将附着在试样上的腐蚀产物膜刮下,用X 射线衍射仪对腐蚀产物膜进行分析。以500 mL 盐酸+500 mL 去离子水+3.5 g 六次甲基四胺配制成除锈液,用软毛刷蘸取除锈液除去试样表面锈迹,再用蒸馏水冲洗,然后用酒精脱水,最后用冷风吹干后放入干燥器,待试样充分干燥后用分析天平称量,以此计算质量损失及腐蚀速率[18]。
1.3.2 细菌计数
对细菌计数采用连续稀释法对浮游细胞计数。使用培养基在稀释培养计数(MPN)的小瓶中进行1∶10 的稀释,将小瓶放入37 ℃下培养。根据阳性反应和稀释倍数对SRB、IOB 进行计数[19]。
1.3.3 电化学试验
电化学试验用美国EG&G 公司生产的M2273,试样为10 mm×10 mm 的方形试片,试样背面用焊锡连接铜导线,用环氧树脂进行密封,用金相砂纸将工作面打磨至1000 号,再用去离子水冲洗,最后用酒精清洗,吹干后放置于干燥皿中备用,电化学阻抗谱测试频率为100 kHz ~10 MHz,施加的正弦波幅值为10 mV,采用Zsimpwin 阻抗软件对测试结果进行拟合和数据处理,极化曲线测试电位范围为 -250 ~300 mV,扫描速率为0.5 mV/s。
1.3.4 表面形貌观察与分析
将腐蚀后的试样在5% 的戊二醛溶液中浸泡30 min,固定生物膜,然后用25%、50%、75%、100%的乙醇逐级脱水,使用JSM-6390A 扫描电镜观察腐蚀后的腐蚀产物形貌,并采用配套的电子能谱(EDS)进行腐蚀产物的成分分析,最后再用Smart Zoom 5型超景深光学数码显微镜来观察清除腐蚀产物后试样表面点蚀坑的深度。
2 试验结果与分析
2.1 失重结果与杀菌率分析
表2 为碳钢在含SRB+IOB 培养基中腐蚀160 h后的失重结果,由表2 可见,在无杀菌剂的环境中腐蚀最为严重,腐蚀速率达到了0.641 mm/a,属于极严重腐蚀;加入单一的D-tyrosine 其杀菌率为0,说明只加入D-tyrosine 时,对溶液中细菌的杀菌效果较差甚至无杀菌效果,但起到了一定的缓蚀作用;在加入单一的THPS 后,腐蚀速率均有所下降,并且随着THPS 的浓度提升,缓蚀率逐渐提升;在THPS 中加入D-tyrosine 后,50 mg/L THPS+1 mg/L D-tyrosine的缓蚀率和杀菌率均效果比100 mg/L THPS 有所提升,甚至在加入10 mg/L THPS+3 mg/L D-tyrosine 后的缓蚀率达到最高(年腐蚀深度为0.173 mm,缓蚀率为73.07%),说明加入D-tyrosine 后,可使杀菌剂的使用量显著降低。
2.2 表面形貌观察与分析
图1 为碳钢含SRB+IOB 培养基中腐蚀160 h 后的扫描电镜(SEM)与X 射线能谱分析(EDS)图,从图1-a1、a2 可见,在无杀菌剂环境中试样表面覆盖了腐蚀产物膜,腐蚀产物膜出现分层现象,且局部出现被内层持续发育的腐蚀产物撑破所产生的裂纹,将局部放大至10 000 倍(X10 000)可见明显的SRB与IOB 所构成的絮状腐蚀产物,EDS 分析结果表明,腐蚀产物除了以铁的氧化物为主外,还伴随着磷化物和硫化物,与其他3 组实验对比,无杀菌剂环境下的硫含量较高。
图1-b1、b2 可见,基体表面的腐蚀产物膜较为平整,无分层现象,并出现取向不定的裂纹,在腐蚀产物膜上还出现颗粒及长条状产物堆积,将局部放大发现这些颗粒及长条状产物是加入THPS 杀死了悬浮在溶液中的细菌后,滞留在腐蚀产物膜上。通过EDS可见,腐蚀产物以铁的氧化物为主,但硫含量明显降低,这说明THPS 起到灭菌效果,使得硫含量降低。
图1-c1、c2 可见,基体表面的腐蚀产物膜比较致密完整,无裂纹出现,这使得腐蚀产物膜在一定程度上相较于图1-b 阻碍了腐蚀阴离子的进入,进而减缓了腐蚀的发生。将局部放大可见SRB 与IOB 所构成的絮状腐蚀产物与图1-a 相比骤减,根据EDS 显示,腐蚀产物以铁的氧化物为主,磷化物和硫化物含量大大减低。

表2 碳钢在含SRB+IOB 培养基中腐蚀160 h 后的失重结果表

图1 碳钢在SRB+IOB 培养基中腐蚀160 h 后的SEM 与EDS 图
图1-d1、d2 可见,腐蚀产物膜出现了深而宽的裂隙,将局部放置高倍镜下可见,与前3 种溶液相比,没有发现SRB 与IOB 的存在,这表明,D-tyrosine可使附着在试样表面上的生物膜快速分解,将固着的细胞转化为浮游态[20],配合溶液中的THPS 有效杀死了细菌,使得腐蚀速率下降,根据EDS 显示,受到D-tyrosine 影响,此时硫化物含量最低。
图2 是碳钢在不同环境中腐蚀160 h 后的SEM图,可见无杀菌剂的腐蚀产物膜较为致密且裂隙出现;而加入D-tyrosine+THPS 后(图2-b),由于D-tyrosine 对生物膜起到了较好的分解作用,与图2-a相比,腐蚀产物膜疏松并较易脱落,膜上出现了较多的裂隙,进一步说明D-tyrosine 对生物膜起到了较好的分解与剥离作用。

图2 碳钢在不同环境中腐蚀160 h 后的SEM 图

图3 碳钢在SRB+IOB 培养基中腐蚀160 h 后去除腐蚀产物后宏观形貌图

图4 碳钢在SRB+IOB 培养基中腐蚀160 h 后去除腐蚀产物后的超景深光学显微镜图
图3、4 分别是碳钢在SRB+IOB 培养基中腐蚀160 h 后去除腐蚀产物后宏观形貌和超景深光学显微镜图片。由图3、4 可见,在无杀菌剂环境下,试样表面存在较为密集细小的蚀孔(图2-a、3-a),腐蚀较为严重,有研究表明[21],高浓度的胞外聚合物(EPS)对Fe2+具有络合作用,进而促进试样表面的阳极溶解,故无杀菌剂环境下最大点蚀坑深度可达5.2 μm;在加入了THPS后蚀孔数量均明显减少(图3-b、c和4-b、c),最大点蚀坑深度也逐渐减小,腐蚀程度与无杀菌剂环境下相比得到减缓;由图3-d、4-d 可见,试样表面蚀孔数量显著降低,最大点蚀坑深度减小至1.1 μm,Jia等[22]研究表明,在MIC 中,点蚀坑深度比重量损失更重要,因为MIC 所引发的事故通常是由针孔泄漏所导致的。由此可见D-tyrosine 与THPS 起到了很好的协同作用,将附着在试样表面的细菌转化为浮游态并将其杀死,虽然腐蚀产物膜裂缝较大(图1-d1),会吸附较多的腐蚀性离子进入,但SRB 与IOB 引起的腐蚀却显著降低,使得总体的腐蚀速率下降。
2.3 XRD 分析
图5 为碳钢在SRB+IOB 培养基中腐蚀160 h 后腐蚀产物的X 射线衍射(XRD)图。
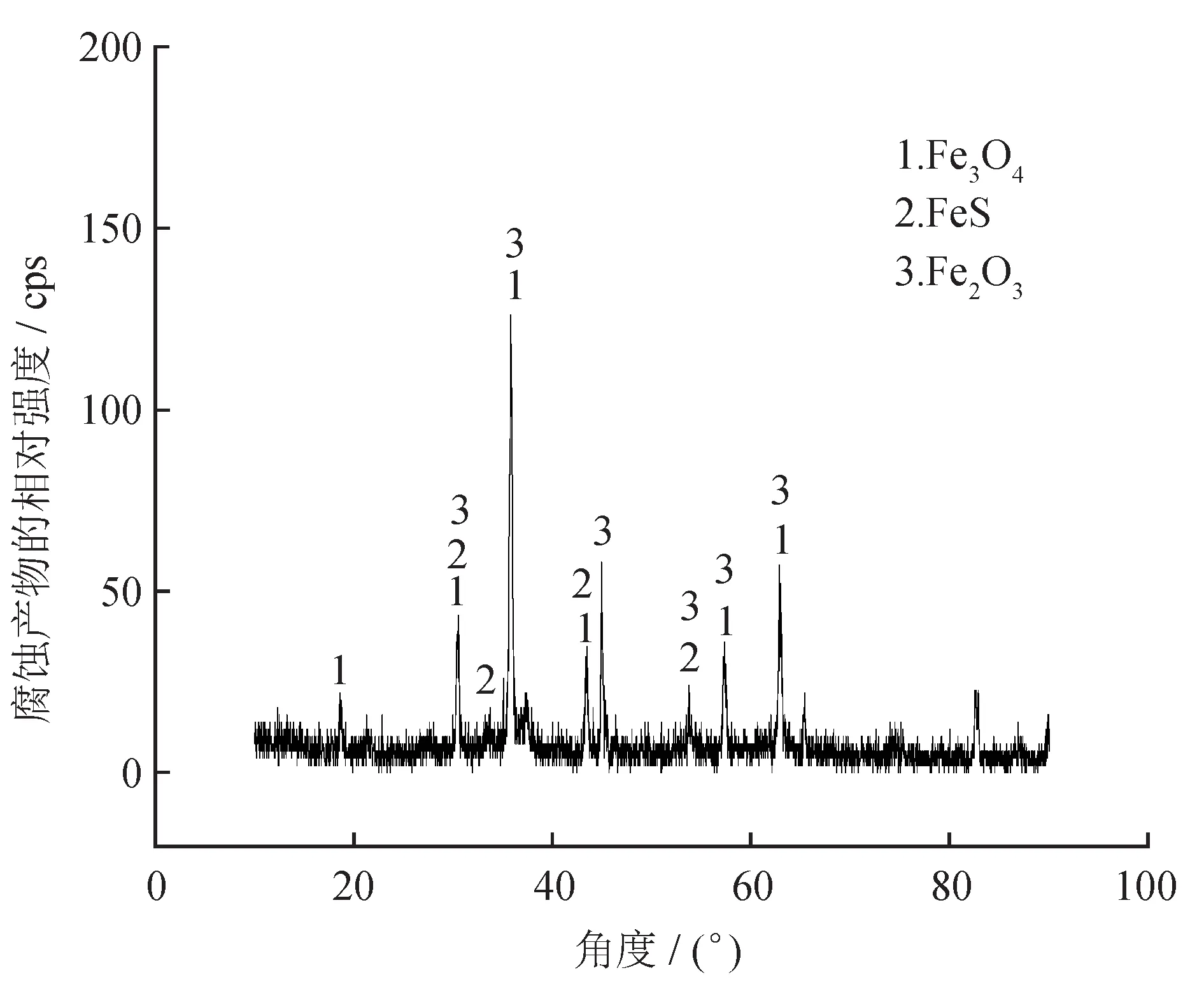
图5 碳钢在SRB+IOB 培养基中腐蚀160 h 后腐蚀产物的XRD 图
4 种环境下的腐蚀产物均为Fe3O4、FeS、Fe2O3,这是因为在硫酸盐充足的条件下,碳氢化合物和脂肪酸(例如甲酸盐、丙酮酸盐、醋酸盐、甲醇和乳酸)为SRB 在新陈代谢提供能量,并且SRB 在代谢过程中以SO为电子受体,氧化有机物,并从中获取维持生命活动所需的能量,将SO还原成H2S[23]:
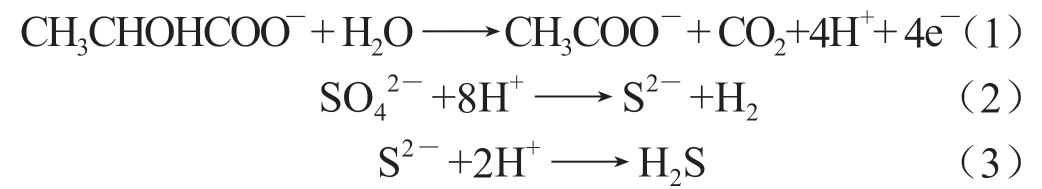
其次SRB 产生的S2-与Fe2+相互作用,生成铁的硫化物,附着在铁表面上,形成阴极,与Fe 阳极形成浓差电池,加剧了金属的腐蚀:

铁细菌能把水中的Fe2+氧化成Fe3+,而沉积于菌体鞘内或菌体周围,形成包含菌体和氢氧化高铁等组分在内的结瘤,结瘤下部缺氧区作为阳极区,结瘤周围作为阴极区,阳极区溶解出的Fe2+向外扩散生成Fe(OH)2,由于Fe(OH)2并不稳定,使得Fe2+转变为Fe3+,产生FeOOH 与Fe(OH)3[24-25]:
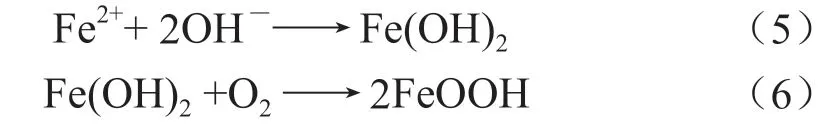
而到达表层的Fe3+,被IOB 氧化,生成Fe(OH)3红棕色沉淀,产生能量,附着在试样表面上形成锈瘤,与SRB 相互作用,加剧点蚀的发生:
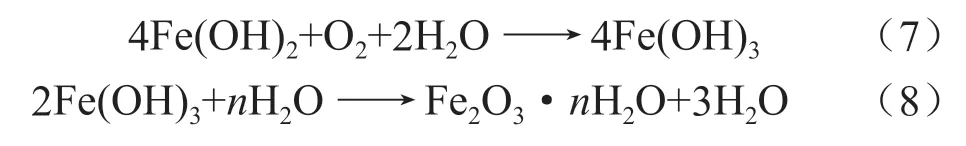
2.4 极化曲线分析
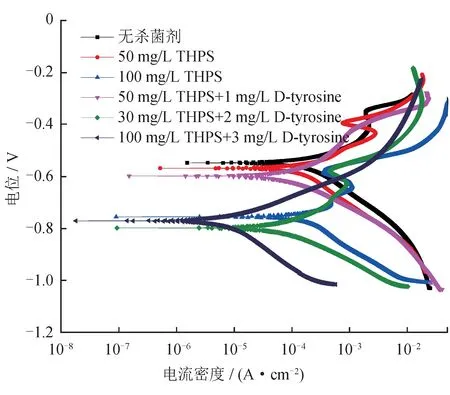
图6 碳钢在SRB+IOB 培养基中腐蚀160 h 后的极化曲线图
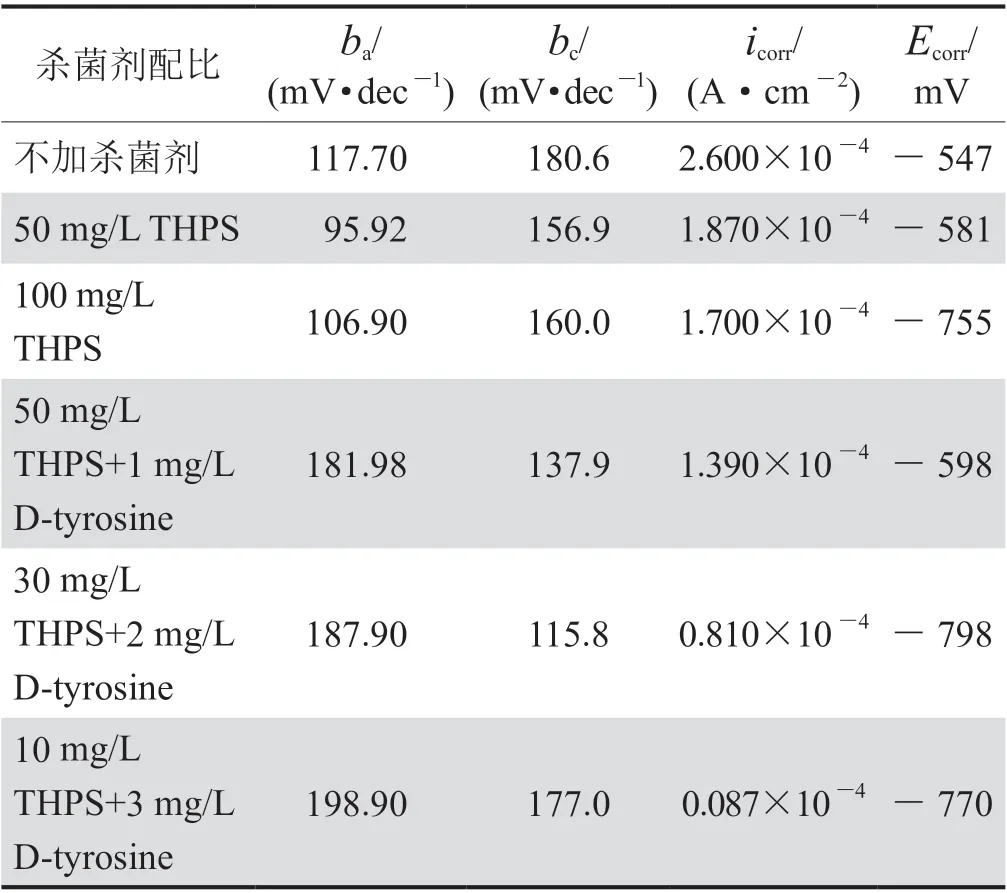
表3 碳钢在SRB+IOB 培养基中腐蚀160 h 后的 Tafel 拟合结果表
图6 与表3 分别是碳钢在含SRB+IOB 培养基中腐蚀160 h 后的极化曲线和Tafel 拟合结果,可此可见,无D-tyrosine 加入时阳极区均出现活化—钝化转换区;在无杀菌剂环境下,自腐蚀电流密度达到2.6×10-4A/cm2,这主要是由于SRB 与IOB 代谢生成了硫化亚铁、铁的氧化物以及生物膜,附着在试样表面,促进金属阳极溶解,诱发点蚀,从而加速了钢的腐蚀,使腐蚀电流达到最大;在加入杀菌剂后,随着D-tyrosine 含量的提升,阳极斜率(ba)逐渐增大,曲线呈现出左移趋势,腐蚀电流逐渐减小,试样表面点蚀逐渐减少,这说明THPS 与D-tyrosine 的加入后,可减缓阳极溶解,从而降低腐蚀速率,对金属起到较好的保护作用。
为了进一步探究THPS 和THPS+D-tyrosine 对金属腐蚀的影响,根据以下公式计算了抑制效率(IE)[26]:

式中i无杀菌剂表示无杀菌剂环境下试样的自腐蚀电流密 度,A/cm2;i 表 示 存 在THPS 或THPS+D-tyrosine 的试样的自腐蚀电流密度,A/cm2。腐蚀160 h后,50 mg/L THPS 与100 mg/L THPS 的IE 值 分 别为28.07%和34.6%;而加入D-tyrosine 后,10 mg/L THPS+3 mg/L D-tyrosine 的IE 值可高达96.7%,可见THPS+D-tyrosine 的IE 值高于添加单一THPS 时的IE 值,说明D-tyrosine 的加入增强了THPS 对钢试件腐蚀的抑制作用。
2.5 EIS 分析
图7 是碳钢在含SRB+IOB 培养基中腐蚀160 h后的奈奎斯特(Nyqusit)和Bode(Bode 表示阻抗模量,相位角随频率的变化)图。由图7 可见,在腐蚀24 h、72 h、160 h 后,容弧抗半径排序均为无杀菌剂<只添加单一的THPS <THPS+D-tyrosine,说明两者的添加均可有效减缓腐蚀的发生,并且D-tyrosine 增强了THPS 的缓蚀作用,这与上述分析相吻合;从腐蚀160 h 的Bode 图可见,EIS 出现一个时间常数,表明碳钢在含SRB+IOB 培养基中发生了单一的腐蚀,随着THPS 和D-tyrosine 的添加,最大相位角向高频区发生移动,这与试样表面腐蚀产物膜有关。
EIS 数据均采用图8 所示等效电路Rs(Qf(Rct))与Rs(Qf(Rf(QdlRct))) 进行拟合。其中,Rs表示溶液电阻,Ω·cm2;Rf表示生物膜/腐蚀产物膜的电阻,Ω·cm2;Rct表示电荷转移电阻,Ω·cm2;Qf表示生物膜/腐蚀产物膜的电容;Qdl表示双电层电容。

图7 碳钢在SRB+IOB 培养基中腐蚀160 h 后的Nyqusit 和Bode 图
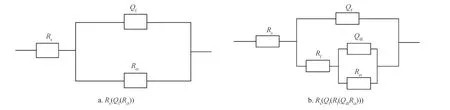
图8 EIS 数据拟合的等效电路模型图

表4 碳钢在SRB+IOB 培养基中腐蚀160 h 后的EIS 拟合结果表
EIS 拟合得到的等效电路的参数值如表4 所示。可见,在腐蚀24 h、72 h 和160 h 后,与无杀菌剂相比,加入THPS 与THPS+D-tyrosine 后,用Yf表示电极表面膜的大小,则Yf呈现出逐渐减小的趋势[27],这是由于THPS 抑制了SRB 与IOB 代谢所形成的硫化物、铁氧化物,阻碍了电荷转移,使得试样表面的导电性与无杀菌剂时相比大大降低,再加入D-tyrosine后,其对抑制生物膜形成及促进其解体具有较好的效果,所以导致Yf的值逐渐降低;nf为电极表面的粗糙程度和腐蚀电流不均匀的程度[28],在腐蚀160 h后,THPS+D-tyrosine 的nf最小,这也是由于D-tyrosine对抑制生物膜形成,使固着在试样表面的SRB 与IOB 转变为浮游态,从而使试样表面与无杀菌剂和添加单一THPS 相比无较多生物膜,故而nf值由0.887降至0.830,最后降至0.720。
图9 是碳钢在SRB+IOB 培养基中腐蚀160 h 后Rp-1的变化规律,Rp表示极化电阻,Rp-1表示极化电阻负相关,对于R(Q(R(QR)))电路模型,可以通过以下方程来计算电化学阻抗谱测量:

根据法拉第第二定律:腐蚀电流密度与极化电阻(Rp)成反比,即Rp-1越大表示腐蚀速率越快。可见,在腐蚀24 h、72 h、160 h 后均为无杀菌剂的Rp-1值最高,表示腐蚀最严重,加入THPS+D-tyrosine 后的Rp-1值均最低,表示腐蚀最轻;此外,腐蚀160 h 后在3 种环境下的腐蚀速率相较于腐蚀4 d 后要高,这是由于在腐蚀初期(1 ~72 h),SRB 代谢生成的胞外聚合物EPS 抑制了碳钢的腐蚀,而在160 h 后细菌所生成的代谢产物又显著促进了腐蚀,故使得腐蚀160 h 后腐蚀速率较72 h 显著提升。
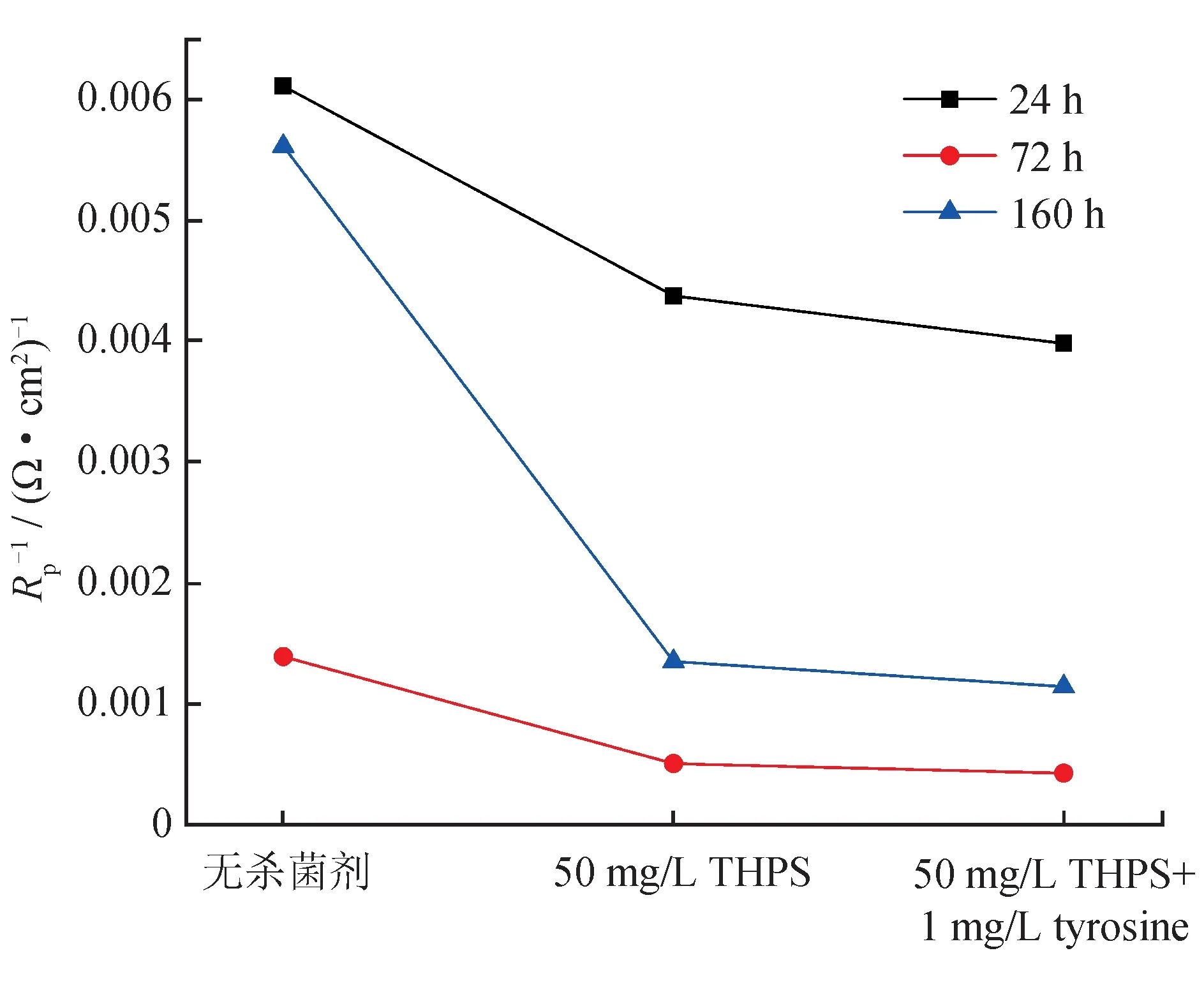
图9 碳钢在SRB+IOB 培养基中腐蚀后的Rp-1 折线图
3 分析与讨论
从SEM 图中可以看出,在无杀菌剂环境下,SRB 与IOB 协同作用加剧腐蚀的发生,根据生物催化阴极硫酸盐还原(BCSR)理论,理论假设铁氧化释放的电子通过SRB 传输,还原了SRB 中的硫酸盐,从而导致腐蚀的发生,如下面的反应所示:
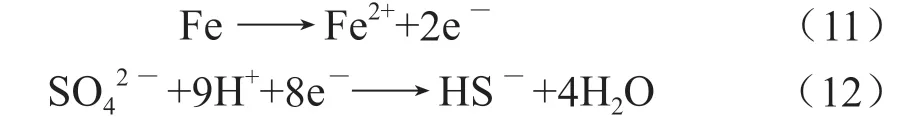
在BCSR 理论中,铁氧化释放的电子通过细胞壁从细胞外转移到SRB 细胞质并使还原了硫酸盐,因此,释放的电子需要穿过SRB 细胞壁进行传输,而生物膜作为碳源扩散的屏障,在其顶层可以消耗一定量的碳源,而生物膜底层固着细胞所含有机碳较少,导致固着在金属表面的细胞缺乏良好的生长环境,此时,缺乏碳源的SRB 将转换为元素Fe 作为电子供体,产生维持所需的能量。再加上IOB 在试样表面上附着形成了结瘤,结瘤下部成为贫氧的阳极区,结瘤周围成为富氧的阴极区,从而构成氧浓差电池,并且由于结瘤对氧气形成阻碍,使环境中的氧气很难扩散至试样表面,这也为厌氧的SRB 繁殖提供了良好条件,进而加剧了腐蚀,同时由于SRB 去极化作用及产生的硫化物,进一步加剧了腐蚀;此外,从图1-a1 可见,腐蚀产物膜存在较多的裂隙,较易吸附腐蚀性Cl-进入,从而促进了点蚀的生成,并且Cl-与H+结合,形成HCl,造成酸化自催化效应,加上SRB、IOB 与Cl-三者发生协同作用,致使腐蚀加剧,故在3 种环境下无杀菌剂的腐蚀速率达到最高。
而加入THPS+D-tyrosine 后,由于D-tyrosine 对生物膜的分解作用,使得细菌由固着态转化为浮游态,进一步阻碍了SO42-向S2-进行转变,这使电子无法从试样表面转移至溶液中,此外THPS 带正电荷,较易吸附至细菌上,并渗透细菌表面从而进入细胞膜,阻碍细胞膜的半渗透作用,改变了细胞酶与蛋白质的性质,而且THPS 的亲油基团对细胞表面的脂肪壁造成损害,转变细胞膜的物化性质,导致细菌死亡,从而使IOB 在试样表面上所形成的结瘤破裂,破坏了氧浓差电池的腐蚀环境,使腐蚀显著降低,故THPS+D-tyrosine 有效地减缓了腐蚀的发生。
4 结论
1)在无杀菌剂环境下的腐蚀速率达到最高,这是由于铁氧化释放的电子通过SRB 细胞壁传输,还原了SRB 细胞质中的硫酸盐,为SRB 的生长繁殖提供能量,并且IOB 在试样表面上形成结瘤,其下部成为贫氧的阳极区,其周围成为富氧的阴极区,从而构成氧浓差电池,加上Cl-与细菌协同作用,进而加剧了腐蚀。
2) 碳钢在含SRB+IOB的培养基中腐蚀160 h后,添加50 mg/L THPS+1 mg/L D-tyrosine 的溶液缓蚀与杀菌效果最为显著,缓蚀率可达48.07%,对SRB、IOB 的杀菌率分别可达99.54%、91.22%,其效果优于100 mg/L THPS 的杀菌效果和缓蚀作用,说明D-tyrosine 对增强THPS 的杀菌和抑制腐蚀效果显著,也减少了THPS 的使用量。
3)根据EDS 显示,添加50 mg/L THPS+1 mg/L D-tyrosine 的磷化物和硫化物的含量最低,说明D-tyrosine 具有显著分解和抑制生物膜的作用,配合THPS 有效地杀死细菌,从而破坏氧浓差环境,使腐蚀大大降低,试样表面的点蚀坑数量与深度最少。

