3种警犬不同肌肉中PPARGC1A基因的发育性表达研究
李静 万九生 陈超 邓卫东 岳锐 熊和丽 黎立光

摘要 [目的]探究PPARGC1A基因mRNA在昆明犬、马里努阿犬、德国牧羊犬不同肌肉组织中的发育性表达规律,为研究犬的肌肉和运动能力形成机理提供理论参考。[方法]采用实时荧光定量PCR技术检测昆明犬、马里努阿犬、德国牧羊犬3种警犬在6月龄、1岁龄的臀腿肌肉组织中PPARGC1A基因mRNA表达量。[结果]随着年龄的增长,PPARGC1A基因在3种警犬肌肉中呈现逐渐上升的表达趋势。马里努阿犬在6月龄和1岁龄时臀腿肌中的表达量极显著高于昆明犬和德国牧羊犬(P<0.01)。[结论]PPARGC1A基因在肌肉发育和肌内脂肪沉积过程中起着很重要的作用。该研究结果可为探索肌肉发育及肌内脂肪沉积相关研究提供理论参考和研究基础。
关键词 犬;昆明犬;PPARGC1A基因;发育性表达;肌肉组织
中图分类号 S829.2 文献标识码 A 文章编号 0517-6611(2021)04-0092-04
doi:10.3969/j.issn.0517-6611.2021.04.024
Developmental Expression of PPARGC1A Gene in Different Muscles of Three Police Dogs
LI Jing1,2,3, WAN Jiu-sheng1,2, CHEN Chao1,2 et al
(1.Kunming Police Dog Base of the Ministry of Public Security, Kunming, Yunnan 650201;2.Key Laboratory of Police Dog Technology of the Ministry of Public Security, Kunming, Yunnan 650201;3.School of Animal Science and Technology of Yunnan Agricultural University, Kunming, Yunnan 650201)
Abstract [Objective]The aim of this study was to investigate the development expression laws of PPARGC1A gene mRNA in different muscle tissues of Kunming Dog, Malinua Dog and German Shepherd Dog, and provide theoretical reference for studying the formation mechanism of muscle and motor ability of dogs.[Method] The expression quantity of PPARGC1A gene mRNA in the gluteal and leg muscles of Kunming Dog, Malinua Dog and German Shepherd Dog at 6 month-age and 1-year-age was detected by real-time fluorescence quantitative PCR. [Result] PPARGC1A gene was gradually increased in three kinds of muscles with the increase of age. The expression level of gluteal leg muscle in Malinua Dog was significantly higher than that in Kunming Dog and German Shepherd Dog (P< 0.01). [Conclusion] PPARGC1A gene played an important role in muscle development and intramuscular fat deposition. The results of this study could provide theoretical reference and research basis for the study of muscle development and intramuscular fat deposition.
Key words Dog;Kunming Dog;PPARGC1A gene;Developmental expression;Muscle tissue
基金項目 公安部科技强警基础工作专项项目(2018GABJC27,2019GABJC29);云南省科技厅科技计划项目基础研究计划项目(青年项目)(2019FD025)。
作者简介 李静(1989—),女,内蒙古乌兰察布人,助理研究员,博士,从事警犬分子遗传育种研究。通信作者,副研究员,硕士,从事警犬疾病健康研究。
收稿日期 2020-05-18;修回日期 2020-06-06
1998年Puigserver等[1]发现了过氧化物酶体增殖物激活受体γ共激活因子1α,该转录因子作为与自适应产热相关(PPARγ)和PPARγ共激活因子家族PGC-1。作为核受体PPARG的转录共激活因子,它是脂肪细胞分化的主要调节剂。它还可以诱导肌纤维类型从酵解型向有氧代谢型转换,进而改善肉质;另外,还能够与肌肉组织的选择性转录因子肌细胞特异性增强子结合,控制另一肉质候选基因在肌肉组织中的表达[2]。在具有高能量需求并富含线粒体的组织中发现了PPARGC1A mRNA,同时该PPARGC1A蛋白的通用功能使其成为肉品质性状的功能候选基因[3]。同时,在脂肪、肌肉、肾脏、肝脏、大脑、心脏和肾上腺组织中检测到该基因的转录,这与PPARGC1A蛋白在适应性产热方面的功能一致。
笔者以3种国内常用的警犬品種为研究对象,采用实时荧光定量PCR技术,检测PPARGC1A基因在6月龄、1岁龄警犬臀腿肌肉组织中的发育性表达规律,从基因表达水平上探讨PPARGC1A与肌肉发育和骨骼肌对葡萄糖摄取能力,旨在为研究PPAR家族通过抑制葡萄糖氧化和增加葡萄糖吸收来补充肌糖原贮备等机理提供理论依据。
1 材料与方法
1.1 样品采集
试验以昆明犬(KM)、马里努阿犬(MQ)、德国牧羊犬(DM)公犬为研究对象。样品采集于公安部昆明警犬基地。将犬只麻醉后,分别在6月龄和1岁龄时臀大肌和股二头肌各取一小块组织块,立即置于液氮中速冻保存,于-80 ℃冰箱中保存备用,用于RNA的提取。
1.2 主要试剂和仪器
1.2.1 主要试剂。qPCR试剂TSE202(2×T5 Fast qPCR Mix SYBR Green I,北京擎科生物科技有限公司),反转录试剂(TSK302S)RT6 cDNA Synthesis Kit Ver 2(北京擎科生物科技有限公司),无水乙醇、氯仿以及异丙醇等均为分析纯国药试剂。所有枪头以及EP管全部使用AXGEN公司提供的一次性无RNase/DNase耗材。
1.2.2 仪器。实时荧光定量PCR仪(ABI Prism 7500);超微量分光光度计(NanoDrop 2000C);逆转录仪器(郎基A300PCR);凝胶成像系统(Bio-Rad GelDoc XR);凝胶电泳系统(Bio-Rad PowerPac 300);冷冻离心机(Thermo);漩涡振荡仪(Labnet);微量移液器(Eppendorf)。
1.3 引物设计与合成
参考GenBank数据库(https://www.ncbi.nlm.nih.gov/genbank/)中PPARGC1A(实时荧光定量内参基因)基因cDNA引物,使用NCBI网站在线设计引物,用于实时荧光定量PCR(RT-qPCR)。引物浓度为10 μmol/L,引物序列见表1。
1.4 总RNA的提取
①取适量液氮研磨成粉的样品置于1.5 mL Eppendorf管,加入1 mL Trizol试剂,混匀;
②按Trizol∶氯仿5∶1的比例加入氯仿,剧烈振荡15 s,室温静置3 min;4 ℃,12 000 r/min,离心15 min;
③吸取上清置于另一新的1.5 mL eppendorf管,加入等体积的异丙醇,混匀后室温静置20 min;
④4 ℃12 000 r/min离心10 min后,去上清;加入1 mL 4 ℃预冷的75%乙醇,洗涤沉淀;
⑤ 4 ℃10 000 r/min离心5 min,弃上清;4 ℃10 000 r/min再次离心5 min,吸去残液,室温干燥(不需完全干燥);
⑥加入20 μL RNase-free水,直至完全溶解,取1 μL用于琼脂糖凝胶电泳检测。
1.5 反转录获得cDNA产物
进行反转录扩增,按照试剂盒说明书进行加样:混匀后42 ℃孵育2 min,60 ℃孵育5 min,迅速置于冰上冷却,短暂离心后按照试剂盒说明书组分进行加样。混匀后,25 ℃孵育10 min,50 ℃孵育30 min,85 ℃孵育5 min,将反转录产物置于冰上或冷藏备用。
1.6 实时RT-PCR
将10 μL ddH2O稀释至30 μL,作为qPCR模板,按照试剂盒说明书扩增体系加样。扩增体系按以下扩增程序扩增、熔解:
95 ℃预变性1 min;95 ℃10 s,65 ℃5 s,74 ℃10 s,40个循环;
95 ℃15 s;60 ℃1 min,95 ℃15 s,0.3 ℃/20 s。以上扩增循环阶段在72 ℃下采集荧光信号。
1.7 PCR产物鉴定 使用1.0%琼脂糖凝胶进行电泳,利用凝胶成像系统检测PCR电泳结果并拍照。
1.8 数据统计和分析
将RT-PCR结果导出,计算内参、外参以及目的基因的平均Ct值,采用2-ΔΔCt方法计算各组织样品中目的基因的相对表达量。对不同品种、不同阶段PPARGC1A基因的表达量进行比较。使用SPSS 18.0统计软件对同一品种、同一组织中3个时间点的表达量进行单因素方差分析,采用邓肯法进行多重比较,对2个品种间的差异分析采用独立样本t检验。P<0.05表示差异显著,P<0.01表示差异极显著。利用GraphPadPrism5软件进行图表的绘制。
2 结果与分析
2.1 总RNA与反转录检测
由图1可知,从马里努阿犬、昆明犬、德国牧羊犬提取的RNA在电泳中显示28S和18S两条带。
2.2 目的基因标准品的制备
利用琼脂糖凝胶电泳检测到PPARGC1A基因133 bp的目的片段。最后,对PCR产物进行测序,通过琼脂糖凝胶电泳检测PCR扩增产物,如图2所示。
2.3 扩增动力学曲线
该试验采用3个样本重复,对PPARGC1A进行定量分析,扩增动力曲线见图3。
2.4 部分样品的扩增溶解曲线
图4为部分样品扩增溶解曲线,扩增产物Tm值都是单一的峰,没有杂峰,无二聚体或者多聚体产生。
2.5 不同阶段3种警犬体重和臀肌重的比较
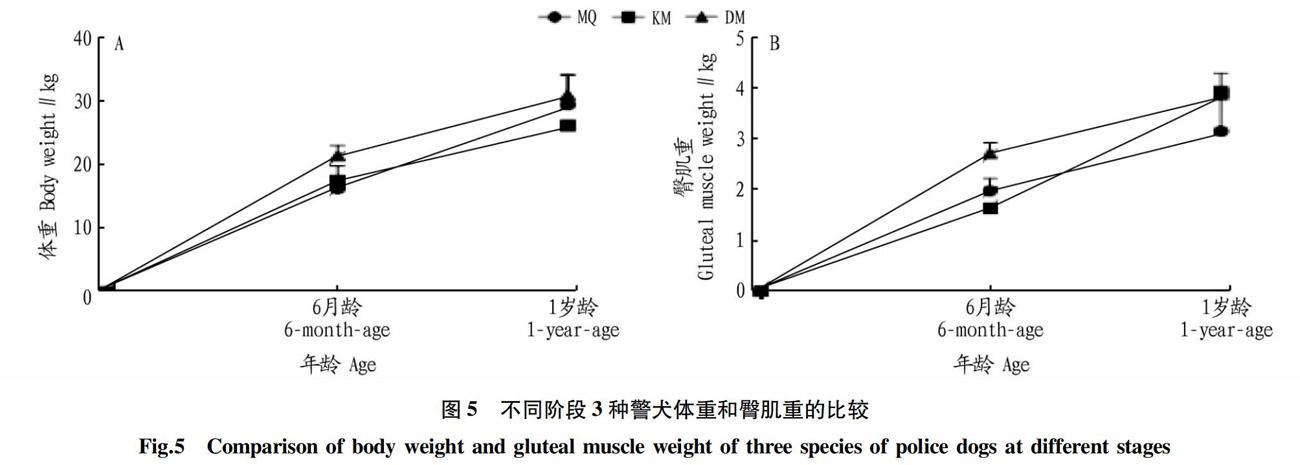
随着日龄的增长,3种警犬的体重、臀肌重均逐渐增加。其中,3种警犬的体重在0~6月龄增长速度最快。随日龄的增长,3种警犬的臀肌重与体重的增长趋势一致(图5A、B)。3种警犬的体重和臀肌重差异不显著(P>0.05)。
2.6 PPARGC1A基因在不同年龄3种警犬臀腿肌中的相对表达量
不同年龄3种警犬臀腿肌中PPARGC1A基因的表达规律如图6所示。从图6可以看出,1岁龄时3种警犬臀腿肌中PPARGC1A基因的表达量与6月龄间差异不显著(P>0.05);6月龄时马里努阿犬(MQ)臀腿肌中PPARGC1A基因的表达量极显著高于昆明犬(KM)和德国牧羊犬(DM)(P<0.01)。1岁龄马里努阿犬臀腿肌中PPARGC1A基因的表达量极显著高于昆明犬和德国牧羊犬(P<0.01),其中PPARGC1A基因在昆明犬肌肉中的表达量最低,德国牧羊犬次之。
3 讨论
RT-PCR是一种灵敏且准确的检测技术,常用于检测基因的表达程度,通过样本进行相对定量RT-PCR,可以比较不同时期样本mRNA表达的差异[4]。过氧化物酶体增殖物激活受体1α(PPARGC1A)是一种转录共激活因子,可以参与机体代谢的多种生物学反应,主要包括线粒体启动、通过调节脂质运输和葡萄糖氧化[5-6]。 PPARGC1A和PPARα在分解脂肪酸的组织中,特别是肝脏、骨骼肌中表达水平较高。在人类中PPARGC1A和PPARα基因作为调节基因,主要通过表达编码参与脂肪酸氧化的几种关键酶和控制氧化磷酸化。研究也表明,耐力训练会增加PPARGC1A的 mRNA水平,因此通过PPARα调节基因表达量可以增强骨骼肌的氧化能力[7-8]。目前,对PPARGC1A基因的研究主要集中于肌纤维类型对肌肉品质的影响研究[9-10]。然而,PRARGC1A在犬肌肉中的表达量及不同发育阶段不同品种犬骨骼肌中的表达规律研究较少。该试验利用RT-PCR对PPARGC1A基因在不同发育阶段马里努阿犬、昆明犬、德国牧羊犬肌肉中的表达量差异进行研究。在该研究中1岁龄时3种警犬臀腿肌中PPARGC1A基因的表达量与6月龄间差异不显著(P>0.05);6月龄时马里努阿犬(MQ)臀腿肌中PPARGC1A基因的表达量极显著高于昆明犬(KM)和德园牧羊犬(DM)(P<0.01)。1岁龄马里努阿犬臀腿肌中PPARGC1A基因的表达量极显著高于昆明犬和德国牧羊犬(P<001)。其中,PPARGC1A基因在昆明犬肌肉中的表达量最低,德国牧羊犬次之。
昆明犬是我国唯一一个自主选育的工作犬品种,体型方正,体尺较高,适应能力广泛,具有狼青、黑背、草黄3种毛色,被广泛用于军警用多种工作犬使用领域。马里努阿犬又称比利时马里努阿犬、马犬,无论因其被毛极短,肌肉发达,爆发力强,工作能力优秀,服从性好,目前在美国、德国、澳大利亚、中国等国家作为通用的军警犬、保镖犬、护卫犬。德国牧羊犬,别名德牧,也就是人们常说的德国狼犬,原产德国一战、二战时期犬已经在德国各地固定下来作为军警犬使用,行动敏捷,且适用于多种工作环境。德国牧羊犬肌肉组织匀称,臀部长,略微向下倾斜,与水平的夹角为23°。从外型来看,马里努阿犬较昆明犬、德国牧羊犬肌肉结构更加紧凑。马里努阿犬皮下脂肪含量较昆明犬、德国牧羊犬更低。该研究也表明随着日龄的增长,3种警犬体重、臀腿肌重呈线性增长,其中体重在0~6月龄增长速度最快。随日龄的增长,3种警犬臀腿肌的增长与体重增长趋势一致,3种警犬体重和臀肌重差异不显著(P>0.05)。但马里努阿犬臀腿肌肉比例略高于其他2个警犬品种,1岁龄时德国牧羊犬和昆明犬的体重略大于马里努阿犬。
Li等[9]研究了过氧化物酶体增殖激活受体γ-辅活化子1-α(PPARGC1A)基因在猪肌肉纤维中表达的mRNA和蛋白质水平,结果表明PPARGC1A基因在背最长肌中的表达量最高,肝脏次之,背部脂肪最低。在背最长肌组织中,大白猪与滇南小耳猪、藏猪相比具有较高的mRNA和蛋白表达,基因表达量与肌内脂肪含量呈负相关(P<0.05)。PPARGC1A在大白猪肝脏和背部组织中的表达量比滇南小耳猪和藏猪更高,蛋白质水平差异显著(P<0.05),肝脏、背部中脂肪含量差异极显著(P<001)。滇南小耳猪为本土品种,产自云南省南部,具有肌内脂肪(IMF)含量高、肉质嫩等特点。藏猪是青藏高原特有的猪种,主要分布于林芝、昌都(西藏)、甘肃、迪庆(云南)、阿坝和甘孜(四川)。除了能很好地适应严酷的环境外,藏猪也具有很高的IMF含量。大白猪是一种引进的猪品种,在生长率、瘦肉率等方面具有较好的性状,但IMF含量较低。该研究表明猪脂肪性状的表型不同,背膘厚度和IMF含量与不同水平的PPARGC1A表达(mRNA或蛋白)相关。PPARGC1A的表达是影响肌纤维类型的重要因素[11-16]。3种警犬中PPARGC1A的表达量不同,结合肌纤维类型及运动能力进行综合分析,进一步揭示该基因在调节骨骼肌线粒体、糖、脂和能量代谢方面的生物重要性,寻找有意义的分子标记,为进一步加快警犬的分子辅助育种工作提供理论依据。
4 结论
该研究分析了3个警犬品种中PPARGC1A的表达规律,结果表明,随着年龄的增长,PPARGC1A基因在3种警犬肌肉中的表达量呈現逐渐上升的趋势。马里努阿犬在6月龄和 1岁龄时臀腿肌中的基因表达量极显著高于昆明犬和德国牧羊犬(P<0.01)。这揭示PPARGC1A基因在肌肉发育和肌内脂肪沉积过程中起着重要的作用,结合警犬的警用耐力性能和有氧运动能力进行关联分析,为加快警犬分子辅助育种提供了理论依据。
参考文献
[1] PUIGSERVER P,WU Z D,PARK C W,et al.A cold-inducible coactivator of nuclear receptors linked to adaptive thermogenesis[J].Cell,1998,92(6):829-839.
[2] 韩雪蕾,刘榜,彭勇波,等.猪PPARGC1A基因的遗传变异检测及与胴体性状的关联分析[J].华中农业大学学报,2009,28(5):587-590.
[3] BRAISSANT O,FOUFELLE F,SCOTTO C,et al.Differential expressionof peroxisome proliferator-activated receptors(PPARs):Tissue distribution of PPAR-α,-β,and -γ in the adult rat [J].Endocrinology,1996,137(1):354-366.
[4] BUSTIN S A.Absolute quantification of mRNA using real-time reverse transcription polymerase chain reaction assays[J].Journal of molecular endocrinology,2000,25(2):169-193.
[5] 尚进,靳烨.PPARGC1α基因与肉质品质相关性研究进展[J].肉类研究,2012,26(3):42-44.
[6] 尚进.苏尼特羊、巴美肉羊、小尾寒羊PPARGC1α基因突变与肉质的相关性研究[D].呼和浩特:内蒙古农业大学,2012.
[7] 李碧侠,王学敏,任守文,等.猪PGC1基因与胴体性状的相关性分析[J].江苏农业科学,2007,35(4):141-142,210.
[8] 李碧侠,王学敏,任守文,等.5个不同猪种PGC1基因PCR-RFLP多态性研究[J].猪业科学,2006,23(10):52-54.
[9] LI Q G,WANG Z X,ZHANG B,et al.Single nucleotide polymorphism scanning and expression of the pig PPARGC1A gene in different breedse[J].Lipids,2014,49(10):1047-1055.
[10] YANG Y,MO X B,CHEN S F,et al.Association of peroxisome proliferator-activated receptor gamma coactivator 1 alpha(PPARGC1A)gene polymorphisms and type 2 diabetes mellitus:A meta-analysis[J].Diabetes/metabolism research and reviews,2011,27(2):177-184.
[11] HAMMARSTEDT A,JANSSON P A,WESSLAU C,et al.Reduced expression of PGC-1 and insulin-signaling molecules in adipose tissue is associated with insulin resistance[J].Biochemical biophysical research communications,2003,301(2):578-582.
[12] SORIA L A,CORVA P M,BRANDA SICA A,et al.Association of a novel polymorphism in the bovine PPARGC1A gene with growth,slaughter and meat quality traits in Brangus steers[J].Molecular and cellular probes,2009,23(6):304-308.
[13] KIM J M,LIM K S,LEE E A,et al.Polymorphisms of the 5′ regulatory region of the porcine PPARGC1A gene and the effects on muscle fiber characteristics and meat quality[J].Molecular biology reports,2012,39(4):3933-3942.
[14] LEE J S,KIM J M,HONG J S,et al.Effects of polymorphisms in the 3′ untranslated region of the porcine PPARGC1A gene on muscle fiber characteristics and meat quality traits[J].Molecular biology reports,2012,39(4):3943-3950.
[15] ZHAO R Q,YANG X J,XU Q F,et al.Expression of GHR and PGC-1α in association with changes of MyHC isoform types in longissimus muscle of Erhualian and Large White pigs(Sus scrofa)during postnatal growth[J].Animal science,2004,79(2):203-211.
[16] 楊飞云,陈代文,黄金秀,等.猪背最长肌肌纤维类型的发育性变化及品种与营养影响特点[J].畜牧兽医学报,2008,39(12):1701-1708.

