铁氨基黏土-葡萄糖氧化酶纳米复合催化剂的构筑及多酶级联反应研究
李 柳,孙仕勇,吕 瑞,GOLUBEV Yevgeny Aleksandrovich,王 可,董发勤,段 涛,KOTOVA Olga Borisovna,KOTOVA Elena Leonidovna
(1.西南科技大学环境与资源学院,绵阳621000;2.俄罗斯科学院乌拉尔分院科米科学中心尤什金地质研究所,瑟克特夫卡尔167982,俄罗斯;3.西南科技大学国防科学技术学院,绵阳621000;4.圣彼得堡国立矿业大学,圣彼得堡199106,俄罗斯)
酶是一类由活细胞产生,具有高催化活性和特异性的蛋白质或RNA,广泛参与机体中的各种代谢反应[1,2].由于体内的众多代谢反应通常需要多酶协同/级联催化,因此,体外构筑多酶协同/级联催化体系将有助于深入研究体内生化反应,并为新型生物催化剂的构筑提供帮助[3,4].但是,天然酶在体外易受到高温、极端pH和高离子强度等影响而失活,而且天然酶成本高,使用后难以回收利用[5,6],因此限制了其规模化应用.酶固定化技术是提高其稳定性和重复利用性的有效手段[7~9].将天然酶通过吸附[10,11]、包埋[12,13]和交联[14,15]等方法负载到载体上,可以提高其在环境中的耐受性,从而扩大其应用范围.Pandey等[16]将葡萄糖氧化酶(GOx)共价固定在硫醇化的金纳米颗粒上,测试结果表明,固定后的GOx对pH和温度的耐受性均有所提高.Kim等[17]分别通过吸附和戊二醛交联将α-胰凝乳蛋白酶和脂肪酶固定在介孔二氧化硅(HMMS)中,储存14 d后酶活性无明显降低.
纳米酶是一类蕴含酶学特性的纳米材料[18,19],与天然酶一样,能够在温和条件下催化底物转化,且比天然酶更加稳定,即使在强酸、强碱和高温等极端环境下也能保持较高的催化活性[20,21].以纳米酶为载体固定天然酶,不仅可以提高天然酶在极端环境下的稳定性,还可以利用纳米酶的催化活性与天然酶结合进行级联反应[22].近年来,碳基材料[23]、金属纳米粒子[24,25]和金属氧化物[26,27]等纳米材料已被广泛用于构建多酶级联催化体系.Zhong等[28]将葡萄糖氧化酶(GOx)固定在金属有机骨架[MOF-545(Fe)]上得到GOx@MOF-545(Fe),构建了一种模拟辣根过氧化物酶-葡萄糖氧化酶(HRP-GOx)的级联反应体系,研究发现,该体系不仅表现出了优异的催化稳定性和重复使用性,还能作为快速检测葡萄糖的比色传感器,对葡萄糖的检测限低至0.28μmol/L.Jung等[29]将尿酸氧化酶(UOX)与金纳米颗粒(AuNP)结合进行级联反应,该UOX-AuNP级联系统可利用AuNP的过氧化物酶活性消除具有潜在细胞毒性的H2O2,并对尿酸的降解速度比单独使用UOX快5倍以上,从而可用于高尿酸血症的治疗.
氨基黏土是一类人工合成的具有层状结构的有机黏土矿物[30],其最大特点是能够通过氨基质子化在水中自主剥落成单片,而在乙醇等极性较小的溶剂中又可恢复为堆叠状态[30,31].剥落的单片可进一步通过超声处理获得纳米级黏土单元,并具有很强的与生物分子(脂质、蛋白质和DNA)相互作用的能力,可用于制备高稳定性的功能化杂化材料[32,33].由于氨基黏土易于制备且毒性低,目前已广泛用作载体材料和吸附剂[34,35].Kim等[36]制备了镁氨基黏土并用于吸附纺织品阴离子染料活性红120(RR120),结果表明,其吸附动力学遵循准二级Langmuir等温方程模型,最大吸附量可达229.9 mg/g,是目前文献报道的最高值.Liu等[37]将葡萄糖氧化酶固定在镁氨基黏土纳米片基质中得到葡萄糖氧化酶/镁氨基黏土(GOD/AMP)复合物,再与纳菲薄膜结合构建了葡萄糖生物传感器,研究结果表明,固定在AMP中的GOD保持了生物活性,并促进了GOD在玻碳电极表面的直接电子转移,GOD/AMP复合修饰电极对溶解氧和葡萄糖均表现出灵敏的电催化响应.2013年,Lee等[38]首次报道了铁氨基黏土(FeAC)具有优异的类过氧化物酶活性,其能够催化过氧化氢氧化3,3′,5,5′-四甲基联苯胺(TMB),与天然HRP相比,FeAC在较宽的pH范围内具有更高的催化活性.
本文以FeAC为载体,通过固定葡萄糖氧化酶构筑了FeAC-GOx纳米结构酶.FeAC的存在不仅可以保护葡萄糖氧化酶的催化活性,而且能利用其本征的类过氧化物酶活性与葡萄糖氧化酶构成级联反应体系,从而直接将葡萄糖转化为羟自由基并触发显色反应.该纳米结构酶不仅稳定性良好,而且具有优异的催化活性和重复利用性,为新型葡萄糖传感器的开发奠定了基础.
1 实验部分
1.1 试剂与仪器
3-氨丙基三乙氧基硅烷(APTES,纯度98%)购于上海麦克林生化科技有限公司;六水合三氯化铁(FeCl3·6H2O,纯度99%)、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC,纯度98%)、3,3′,5,5′-四甲基联苯胺(TMB,纯度>99%)和葡萄糖购于上海阿拉丁生化科技股份有限公司;葡萄糖氧化酶(GOx,100 U/mg)和辣根过氧化物酶(HRP,250 U/mg)购于合肥博美生物科技有限责任公司;考马斯亮蓝G250(纯度>90%)购于成都市科龙化工试剂厂;其它试剂均为分析纯.
X′Pert PRO型X射线衍射(XRD)仪,荷兰帕纳科公司;Spectrum One型傅里叶变换红外光谱(FTIR)仪,美国PE仪器公司;ULTRA 55型200 kV场发射扫描电子显微镜(SEM),德国蔡司仪器公司;UV-2800A型紫外-可见(UV-Vis)分光光度计,尤尼柯(上海)仪器有限公司;Zetasizer Nano ZS 90型马尔文激光粒度仪,英国马尔文仪器有限公司,
1.2 实验过程
1.2.1 FeAC的合成 室温下,将FeCl3·6H2O(8.4 g,31.08 mmol/L)溶于200 mL乙醇溶液中,超声分散10 min;逐滴加入13 mL APTES溶液(58.3 mmol/L),APTES与FeCl3·6H2O的摩尔比约为2∶1,形成棕色沉淀浆液;以600 r/min的转速磁力搅拌12 h;反应结束后,以6000 r/min的转速离心5 min,用乙醇溶液清洗2次,除去多余的FeCl3·6H2O,烘干得到FeAC,备用.
1.2.2 FeAC固定葡萄糖氧化酶 将EDC(25 mg)溶于10 mL磷酸盐缓冲液(100 mmol/L,pH=7.0)中,配制成EDC溶液(质量体积分数0.25%).将0.3 g FeAC加入10 mL EDC溶液中,室温下置于转速为150 r/min的摇床中活化1 h,离心,用磷酸盐缓冲液洗涤3次,除去残余的EDC.
向活化后的FeAC中加入10 mL葡萄糖氧化酶溶液(3 mg/mL),置于转速为150 r/min的摇床中振荡反应3 h,于6000 r/min转速下离心5 min,所得沉淀用PBS缓冲液清洗3次,除去未结合或结合不完全的酶;将制得的FeAC-GOx置于4℃冰箱中冷藏备用.FeAC-GOx的制备过程如Scheme 1所示.
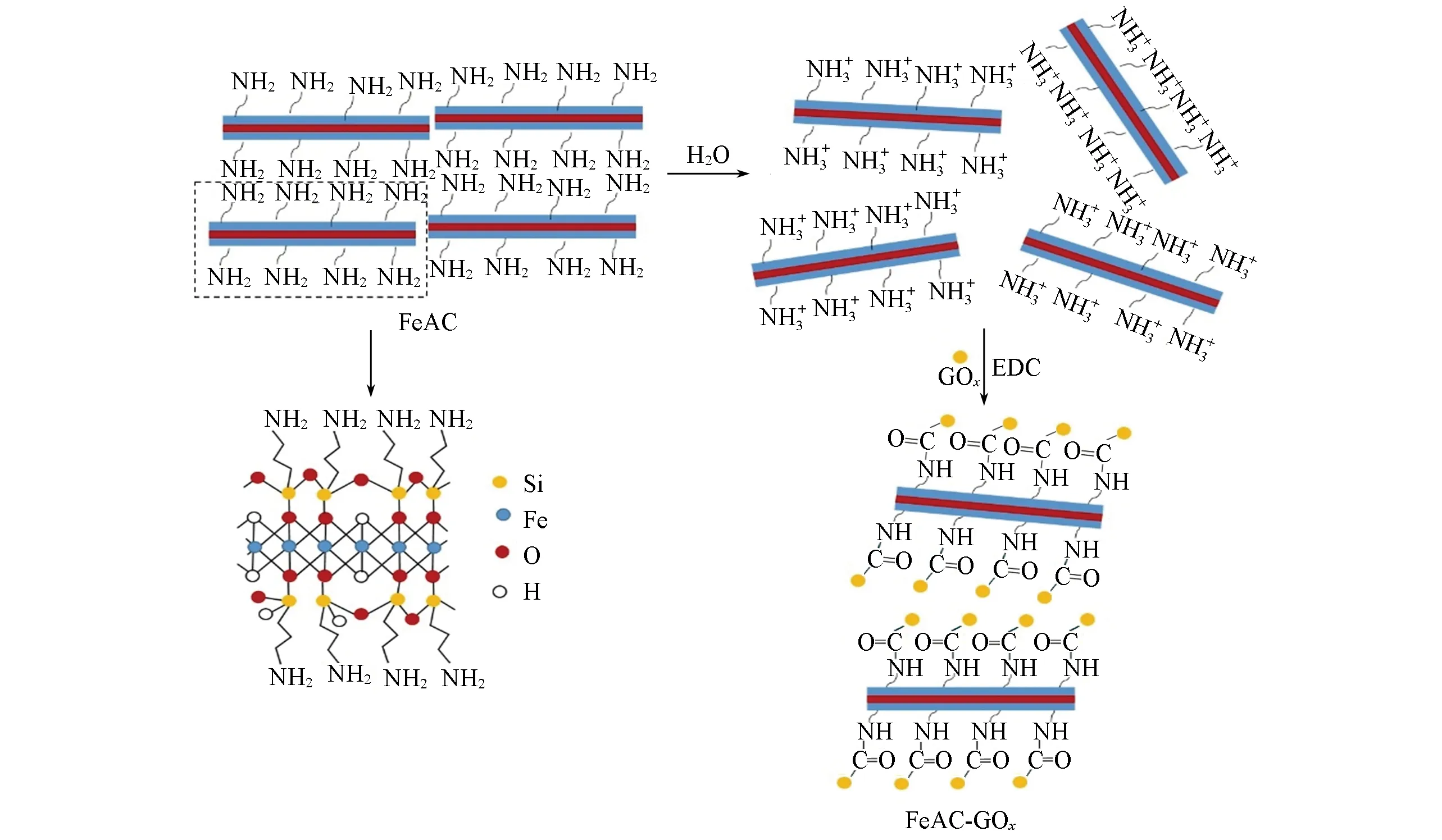
Scheme 1 Schematic of the preparation of FeAC-GOx composite
1.2.3 酶固定化率的测定 采用Bradford法测定离心所得上层清液中蛋白质的浓度,以牛血清蛋白(BSA)为标准蛋白绘制标准曲线,测定样品上层清液中的蛋白含量,按下式计算酶固定化率E(%).

式中:m0(mg)为固定化前酶蛋白总含量;m1(mg)为固定化后上层清液中酶蛋白的含量.
1.2.4 酶活性的测定 采用H2O2-TMB显色反应测定FeAC-GOx和游离酶的活性.首先,将TMB(20 mg)溶于10 mL无水乙醇中,配制TMB溶液(2 mg/mL).将0.2 mL TMB溶液加入到1.8 mL PBS缓冲液(100 mmol/L,pH=7.0)中,再依次加入0.5 mL的葡萄糖溶液(100 mmol/L)和0.5 mL酶溶液(1 mg/mL);将混合物在37℃下温育1 h,于8000 r/min转速离心3 min,取上层清液用紫外-可见分光光度计在655 nm测量吸光度,每个样品测量2~3次,取平均值;将每分钟氧化1μmol葡萄糖为葡萄糖酸和过氧化氢的酶量定义为1个酶活(U/mg)单位.
1.2.5 pH和温度稳定性测定 将FeAC-GOx和游离酶体系(GOx+HRP)分别在不同pH的磷酸缓冲液(pH=3.0~9.0,100 mmol/L)中放置5 h测定酶活性,考察其pH稳定性.将FeAC-GOx和游离酶体系(HRP+GOx)在不同温度(30~90℃)下温育1 h,测定其酶活性,考察其温度稳定性.
2 结果与讨论
2.1 材料的表征
2.1.1 XRD及FTIR分析 由FeAC和FeAC-GOx的XRD谱图[图1(A)]可知,FeAC在2θ=5.3°[d(001)=1.65 nm]处出现衍射峰,这是层状有机黏土结构的典型特征峰;在2θ=26.6°[d(020)=d(110)=0.34 nm],2θ=34.6°[d(020)=d(110)=0.26 nm]处的平面内反射宽峰强度很弱,是1∶1层状硅酸盐矿物([H2N(CH2)3]4·[Si4Fe6O8(OH)2],由1个硅氧四面体片和1个铁氧八面体片结合而成)的特征峰[39].固定化GOx后,部分酶蛋白分子进入到FeAC的层间,层间距相应增加[d(001)=2.13 nm];通过Bradford法测得离心所得上层清液中GOx含量为7.6 mg,由式(1)计算出酶固定化率为76.4%,因此结合酶固定化率和FTIR表征结果可以推断,GOx已固定在FeAC上.
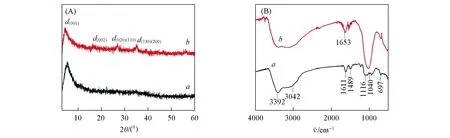
Fig.1 XRD patterns(A)and FTIR spectra(B)of FeAC(a)and FeAC-GOx(b)
由FTIR图[图1(B)]可知,FeAC的谱线存在特征吸收峰Fe—O(697 cm-1),Si—O—Si(1040 cm-1),Si—O—C(1116 cm-1),—CH2弯曲振动峰(1489 cm-1),—NH2弯曲振动峰(1611 cm-1),—CH2(3042 cm-1)和—OH(3392 cm-1),与文献[38]报道结果一致.FeAC在水溶液中剥落为单片后,片层上大量的—NH3+会与GOx上的—COOH基团共价结合,形成稳定的酰胺键(—CO—NH—).对于FeAC-GOx,酰胺Ⅰ键位于1653 cm-1处,主要来自C=O的伸缩振动,证实GOx以共价酰胺键负载到FeAC上[9,40,41].
2.1.2Zeta电位及纳米粒度分析Zeta电位是考察材料分散性与稳定性的重要指标,分散粒子越小,Zeta电位绝对值越高,体系越稳定.当pH=7.0时,FeAC,GOx和FeAC-GOx的Zeta电位分别为15.6,-4.23和-31.9,GOx的电位为负值,而FeAC由于具有高密度带正电荷的氨基,电位为正值.当GOx固定到FeAC上后,FeAC-GOx的电位为负值,且绝对值大于FeAC,表明FeAC表面固定了带负电的GOx,导致电位发生变化,并且Zeta电位绝对值的增大表明FeAC-GOx在水溶液中比游离酶更加稳定.以上结果表明,FeAC-GOx在水溶液中表现出良好的分散性,不易发生聚集沉淀,有助于其类酶活性的发挥.由图2可见,当pH=7.0时,FeAC,GOx和FeAC-GOx的平均粒度分别为258.10,162.44和485.06 nm.通过粒度分析可知,固定GOx以后,FeAC-GOx的平均粒度增大,进一步说明GOx与FeAC形成了纳米结构复合物.
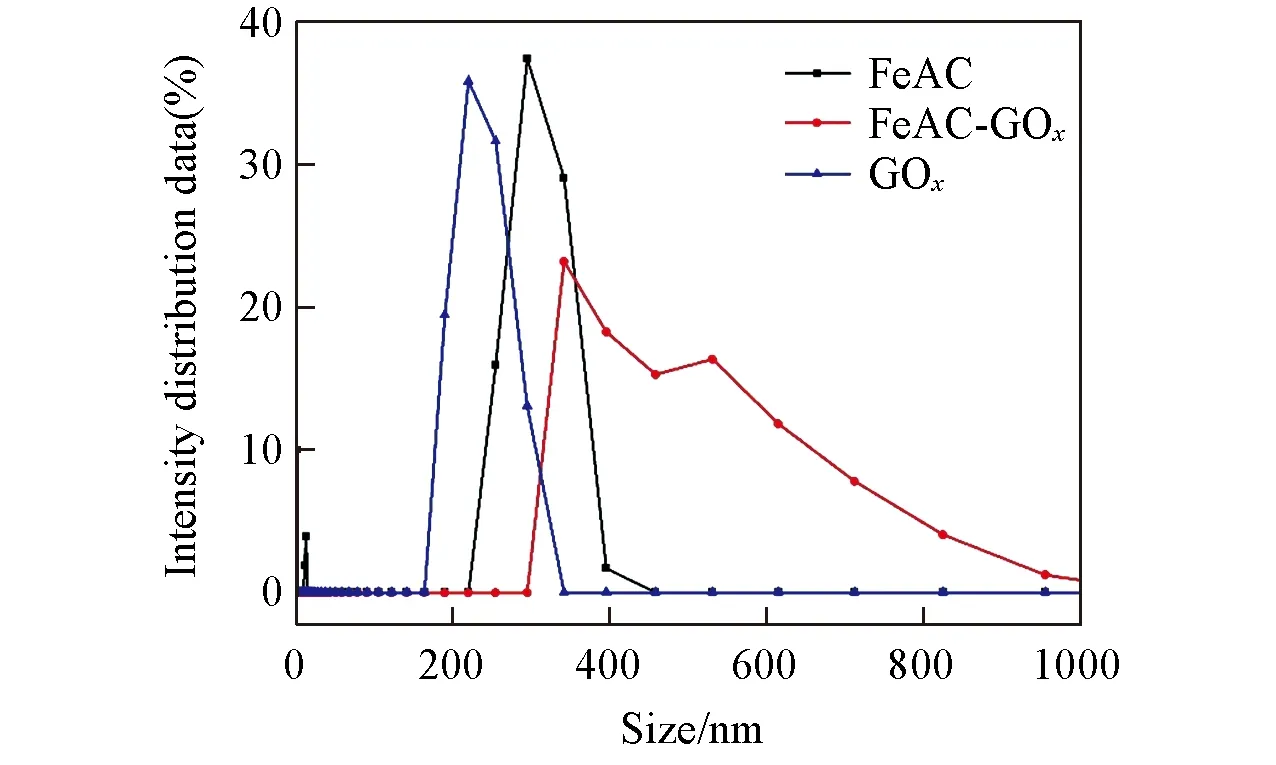
Fig.2 Particle size distribution of Fe-aminoclay,GOx and FeAC-GOx dispersed in aqueous solution

Fig.3 SEM images of FeAC(A)and FeAC-GOx(B)
2.1.3 形貌分析 图3示出了FeAC(A)和FeAC-GOx(B)的结构和形貌特征,可见,FeAC表面平滑,具有明显的片层结构[图3(A)],固定葡萄糖氧化酶后,FeAC表面变得粗糙[图3(B)],说明其表面均匀负载了GOx颗粒.
2.2 FeAC-GOx的酶学特性
2.2.1 温度和pH对酶活性的影响 首先,考察了30~90℃下FeAC-GOx的催化稳定性.由图4(A)可见,当温度低于60℃时,游离酶(GOx+HRP)活性较高;但随着温度的升高,游离酶活性逐渐降低,当温度升高至70℃时,游离酶活性小于20%,而FeAC-GOx在70℃时仍保留了近60%的活性;当温度升高至90℃时,游离酶已经失去活性,而FeAC-GOx依然保持了40%的活性.由此说明,FeAC-GOx的热稳定性高于游离酶.由于高温会破坏酶的三维结构,从而导致酶催化活性降低,而GOx与FeAC共价结合后,增加了酶三维结构的稳定性,从而使FeAC-GOx的热稳定性提高[42].在30~50℃范围内,随着温度的升高,底物与酶的碰撞几率也会增大,进而提高了固定酶的催化活性,但进一步升高温度会破坏酶蛋白的结构,从而导致酶活性降低[40].
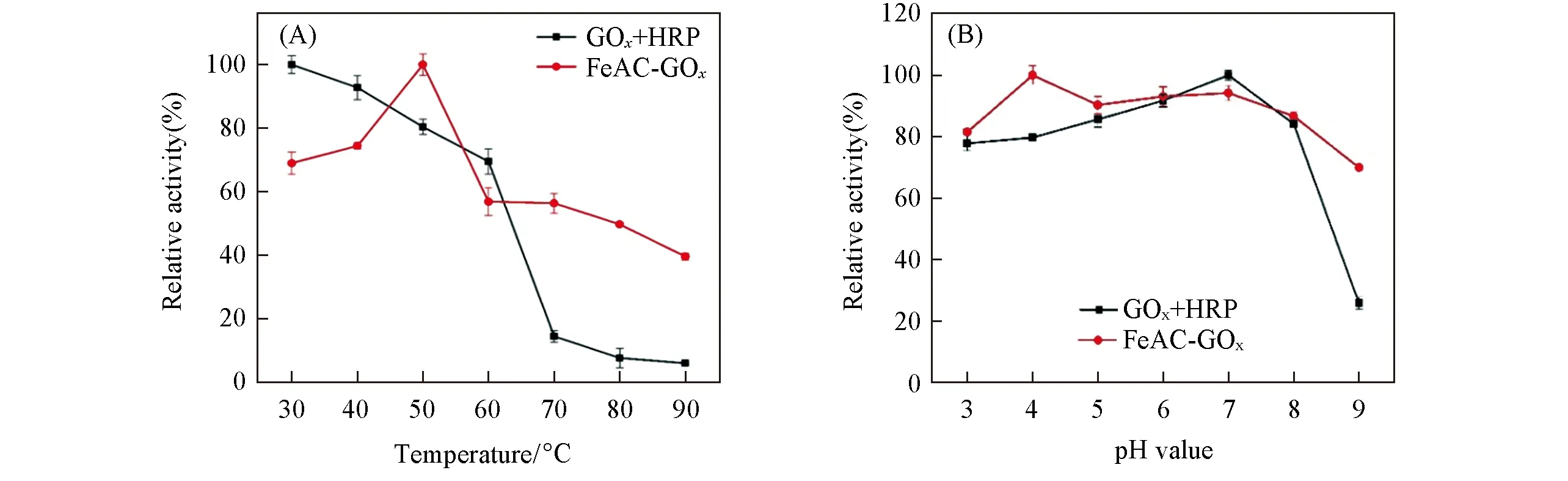
Fig.4 Relative activity at different temperatures(A)and pH(B)for free GOx+HRP and FeAC-GOx
图4 (B)示出了游离酶(GOx+HRP)和FeAC-GOx在pH=3.0~9.0范围内的酶活性.与FeAC-GOx相比,游离酶在极酸和极碱条件下的活性均有所下降,尤其在pH=9.0时游离酶活性下降至20%,而FeAC-GOx在pH=3.0~8.0范围内均保持了较高的活性,即使在pH=9.0时酶活性也保持在约70%.以上结果表明,FeAC作为载体显著降低了环境pH对GOx的影响,致使FeAC-GOx表现出更高的pH耐受性[43,44].
2.2.2 储存稳定性及重复使用性 从实用和经济角度看,酶的储存稳定性和重复使用性均是其广泛应用的关键,因此,构建具有高储存稳定性和重复利用性的多酶级联反应体系对于实际应用极为重要[45].实验测定了在4℃下储存7 d后游离酶(GOx+HRP)和固定酶(FeAC-GOx)的催化活性.由图5(A)可见,在储存7 d后FeAC-GOx纳米复合物的催化活性大于80%,而游离酶的酶活却小于40%,说明FeAC-GOx具有优异的储存稳定性.此外,FeAC-GOx在重复使用6次以后,催化活性仍大于90%[图5(B)].
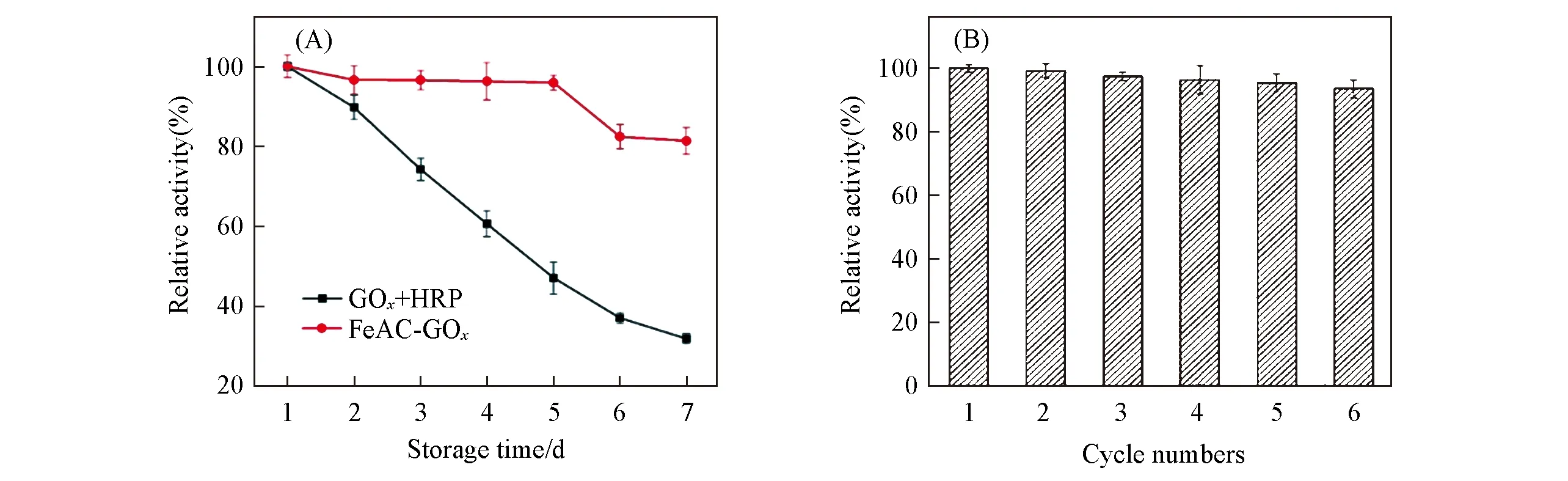
Fig.5 Storage stability at 4℃of free GOx+HRP and FeAC-GOx(A)and cycle numbers for FeAC-GOx(B)
以上结果表明,GOx通过共价相互作用固定到FeAC上以后,提高了催化稳定性.与游离酶相比,FeAC-GOx在高温、强酸碱环境下均有更高的耐受性,并且具有良好的储存稳定性和重复使用性,在实际应用中具有广阔的前景.
2.2.3 酶动力学参数 酶动力学参数Vmax(mmol·L-1·min-1)是指最大反应速率,即当酶的活性位点完全被底物占据时的反应速率;Km(mmol/L)是指反应速率达Vmax值一半时所需的底物浓度,表示酶对底物的亲和力,Km值越小,则酶与底物之间的亲和力越强.Km和Vmax都是酶固有的特性,与其自身性质有关,酶固定化前后可能会发生动力学参数的变化.在pH=4.0和37℃条件下,分别以不同浓度的葡萄糖和TMB为底物,测定了游离酶(GOx+HRP)和FeAC-GOx的动力学参数,以底物浓度倒数(c-1)横坐标,反应初速度倒数(V0-1)为纵坐标绘制Lineweaver-Burk曲线(图6),动力学参数计算结果列于表1.
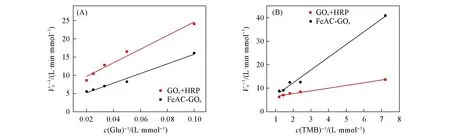
Fig.6 Lineweaver-Burk plots of the free GOx+HRP and FeAC-GOx with glucose(A)and TMB(B)as substrate,respectively
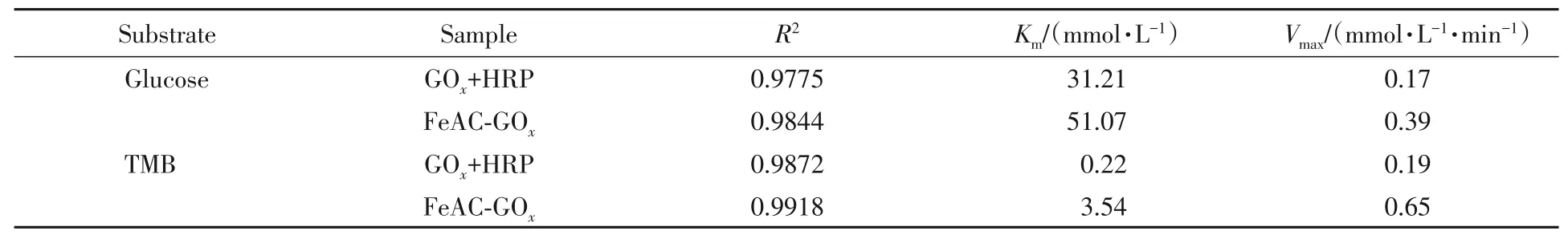
Table 1 Kinetic parameters of the free GOx+HRP and FeAC-GOx
由表1可知,以葡萄糖或TMB为底物时,FeAC-GOx的Km值均大于游离酶(GOx+HRP),说明游离酶与葡萄糖或TMB的亲和力要优于FeAC-GOx.这是因为酶与FeAC的结合增大了GOx的空间位阻,使酶与底物的亲和能力下降.而FeAC-GOx的最大反应速率大于游离酶,表明在温度、pH、葡萄糖和TMB浓度及游离酶和固定酶浓度均相同的情况下,FeAC-GOx具有更高的催化能力,这主要归因于“纳米尺度邻近效应”最小化了中间体的分解[22,46].
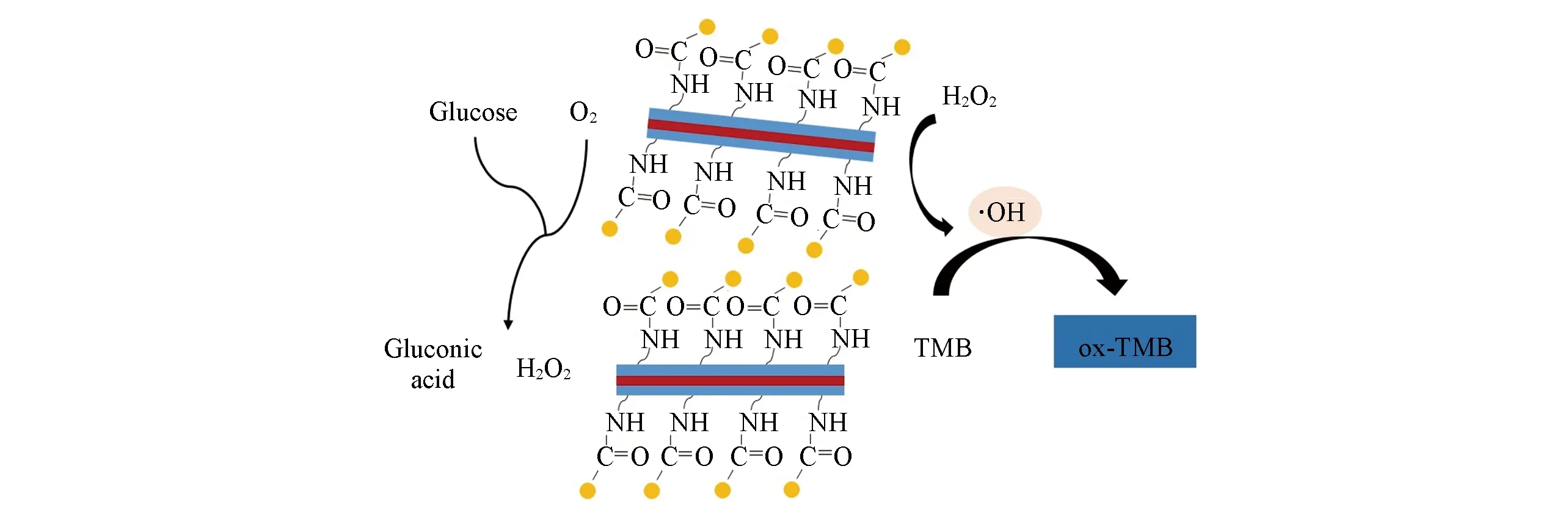
Scheme 2 Schematic of the cascade reaction catalyzed by FeAC-GOx
2.2.4 催化机理 FeAC-GOx多级酶联催化体系的催化机理如Scheme 2所示.葡萄糖通过GOx的作用被氧化为葡萄糖酸和H2O2,生成的H2O2又在FeAC的催化下生成羟自由基(·OH),从而将无色的TMB氧化为典型的蓝色氧化态TMB(ox-TMB).
3 结 论
以铁氨基黏土为载体,通过共价固定葡萄糖氧化酶得到铁氨基黏土-葡萄糖氧化酶(FeAC-GOx)纳米复合催化剂,整合了纳米酶的稳定性和天然酶的高催化活性.实验结果表明,FeAC-GOx表现出良好的分散性,与游离酶相比,FeAC-GOx不仅具有高催化活性、储存稳定性和可重复利用性,而且对温度、酸和碱都具有更高的耐受性.该研究为新型葡萄糖传感器的开发奠定了基础.

