水溶液pH对甲烷低温氧化制备甲醇的影响
李 健,于明明,孙 源,冯文华,冯兆池,吴剑峰
(1.功能有机分子化学国家重点实验室,甘肃省有色金属化学与资源利用重点实验室,先进催化中心,兰州大学化学化工学院,兰州730000;2.中国科学院大连化学物理研究所,催化基础国家重点实验室,大连116023)
甲烷作为天然气的重要组成部分,具有储量大、价格低的优势.因此,甲烷被认为是替代石油的重要碳资源[1~3].由于甲烷自身的高稳定性,传统的甲烷利用途径需要经过高能耗的合成气转化过程(T>1000 K),然后再依靠CuZnAl三元催化剂来制备甲醇[4].该反应过程能耗高、路径长,不具备绿色化工过程的特征.
由于反应过程步骤短,同时规避了高能耗反应途径,甲烷直接制备甲醇已经成为目前的一个主要研究热点.根据反应体系,甲烷直接制备甲醇的反应过程可以分为2类:(1)以O2或者N2O为氧化剂的气-固相反应.这类反应主要是以Cu或Fe修饰的分子筛催化剂为研究对象[5,6];(2)以H2O2(反应中添加或者原位生成)为氧化剂的气-固-液三相反应.该研究领域目前取得了很多富有成效的研究成果[7~26].在反应过程中,H2O2通过分解产生活性的·OH自由基来促进甲烷的活化[9].
Kawase课题组[27]发现H2O2生成·OH自由基的速率依赖于溶液的pH.这表明溶液的pH可能会极大地影响产物收率.目前,关于溶液pH对甲烷氧化制备甲醇反应过程影响的研究并不多,并且多集中在较窄pH范围内进行[21,28,29].如Park课题组[21]以FeSO4和Pd/C为催化剂,在原位生成H2O2或者直接添加H2O2的条件于pH=0.7~4.3的酸性条件下研究了含氧化合物的生成量.该研究发现含氧化合物的生成量分别在pH=1.3(原位生成H2O2)和2.3(直接添加H2O2)时达到最大值.
Park课题组[28]随后报道了离子交换制备的Fe/ZSM-5和Pd/活性炭催化剂在pH=0.7~3.3之间催化甲烷和原位生成H2O2的反应.该研究发现高的酸浓度可以促进含氧化合物的生成(最佳酸性为pH=0.7),但是高的酸浓度也会促进Fe物种从分子筛载体上流失.Fan和Zou课题组[29]报道了AuPdx胶体催化甲烷和原位生成H2O2之间的反应,研究的pH范围是1~8.该课题组发现在pH=3.0时,可以生成最高含量的含氧化合物.
本文通过固态离子交换法制备了0.5% Fe/ZSM-5催化剂,首先对催化剂活性位点的结构和落位进行了研究.评价了不同溶液pH对甲烷直接氧化为甲醇反应的影响.研究结果表明,强酸介质有利于产物生成,但会增加Fe的浸出量;强碱介质能促进H2O2自分解,不利于产物生成.此外,该催化反应过程是多相的,体系中析出的Fe物种不能催化该反应的发生.根据以上实验结果,探讨了不同pH条件下的反应机理.
1 实验部分
1.1 试剂与仪器
甲烷(广东华特气体股份有限公司,纯度99.999%);ZSM-5(nSi/nAl=15)购自南开催化剂厂;过氧化氢(成都市科隆化学品有限公司,质量分数≥30%);一水合1,10-菲罗啉(成都市科龙化工试剂厂,纯度≥99.0%);3-(三甲基硅基)-丙磺酸钠盐(DSS,Sigma-Aldrich,纯度97%);氘水(青岛腾龙微波科技有限公司,含摩尔分数99.9% D);浓硫酸(西陇科学股份有限公司,质量分数98%);四水合硫酸铈(上海麦克林生物化学有限公司,纯度98%);七水合硫酸亚铁(成都市科龙化工试剂厂,纯度99.0%~101.0%);氢氧化钠(成都市科隆化学品有限公司,纯度≥98%);硝酸铵(天津市福晨化学试剂厂,纯度99%);无水乙醇(利安隆博华医药化学有限公司,纯度≥99.7%);乙酰丙酮化铁(CAS:14024-18-1,上海韶远试剂有限公司,纯度98%);甲酸(成都市科隆化学品有限公司,纯度98%);乙酸(利安隆博华医药化学有限公司,纯度99.5%);甲醇(成都市科隆化学品有限公司,纯度99%),实验室用水均为超纯水(电导率为18.2 MΩ·cm,宁波丹斯博顿环保科技有限责任公司).
内衬材料为玻璃的高压反应釜(50 mL,上海予申仪器有限公司);气相色谱仪(9790 Plus,浙江福立分析仪器有限公司)配备TDX-01色谱柱(2 m×3 mm,兰州东立龙信息技术有限公司);pH计(PHS-3C,杭州雷磁分析仪器厂);JNM-ECS 400M型液体核磁共振波谱仪(日本电子公司);Philips X’Pert Pro型X射线衍射仪(XRD,Cu靶,电压40 kV,电流40 mA,扫描范围2θ为5°~50°,荷兰帕纳科公司);Agilent Cary 5000型漫反射紫外-可见光谱仪(DR UV-Vis,美国安捷伦科技公司);Plasma Quant PQ 9000型电感耦合等离子光谱仪(ICP,德国耶拿分析仪器股份公司);HORIBA HR型拉曼光谱仪(Raman,激发波长为λex=266 nm,法国HORIBA Jobin Yvon公司);Bruker AvanceⅡWB 400 MHz型固体核磁共振波谱仪(瑞士布鲁克公司).
1.2 催化剂的制备
1.2.1 脱模板剂 称取20 g含有模板剂的ZSM-5(nSi/nAl=15)分子筛原粉,均匀平铺在蒸发皿中,在马弗炉内于500℃煅烧5 h,空气流量为10 mL/min,升温速率为1℃/min,煅烧结束后自然降温.
1.2.2 铵型分子筛的制备 在脱模板剂后的ZSM-5分子筛中加入约250 mL 1 mol/L NH4NO3,在电磁搅拌器上以500 r/min转速于80℃进行离子交换,交换12 h后以4000 r/min转速离心5 min.每次离心后用超纯水洗涤4次(最后一次洗涤后加入250 mL NH4NO3再进行下一次离子交换).共进行离子交换4次.最后一次离心结束后,将固体转移至培养皿中,在烘箱中于80℃烘干10 h,取出后研磨得到粉末状NH4-ZSM-5分子筛.
1.2.3 氢型分子筛的制备 将NH4-ZSM-5分子筛均匀平铺在蒸发皿中,于500℃马弗炉内不通空气煅烧5 h,升温速率为1℃/min,煅烧结束后自然降温,得到H-ZSM-5分子筛.
1.2.4 0.5% Fe/ZSM-5催化剂的制备 将0.0963 g乙酰丙酮化铁放置于研钵中,研磨后加入3.0 g H-ZSM-5粉末,继续研磨30 min.将研磨后的固体均匀平铺在蒸发皿中,置于500℃马弗炉内不通空气煅烧3 h,升温速率为1℃/min,煅烧结束后自然降温,得到质量分数为0.5% Fe/ZSM-5催化剂.
1.3 溶液配制
将一定量的NaOH固体放于100 mL烧杯中,加超纯水将其溶解完全,用玻璃棒将溶液转移至100 mL容量瓶中.用少量超纯水洗涤烧杯和玻璃棒3次,将洗涤液转移至100 mL容量瓶中,加超纯水定容至刻度,得到不同pH的碱性溶液(如表1所示).
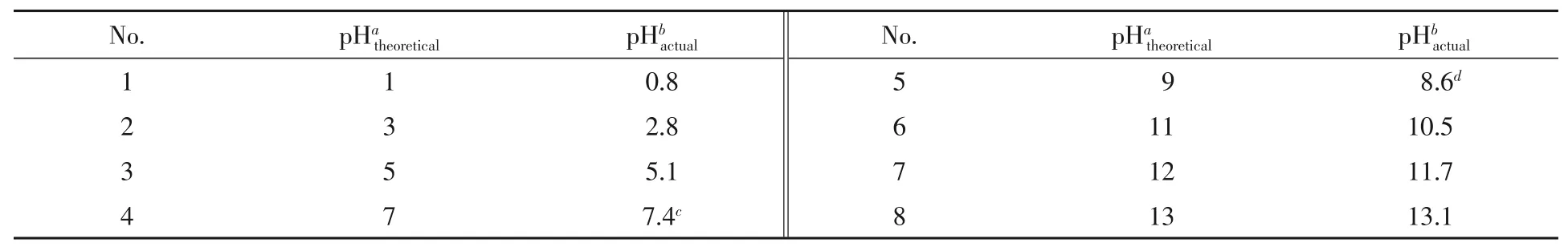
Table 1 Statistics table of pH
将少量超纯水置于100 mL烧杯中,加入一定量的浓H2SO4,搅拌均匀后用玻璃棒将溶液转移至100 mL容量瓶中.用少量超纯水洗涤烧杯和玻璃棒3次,将洗涤液转移到100 mL容量瓶中,加超纯水定容至刻度,得到不同pH的酸性溶液(如表1所示).
1.4 测试条件
1.4.1 催化性能测试 在加入磁子的高压反应釜中加入27 mg 0.5% Fe/ZSM-5催化剂和10 mL不同pH溶液,再加入50μL质量分数为30% H2O2溶液.加入磁子、密封高压釜,放入加热搅拌套中,使用2 MPa CH4气体排气3次,然后充入3 MPa CH4(在测定H2O2自分解浓度时,将CH4气换成Ar气).同时开启加热和搅拌,搅拌速率设定为1500 r/min,待温度升高至50℃,开始计时.30 min后停止加热和搅拌,然后将反应釜置于冰水浴中冷却30 min.用气袋收集反应釜内气体产物.由于反应过程中仅生成微量CO2,所以不进行具体讨论.液体产物进行离心后用于液体1H NMR定量分析.气体和液相产物的定量通过标准曲线法计算.
在最优反应条件下按上述实验步骤进行催化剂稳定性测试,对每次测试后的催化剂进行离心,用去离子水洗涤至pH中性,烘干后收集,用于下次测试继续使用.在回收的催化中添加一定量的新鲜催化剂来保证循环实验中每次催化剂使用量均为27 mg.
1.4.2 碳平衡及碳原子利用率计算 碳平衡(Carbon balance,%)计算公式为

碳原子利用率(Carbon utilization,%)计算公式为

式中:nCH4,remain(mol)表示反应后反应釜内剩余CH4的量;nco(mol)表示反应后反应釜内生成CO的量;nco(2mol)表示反应后反应釜内生成CO2的量;nOxygenates(mol)表示反应后反应釜内生成的总液体含氧化合物的量;nCH4,initial(mol)表示反应前反应釜内充入的起始CH4的量.
1.4.3 剩余H2O2滴定 取1 mL反应后的反应上层清液置于250 mL锥形瓶中,加入10 mL 20% H2SO4,补加超纯水至约100 mL,加0.05 mL 1,10-菲罗啉指示剂,用0.05 mol/L CeSO4溶液滴定,达到滴定终点时溶液由橙红色变为淡蓝色.
2 结果与讨论
2.1 催化剂的ICP表征
表2 给出了Fe/ZSM-5催化剂的ICP表征结果.Fe物种负载在分子筛上后,得到的实际Fe负载量与理论值相近.

Table 2 ICP results of 0.5% Fe/ZSM-5 catalyst
2.2 催化剂的XRD,Raman和DR UV-Vis表征
由图1(A)的XRD谱图可以看到,Fe负载后的分子筛催化剂具有明显的MFI型骨架.通过与Fe2O3标准卡片(JCPDS No.33-0664)对比,没有发现明显的Fe2O3衍射峰.说明Fe物种在ZSM-5分子筛骨架上分散良好,Fe物种粒径小于2~3 nm的XRD检测下限.图1(B)给出了负载Fe物种前后H-ZSM-5的Raman谱图.可见,与H-ZSM-5催化剂相比,0.5% Fe/ZSM-5催化剂的骨架在375 cm-1处的峰强度明显下降,375 cm-1振动峰对应MFI骨架中的五元环[30],该处振动峰强度下降,表明Fe物种落位于五元环上,使五元环振动减弱.图1(C)为0.5% Fe/ZSM-5的DR UV-Vis谱图.203 nm处的吸收峰可归属于四面体Fe3+物种;267 nm处的吸收峰可归属于八面体Fe3+物种;378 nm处的吸收峰可归属于寡聚FexOy团簇中八面体Fe3+物种;534 nm处的吸收峰可归属于Fe2O3纳米颗粒[31,32].此外,DR UV-Vis实验结果还表明该催化剂上的Fe物种均以+3价存在.催化剂的上述表征结果证明已成功制备0.5% Fe/ZSM-5催化剂.
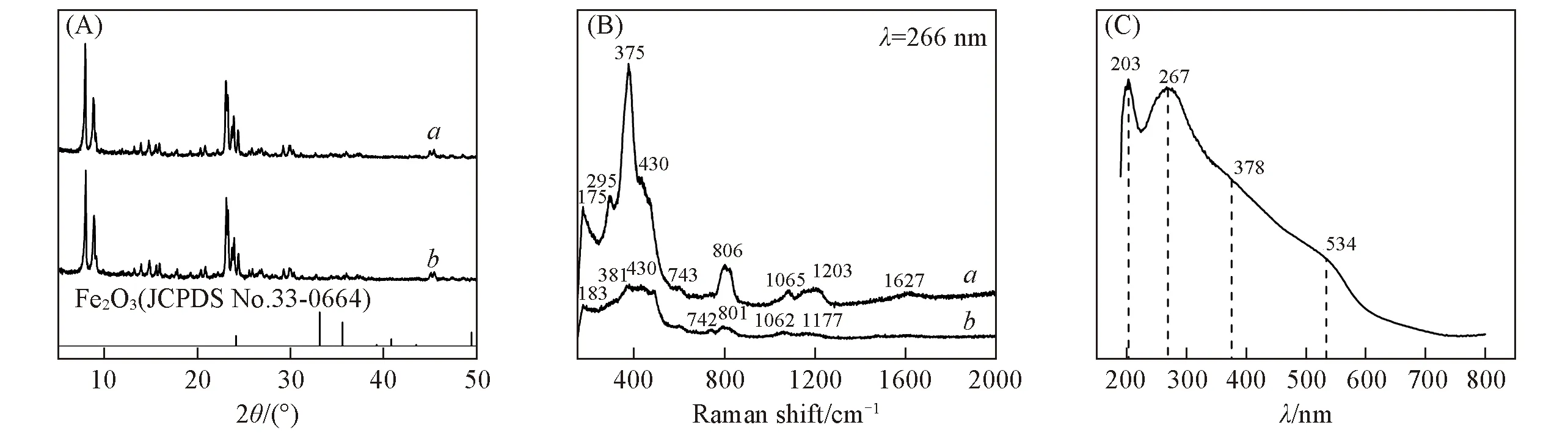
Fig.1 XRD patterns(A),Raman spectra(B)of H-ZSM-5(a)and 0.5% Fe/ZSM-5(b)catalysts and DR UVVis spectrum of 0.5% Fe/ZSM-5 catalyst(C)
2.3 催化反应测试
为了保证数据的可重复性,在每个实验条件下进行了多次测试取平均值.为了确保加入了足量的H2O2氧化剂,在每次反应结束后都取出部分反应液使用CeSO4溶液进行滴定来确定剩余H2O2的浓度.在不同pH条件下进行实验,由于反应前后釜内压力均没有明显变化,计算所得碳平衡为(100±2)%,在实验误差范围内.反应产物(CH3OH,HCOOH等)的数量均在微摩尔级别,因此碳原子利用率较低.不同pH条件下进行实验,计算结果平均值为0.00011%.

Fig.2 Concentration diagram of reaction products and residual H2O2 in different pH solutions(A)and stability test for 3 times(B)
图2 (A)给出了不同pH反应条件下产物和剩余H2O2浓度之间的关系.可见,溶液pH值从0.8升高至5.1的过程中,甲醇产量稍有下降,甲酸产量下降明显,两者的总产量显著下降,剩余H2O2的量也保持在一个较高的范围(均高于34 mmol/L);溶液pH值在7.4~10.5之间时,生成的甲醇和甲酸的产量没有显著变化,但相比于酸性条件(pH=0.8~5.1)而言,甲醇和甲酸的产量均有所降低,并且剩余H2O2的量比酸性条件(pH=0.8~5.1)时有所下降,剩余H2O2的量也保持在32.5 mmol/L,基本不变;但在溶液pH值大于10.5后,甲醇和甲酸的产量都出现了明显的降低,剩余H2O2的量显著降低.甚至在pH=13.1时没有检测到甲醇的生成,剩余H2O2的量也急剧下降.以上实验结果表明,强酸条件(pH=0.8)更有利于产物的生成.在最优条件(pH=0.8)下进行催化稳定性测试[图2(B)],由实验结果可知,经过3次循环,催化剂活性基本保持不变,具有一定稳定性.溶液中浸出的Fe物种可能是非活性的Fe物种.
2.4 分子筛的稳定性
由上述实验结果可知,在pH=13.1时,未检测到甲醇的生成,催化活性较差,且已知强碱条件下分子筛非常不稳定,为探究分子筛稳定性对催化活性影响,对0.5% Fe/ZSM-5分子筛在强碱性条件(pH=13.1)下按照反应条件进行了处理,对比了反应前后0.5% Fe/ZSM-5分子筛的27Al固体核磁谱图(图3).
在图3可见,新鲜催化剂上观测到了位于δ54.0和δ-0.9的2个Al信号,分别代表四配位的分子筛骨架Al物种和六配位的非骨架Al物种[33].0.5% Fe/ZSM-5催化剂在pH=13.1的强碱性条件下反应后仅能观测到四配位的分子筛骨架Al物种.推测非骨架铝物种进入了溶液中,这也由ICP表征数据(非骨架Al含量为0.1631 mg/L)得到证实.

Fig.3 27Al CPMAS NMR spectra of fresh 0.5%Fe/ZSM-5 catalyst(a)and 0.5% Fe/ZSM-5 catalyst after reaction(b)

Fig.4 Concentration diagram of consumed H2O2 in different pH solutions
2.5 反应机理研究
推测强碱性条件不利于反应进行的原因可能是:强碱条件会促进H2O2分解产生的·OH自由基发生自身歧化反应,降低了参与活化CH4的·OH自由基浓度,使催化活性明显降低.为了考察强碱性条件是否会促进·OH自由基的自身歧化进行了平行实验.将反应物中的CH4替换为Ar,在相同条件下反应30 min后,对反应液中H2O2的量进行滴定.以确定参加自分解的H2O2浓度,从而得到参加催化反应的H2O2浓度.
图4 给出了不同pH条件下反应体系中剩余H2O2的浓度.其中,右斜线柱状图代表反应气体是CH4的滴定结果,左斜线柱状图的反应气体是Ar的滴定结果,交叉线柱状图是上述二者的差值.由图4可知,随着溶液pH值增大,总消耗的H2O2浓度显著增加,说明强碱条件确实可以促进H2O2的分解.所研究的pH范围内,消耗的H2O2中75%以上均属于自分解,仅有低于25%的H2O2用于参加反应.因此,提高反应产量的关键之一就是降低H2O2自分解速率,以保持较高浓度的H2O2参加催化反应.
由上述实验结果可知,强碱条件不利于反应进行的原因是强碱条件会促进H2O2的自分解,降低参加催化反应的H2O2的量,从而抑制目标产物甲醇的生成.酸性条件可通过抑制H2O2的自分解来促进产物的生成.
在不同pH条件下,甲烷低温氧化制甲醇可能机理如Scheme 1所示.当pH<11.7时,H2O2分解成·OH自由基后在分子筛的活性位点处活化CH4,生成·CH3自由基,继而进一步生成CH3OH,甲醇继续发生过氧化反应生成甲酸和CO2;而当pH>11.7时,H2O2在分解成·OH自由基后主要发生自身歧化反应生成氧气和水[34].
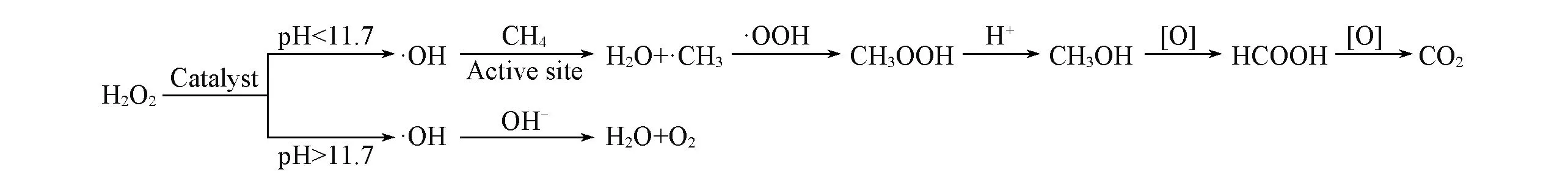
Scheme 1 Proposed mechanism for the oxidation of methane to methanol at low temperature with different pH values
2.6 反应体系探究
对反应后的反应液进行了ICP测试.表3为不同pH反应条件下Fe的浸出量.可知反应后的液体中均有一定量的Fe物种浸出,且随着pH降低,浸出的Fe物种含量显著增加,即浸出率显著变大.说明强酸条件会促进Fe析出,与文献[28]报道的结论一致.

Table 3 Amount of leached Fe under different pH values
为了探究本文反应体系是否存在均相催化的可能,反应后的液体离心后,将得到的上层清液用0.22μm的滤头过滤后置于烘箱中烘干.然后重新加入H2O2溶液,充入CH4气体进行反应.核磁共振谱图中未观察到产物的峰,说明体系浸出的Fe不能催化甲烷氧化反应.
为了探究该体系中各组分(催化剂、CH4、H2O2)存在的必要性,进行了多组平行实验.表4对比了不同反应体系的数据,可见,只有当CH4、H2O2和催化剂三者均存在时,反应才可以进行.

Table 4 Comparison of different reaction systems*
3 结 论
本文首先制备了0.5% Fe/ZSM-5催化剂,并采用XRD,ICP,Raman,DR UV-Vis和固体NMR表征手段研究了催化剂的结构和金属落位.进而研究了不同pH对Fe/ZSM-5低温催化CH4选择性氧化为含氧化合物(甲醇和甲酸)的影响,发现强酸介质有利于产物生成,但会增加Fe的浸出量;强碱介质促进H2O2自分解,不利于产物生成.本文还确定了该催化反应过程为多相,体系中析出的Fe物种不能催化该反应的发生.本研究得到的结论将为进一步优化Fe交换分子筛催化体系以及甲烷直接氧化制备甲醇的机理研究提供指导.

