基于链替代信号放大灵敏检测端粒酶活性的电化学方法
马艳蓉,江胜男,金 燕
(1.北方民族大学预科教育学院,银川750021;2.陕西师范大学化学化工学院,陕西省生命分析重点实验室,西安710062)
端粒酶(Telomerase)能够以其RNA作为模板,在染色体末端合成端粒重复序列(TTAGGG)n,从而维持端粒的长度稳定,使细胞永生化.研究表明,端粒酶在85%以上的人类肿瘤细胞中高表达,而在正常体细胞中的表达量则极低甚至不表达.因此,端粒酶是一种广谱性的肿瘤标志物[1~8],灵敏可靠检测其活性对于肿瘤的早期诊断和抗癌药物的研发具有重要意义.基于聚合酶链式反应(PCR)的端粒重复序列扩增法(TRAP)是检测端粒酶活性的经典方法,但其操作过程复杂、费时,会因为PCR过程带来假阳性结果,而且无法区分细胞内端粒酶活性的差异.为了实现端粒酶活性的灵敏、便捷检测,荧光法[9~12]、比色法[13,14]、化学发光法[15,16]及电化学法等方法不断涌现.由于具有设备简单、低廉、检测快速及响应灵敏等优点,电化学法已经成为生物分析的重要手段之一[17,18].Shao等[19]提出了一种基于端粒重复序列中鸟嘌呤电化学响应检测端粒酶活性的电化学方法.Wang等[20]基于DNA磷酸基团与钼酸盐反应合成了一种具有电化学活性的磷钼酸盐来检测端粒酶活性.Liu等[21]建立了一种基于T7核酸外切酶辅助循环反应用于检测癌细胞中端粒酶活性的电化学方法.Liu等[22]利用端粒酶延长产物形成的G-四链体DNAzyme催化苯胺,以合成具有电化学活性的聚苯胺来检测端粒酶活性.Lei等[23]以亚甲基蓝和对苯二酚为信号分子,构建了比率型电化学法用于检测端粒酶活性.Yang等[24]建立了一种基于金纳米棒(AuNRs)富集引起电化学响应检测端粒酶活性的方法.本文以标记二茂铁的T-DNA分子为信号探针,发夹型DNA探针(H-DNA)为捕获探针,基于端粒酶延长端粒DNA引物链来引发链替代反应,构建了一种简捷、灵敏检测端粒酶活性的电化学新方法.
1 实验部分
1.1 试剂与仪器
三羟甲基氨基甲烷(Tris,纯度>99.9%)购于Solarbio公司;无水氯化镁购于天津市光复精细化工研究所;高氯酸钾(纯度≥98%)购于成都市科龙化工试剂厂;盐酸购于上海活凯生物技术有限公司;实验用水为美国Pall Corporation实验室超纯水(18.2 MΩ·cm);DEPC水和上样缓冲液购于生工生物工程(上海)股份有限公司;限制性内切酶NtBbvCI购于New England Biolabs公司(美国);dNTPs、丙烯酰胺、甲叉双丙烯酰、β-巯基乙醇、EGTA和Tween 20均购自Sigma公司(美国);Taq DNA Ploymerase产自宝生物公司(日本);所用DNA均购于上海生工生物工程技术服务有限公司,序列如表1所示.

Table 1 Sequences of DNA probes
CHI440A型电化学工作站(上海辰华仪器有限公司),采用三电极系统:金电极作为工作电极(面积为3.14 mm2),饱和Ag/AgCl电极作为参比电极,铂丝电极作为对电极;超微量分光光度计(美国DeNovix公司);5424R型小型离心机(德国Eppendorf公司);PowerPac Basic型电泳仪(美国伯乐BIO-RAD公司);LS型超纯水机(美国PALL公司);pH酸度计(梅特勒仪器有限公司).
1.2 实验过程
1.2.1 细胞培养 将宫颈癌(HeLa)细胞培养于含10%(体积分数)胎牛血清的DMEM培养基中(含有100 U/mL青霉素、0.01 mg/mL链霉素和10%胎牛血清),传代后在37℃,95%(体积分数)空气和5% CO2条件下培养,直至贴壁细胞的丰度大于60%.
1.2.2 端粒酶提取 待细胞生长到对数生长期时,用胰蛋白酶消化细胞2 min,使贴壁的细胞从壁上脱落下来,收集1.0×106个HeLa细胞至1.5 mL的无菌离心管中.于800 r/min转速及4℃条件下离心4 min,并用冷的PBS缓冲液洗涤2次,弃掉上层清液.加入200μL CHAPS裂解液[包含10 mmol/L Tris-HCl(pH=7.5),1 mmol/L MgCl2,1 mmol/L EGTA,0.1 mmol/L PMSF,5 mmol/Lβ-巯基乙醇,8.13 mmol/L CHAPS和1.41 mol/L甘油),在冰浴上孵育30 min;在12000 r/min转速及4℃条件下离心20 min;取上层清液至无菌离心管中,储存在-80℃冰箱中.
1.2.3 TRAP法验证端粒酶活性 将1μL端粒酶裂解液(200 cells)加入含有200 nmol/L TS和0.2 mmol/L dNTPs的TRAP缓冲溶液中,终体积为20μL,将管口用封口膜包裹,于30℃水浴1.5 h.然后依次加入TS,ACX,dNTPs和Taq DNA聚合酶,放入PCR扩增仪中进行扩增.取10μL PCR扩增产物加入上样缓冲液中,混合均匀后取2μL加至浓度为12.5%的聚丙烯酰胺凝胶泳道上;依次加入固定液、银染液及甲醛液进行银染,在凝胶成像仪上进行拍照、分析.
1.2.4 链替代反应 将1μL端粒酶裂解液加入含有200 nmol/L TS和0.2 mmol/L dNTPs的TRAP延长缓冲溶液中,终体积为20μL.将混合物于37℃孵育3 h.将被端粒酶延长后产物与10μL 0.5μmol/L AT-DNA在37℃水浴下反应1 h,使延长产物与AT-DNA中的A-DNA结合,从而替换出带有二茂铁基团的T-DNA.
1.2.5 T-DNA与H-DNA的杂交反应 依次用1.0,0.3和0.05μm的α-Al2O3将金电极抛光后,分别用超纯水和75%乙醇超声5 min,置于0.5 mol/L H2SO4溶液中,在-0.3~1.5 V范围内以100 mV/s的速度进行循环伏安(CV)扫描,直至得到稳定的CV曲线,然后用超纯水冲洗电极表面.将20μL 1.0μmol/L巯基标记H-DNA滴加在干净的金电极表面,置于4℃冰箱中密封放置12 h,然后用1 mmol/L MCH在室温下反应3 h以封闭裸露的金电极表面,并用超纯水冲洗电极表面.取10μL链替代反应产物滴于电极表面,常温下放置90 min充分反应后冲洗干净.最后,将此电极置于0.1 mol/L KClO4溶液中,进行微分脉冲伏安(DPV)测定.
2 结果与讨论
2.1 检测原理
基于链替代反应构建了一种检测端粒酶活性的电化学方法,原理如Scheme 1所示.以5′端标记二茂铁基团的DNA(T-DNA)为信号探针,辅助DNA(A-DNA)与T-DNA部分互补杂交形成双链AT-DNA;当存在端粒酶时,端粒酶在TS的3′末端合成TTAGGG的重复序列,形成一条长的DNA单链;这条延长单链DNA含有多个TTAGGG的重复序列,能够与多条A-DNA杂交,释放出多条T-DNA链;T-DNA可与固定在金电极表面的H-DNA杂交,打开发夹结构,使得二茂铁基团靠近电极表面,从而产生电化学信号.基于电流的变化,该方法可简单、快捷地检测端粒酶活性.

Scheme 1 Schematic diagram of the electrochemical detection of telomerase activity
2.2 凝胶电泳分析
凝胶电泳常用来表征核酸和蛋白质分子质量和结构的变化.因此,利用凝胶电泳对HeLa细胞中提取的端粒酶活性进行了验证.图1(A)中泳道1~4分别为细胞裂解液、热失活端粒酶、HeLa细胞中提取的端粒酶及正常细胞中的提取物与TS,dNTP反应并经PCR扩增后的产物.可以看出,在其它条件一致时,泳道1,2和4没有出现TS延长扩增产物条带,只有泳道3出现TS延长扩增后的DNA条带,表明从HeLa细胞中提取的端粒酶是有活性的,可以延长TS.
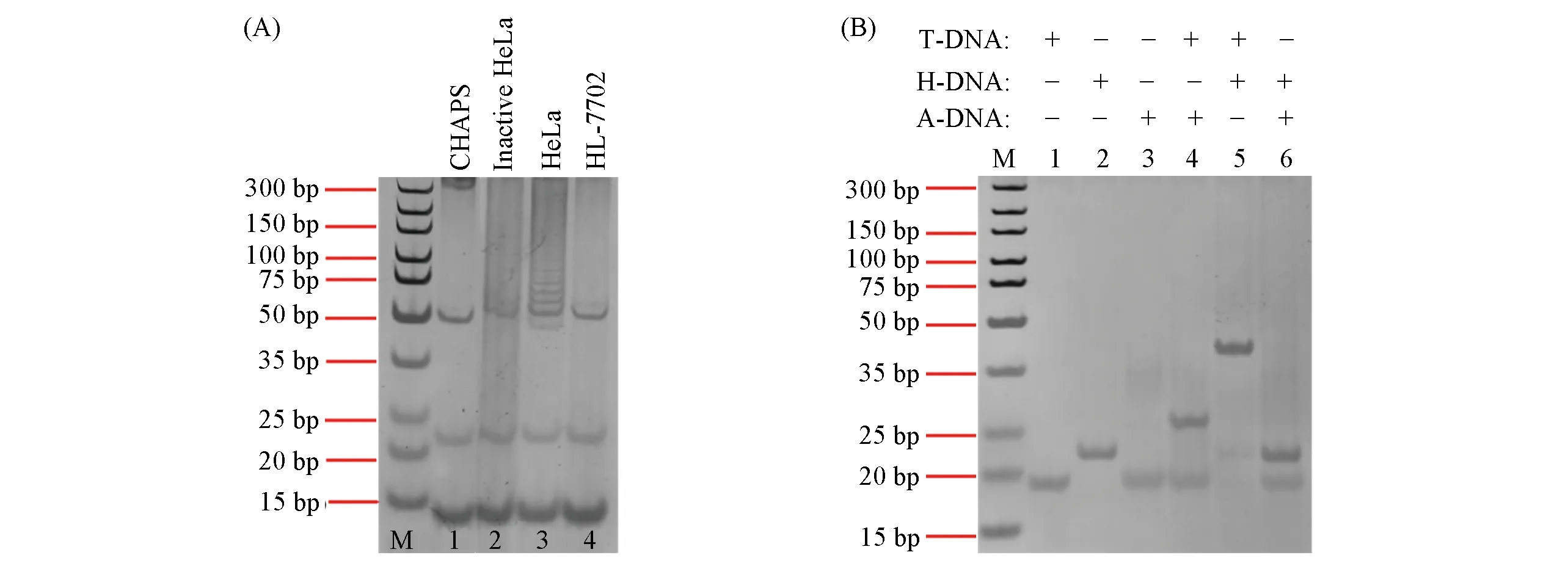
Fig.1 Verification of telomerase activity(A)and strand displacement reaction(B)by polyacrylamide gel electrophoresis
链替代反应的效率和特异性直接影响电化学测定端粒酶活性的性能.因此,采用凝胶电泳成像验证了链替代反应的效率和特异性.图1(B)中泳道1~3分别为T-DNA,H-DNA和A-DNA,泳道4为A-DNA与T-DNA于37℃反应30 min后的产物.可见,当A-DNA与T-DNA混合后,二者对应的DNA条带颜色变浅,并在其上方出现了一条分子量更大的新条带,说明A-DNA与T-DNA发生了杂交反应(泳道4).由泳道5可以看出,当H-DNA与T-DNA在37℃反应30 min后,在H-DNA位置的上方出现新的条带,说明T-DNA可以打开发夹H-DNA而发生杂交反应.泳道6为H-DNA与A-DNA的混合物,没有新的DNA条带产生,表明A-DNA不能与H-DNA发生杂交反应.电泳结果表明,DNA探针设计合理,链替代反应可如Scheme 1所示特异性发生.T-DNA能够与H-DNA发生杂交反应,致使二茂铁分子靠近电极表面,从而产生电化学信号.此外,利用IDT在线Oligo分析工具Oligo Analyzer计算了DNA探针发生杂交反应的吉布斯自由能(ΔG).结果表明,A-DNA与T-DNA反应的ΔG1=-129.47 kJ/mmol,A-DNA与端粒酶延长产物(CST)反应的ΔG2=-153.91 kJ/mmol,H-DNA与T-DNA反应的ΔG3=-170.41 kJ/mmol.ΔG值均小于0,表明反应可以自发进行,ΔG2<ΔG1,说明端粒酶延长产物可以替代出AT-DNA复合物中的T-DNA.
2.3 电化学检测端粒酶活性的原理验证
由Scheme 1可知,本工作是基于端粒酶特异性延长TS来引发链替代反应,从而将电化学信号探针富集到H-DNA修饰金电极表面.分别将CHAPS裂解液、失活端粒酶、正常细胞提取液及端粒酶依次与TS,ATDNA和H-DNA修饰电极反应后,测定金修饰电极的微分脉冲伏安(DPV)响应,结果[图2(A)]表明,只有在端粒酶存在时才检测到明显的DPV峰电流.这是由于CHAPS裂解液、失活端粒酶和正常细胞提取液均不能使引物TS延长,因而不能发生链替代反应置换出T-DNA,H-DNA不能与T-DNA杂交,因此就检测不到二茂铁的DPV电流.图2(A)结果表明,该电化学方法可以特异性地检测端粒酶活性.为了进一步验证原理,测定了金电极在5 mmol/L K3[Fe(CN)6]/K4[Fe(CN)6]溶液中的循环伏安(CV)曲线,结果如图2(B)所示.图2(B)中曲线a为裸金电极的CV曲线,曲线b为MCH/H-DNA/Au修饰电极的CV曲线.比较曲线a和b可以看出,修饰电极氧化还原峰电流明显降低,峰电位间距增大.这是由于DNA修饰和MCH封闭阻碍了K3[Fe(CN)6]/K4[Fe(CN)6]在电极表面的氧化还原反应,说明H-DNA和MCH固定在了金电极表面.CV曲线c和d分别表示热失活端粒酶和端粒酶与TS、ATDNA和H-DNA修饰电极反应后的CV曲线.CV曲线c与b基本重合,说明失活端粒酶无法延长TS来置换出T-DNA.因此,MCH/H-DNA/Au修饰电极表面基本没有变化.而当端粒酶存在时,经过链替代反应后,曲线d的峰电流增大,且氧化还原峰间距减小.这是由于端粒酶延长TS将T-DNA置换出来,T-DNA打开H-DNA的发夹结构,形成刚性的DNA双链结构,DNA间隙增大,使得K3[Fe(CN)6]/K4[Fe(CN)6]易于靠近电极表面发生循环伏安反应.这进一步验证了端粒酶延长TS所引发的链替代和杂交发应对电化学信号产生直接影响,表明用此方法检测端粒酶活性是可行且可靠的.
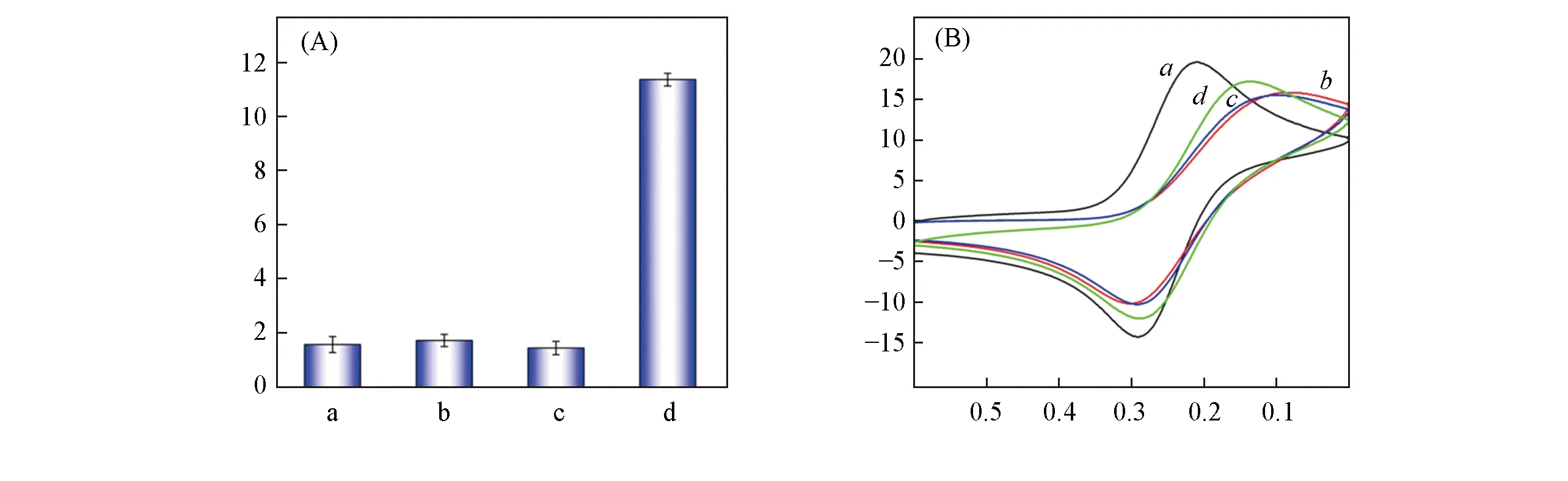
Fig.2 Proof-of-principle by DPV and CV
2.4 电化学交流阻抗表征
在5 mmol/L K3Fe(CN)6/K4Fe(CN)6溶液中,利用电化学交流阻抗法表征了电极的不同状态,结果如图3所示.图3谱线a为裸金电极的阻抗谱图,该谱图仅出现一个较小半圆,表明此时电极上几乎不存在阻挡电子转移的物质,[Fe(CN)6]4-/3-非常容易到达电极表面发生氧化还原反应;谱线b和c分别为H-DNA/Au电极和MCH/H-DNA/Au电极的阻抗谱图,其高频部分出现明显的半圆,且半圆的直径随组装层数增加而依次增大[25],表明H-DNA和MCH在电极表面的自组装阻碍了电子传递,而且随着组装层数的增加逐渐增强,[Fe(CN)6]4-/3-越来越难以到达电极表面;而当MCH/H-DNA/Au电极与T-DNA反应后,由谱线d可见半圆部分直径减小,表明T-DNA能特异性地打开H-DNA发夹结构,形成刚性较强的双链DNA,有更大的空隙利于[Fe(CN)6]4-/3-到达电极表面,阻抗值减小.交流阻抗测试结果与循环伏安测试结果一致,验证了H-DNA和MCH在金电极的自组装及T-DNA与H-DNA的杂交反应.

Fig.3 Electrochemical impedance spectroscopy of Au electrode under different conditions in 0.1 mol/L KCl aqueous solution containing 5 mmol/L K3Fe(CN)6/K4Fe(CN)6
2.5 实验条件优化
2.5.1 H-DNA浓度的优化 考察了H-DNA浓度对电化学信号的影响,测得的DPV峰电流随H-DNA浓度变化情况如图4(A)所示.可以看出,在0.1~1μmol/L之间时,随着H-DNA浓度的增加,DPV峰电流逐渐增大;当H-DNA浓度增大到1μmol/L时,峰电流达到最大值;而继续增大H-DNA浓度,峰电流降低.H-DNA作为捕获探针,可与T-DNA杂交,致使二茂铁分子靠近金修饰电极表面,从而检测到二茂铁的DPV峰电流.H-DNA浓度越大,可捕获的T-DNA越多,峰电流就越高.然而,当H-DNA浓度高于1μmol/L时,H-DNA在金电极表面过于密集,空间位阻会影响H-DNA与T-DNA的杂交效率,导致峰电流反而降低.因此,H-DNA的最佳浓度为1μmol/L.
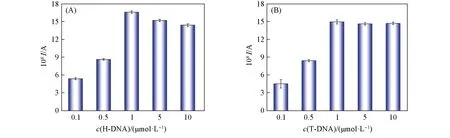
Fig.4 Effect of H-DNA concentration(A)and T-DNA concentration(B)on the peak current
2.5.2 T-DNA浓度的优化 T-DNA作为探针分子,其浓度直接影响检测结果.T-DNA浓度的优化结果如图4(B)所示.T-DNA浓度在0.1~1μmol/L范围内,DPV峰电流随其增加而逐渐增大.这是由于随着T-DNA浓度增大,通过与H-DNA杂交而捕获到电极表面的二茂铁分子增多,电流值就增大.当T-DNA浓度大于1μmol/L时,峰电流基本保持不变.因此T-DNA的最佳浓度为1μmol/L.
2.5.3 链替代反应时间的优化 端粒酶延长产物与AT-DNA发生链替代反应的时间对于链替代反应效率至关重要.实验中分别选择链替代反应时间为15,30,60,90和120 min进行了优化,结果如图5(A)所示.随着反应时间延长,链替代反应的效率增大,峰电流增加.反应60 min钟时峰电流达到最大,再延长反应时间,峰电流无明显变化.因此,最佳链替代反应时间为60 min.
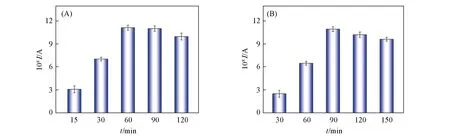
Fig.5 Effects of SDR reaction time(A)and hybridization time(B)on the DPV peak current
2.5.4 杂交反应时间的优化 电极表面H-DNA与T-DNA杂交反应时间会影响检测性能.因此,考察了H-DNA与T-DNA杂交反应30,60,90,120和150 min后的电化学信号,结果如图5(B)所示.随着杂交反应时间延长,杂交反应的效率增大,峰电流增加.反应90 min时峰电流达到最大.因此,杂交反应的最佳时间为90 min.
2.6 端粒酶活性检测
在最佳实验条件下,测定了0.1 mol/L pH=7.0的KClO4溶液中不同浓度的端粒酶对应的DPV峰电流值.结果表明,在一定范围内,随着细胞个数的增加,峰电流逐渐增强,线性关系如图6所示.可以看出,HeLa细胞数目在5~100个之间时,峰电流值与细胞个数呈现良好的线性关系,最低可实现对5个HeLa细胞中端粒酶活性的检测.

Fig.6 DPV peak current plotted against the number of HeLa cells
3 结 论
利用二茂铁分子作为电化学探针,基于端粒酶特异性延长TS引发的链替代反应,建立了灵敏检测端粒酶活性的电化学方法,最低可检测5个HeLa细胞中端粒酶的活性.该方法是一种高选择性、低成本、灵敏检测端粒酶活性的电化学新方法.

