芘与人血清白蛋白和牛血清白蛋白结合位点微环境极性的差异
李梦硕,张 静,刘 丹,朱亚先,张 勇
(1.近海海洋环境科学国家重点实验室(厦门大学),厦门大学环境与生态学院,厦门361000;2.河口生态安全与环境健康省重点实验室,厦门大学嘉庚学院,漳州363105;3.厦门大学化学化工学院化学系,厦门361005)
多环芳烃(PAHs)具有基因毒性、遗传毒性、发育毒性及“三致效应”等,会对人体健康造成潜在危害[1~3].PAHs进入人体血液后,溶解态的PAHs被迅速代谢,而另一部分则结合血清白蛋白被运输至各个器官[4].因此,研究PAHs与血清白蛋白的相互作用,对了解PAHs在人体内的吸收、代谢和毒性机制具有重要意义.然而,目前相关研究仍大量采用牛血清白蛋白(BSA)替代人血清白蛋白(HSA)作为模式蛋白[5~9].研究表明[10],HSA和BSA具有24%氨基酸序列的差异,其中BSA有2个色氨酸(Trp)残基Trp134和Trp213,而HSA只有1个色氨酸残基Trp214.Clara等[11]和Wani等[12]的研究表明,华法令、来那替尼和它莫西芬分别与HSA和BSA相互作用的结合猝灭常数有数量级的差异.此外,本课题组[13~15]利用荧光各向异性、同步荧光法、激发发射矩阵结合平行因子法(Excitation-emission matrix spectralparallel factor,EEM-PARAFAC)和分子动力学等方法研究了母环、烷基取代PAHs及其代谢产物与HSA或BSA的相互作用,发现HSA和BSA分别与不同甲基取代位置菲的作用存在差异.因此,进一步明确HSA及BSA与有机小分子污染物之间相互作用机制的差异十分必要.
本文采用稳态荧光光谱、荧光共振能量转移技术结合分子对接法,选择具有微环境极性探针性质的芘(Pyr)作为污染物有机小分子,分析比较了其分别与HSA和BSA相互作用时结合口袋微环境的极性变化、作用位点、作用距离等,揭示了Pyr与HSA和BSA相互作用的过程和机理间存在的差异.
1 实验部分
1.1 试剂与仪器
BSA(纯度>96%)、Pyr(A.R.级)和三羟甲基氨基甲烷(A.R.级)均购于阿拉丁试剂(上海)有限公司;HSA(纯度>96%)购自美国Sigma试剂公司;无水乙醇等其它药品(A.R.级)购自上海国药集团化学试剂有限公司.
QM 8000型荧光光谱仪(日本Horiba公司);Agilent 8453型紫外-可见分光光度计(美国Agilent公司);Five Easy Plus型台式pH计(美国Mettler Toledo公司).
1.2 实验方法
1.2.1 荧光光谱和紫外吸收光谱测定 将0.05 mol/L Tris-HCl缓冲溶液、1×10-6mol/L HSA和BSA及不同浓度的Pyr依次分别加入2组10 mL棕色比色管中,摇匀后静置30 min,待体系达到平衡后分别进行UV-Vis吸收光谱和荧光光谱测定.荧光光谱仪参数设定:激发和发射狭缝分别是3 nm和2 nm,延迟时间为0.05 s,步长为1 nm.分别测定激发波长为280 nm和295 nm时,Pyr-HSA和Pyr-BSA体系在300~450 nm范围内的发射光谱.
1.2.2 分子对接模拟 利用Auto Dock 4.2.1和Auto Dock Tools软件对Pyr与HSA和BSA分别进行分子对接,对接过程、参数均参考文献[16]方法.利用Pymol软件进行可视化研究,并计算最优构型结合口袋的Pyr周围0.4 nm范围内氨基酸的极性及其与色氨酸残基表观距离.
2 结果与讨论
2.1 Pyr与HSA和BSA结合位点疏水性的差异
研究[17~19]表明,PAHs与HSA和BSA的作用位点主要在ⅡA,ⅢA和IB子域,而不同结合位点微环境疏水性的对比研究鲜见报道.本文利用Pyr的373 nm/384 nm(I1/I3)微极性探针性质[20,21],考察了Pyr与HSA和BSA结合口袋微环境的极性差异.血清白蛋白因含有色氨酸(Trp)、酪氨酸(Tyr)和苯丙氨酸(Phe),在270~300 nm光激发下可发射较强的内源荧光.当激发波长为295 nm时,HSA中332 nm处的最大发射波长由Trp214贡献;而BSA中341 nm处的最大发射波长由Trp134和Trp213贡献.荧光光谱测定结果如图1所示,Pyr-HSA和Pyr-BSA体系中HSA和BSA的色氨酸残基荧光产生猝灭,表明Pyr与HSA和BSA的结合位点均靠近色氨酸残基.在Pyr-HSA体系中,结合态Pyr的I1/I3值随Pyr浓度的增加轻微下降(图2),说明其与HSA中的Trp214逐渐靠近.在Tris-HCl缓冲溶液中溶解态Pyr的I1/I3值为1.85,而与HSA和BSA相互作用后结合态Pyr的I1/I3值分别为1.36和0.92,可见结合态Pyr的I1/I3值均降低,且在BSA及HSA中结合位点微环境的极性具有差异.

Fig.1 Fluorescence spectra of HSA and BSA in the presence and absence of Pyr
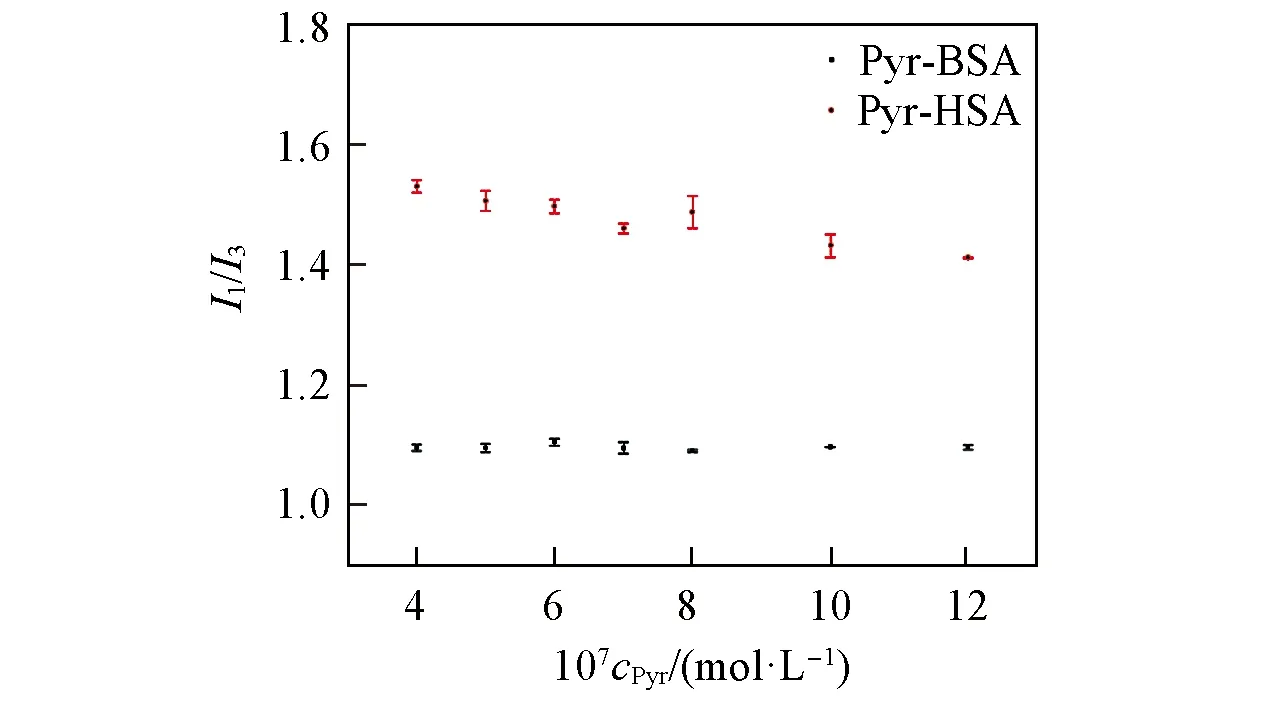
Fig.2 Trend in the I1/I3 ratio as a function of increasing Pyr concentration(λex=295 nm)
2.2 Pyr与HSA和BSA结合平衡常数的差异
研究[22,23]表明,Pyr与HSA和BSA的结合作用力以疏水作用为主,利用荧光猝灭法测定了Pyr-HSA和Pyr-BSA的猝灭常数(Ksv)、猝灭速率常数(Kq)和结合常数(Kb).如图3所示,随着Pyr浓度的增加,BSA在340 nm的荧光发射峰强度逐渐降低,HSA在334 nm的荧光发射峰强度逐渐降低,表明HSA和BSA均与Pyr发生相互作用导致其内源荧光发生猝灭[24].利用Stern-Volmer方程[25]计算了Pyr对HSA和BSA的猝灭常数(Ksv)和猝灭速率常数(Kq)(图4),结果列于表1.可见,Pyr-HSA和Pyr-BSA体系的Kq均大于生物大分子在溶液中的最大动态猝灭常数1010mol-1·s-1,说明上述体系均以静态猝灭为主.作用体系的Kb值从Pyr-HSA的1.86×107L/mol降低到Pyr-BSA的1.71×105L/mol.
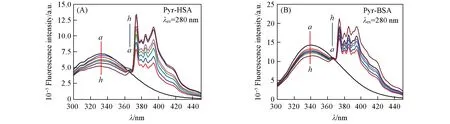
Fig.3 Fluorescence quenching spectra of HSA(A)and BSA(B)by Pyr at 298 K
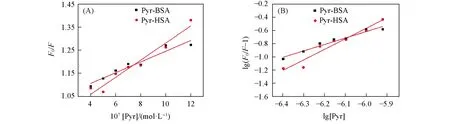
Fig.4 Stern-Volmer(A)and double logarithmic(B)plots for the fluorescence quenching of HSA and BSA by Pyr
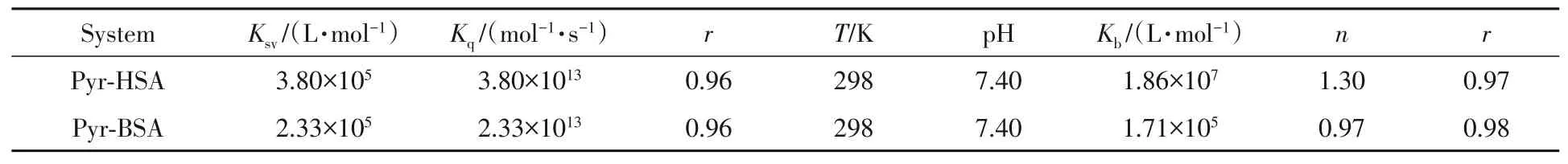
Table 1 Binding constants and number of binding sites of the Pyr-HSA/BSA systems(λex=280 nm)
2.3 Pyr与HSA和BSA作用距离的差异
为进一步明确Pyr与HSA和BSA结合位点是否存在差异,需明确结合在HSA和BSA中的Pyr与色氨酸残基的作用距离.能量转移效率(E)和结合距离(rDA)可用于探讨Pyr与HSA和BSA作用距离的差异.如图5所示,受体Pyr满足同供体HSA和BSA中色氨酸残基发生能量转移的要求.根据Först’s非辐射能量转移理论[26,27],采用FelixGX 4.1.2软件计算了Pyr分别与HSA和BSA之间的E和rDA.结果显示,体系中结合态Pyr与HSA和BSA中色氨酸残基的表观距离(R0)分别为2.37和2.34 nm,与文献[22,23]报道结果在同一数量级.如表2所示,当体系中Pyr与HSA和BSA的浓度比为1∶1时,Pyr与HSA的E值略高于BSA.与上文Pyr-HSA和Pyr-BSA体系的Kq值相比可知,结合态Pyr与HSA和BSA中色氨酸残基的E值与其相应的结合平衡常数呈正相关.此外,HSA和BSA中色氨酸残基的个数及所在子域均不同,表明Pyr与HSA和BSA的作用位点可能在不同子域.

Fig.5 Absorption spectrum of Pyr(a)and normalized emission spectra of HSA(b)and BSA(c)to demonstrate the extent of overlap between donor and acceptor

Table 2 Calculated Förster radius(R0)between the donor and the acceptor(λex=295 nm)
2.4 Pyr与HSA和BSA结合位点的差异
为在分子层面获得Pyr与HSA和BSA在结合过程中的作用位点及周围氨基酸残基极性的详细信息,采用Auto Dock4.2.1软件计算了Pyr在HSA和BSA中的最佳结合位点.取Pyr与HSA和BSA对接能量最低的3种构型,Pyr在HSA中位于ⅡA,ⅢA和IB子域结合位点的结合自由能分别为-7.14,-7.04和-6.75 kJ/mol,Pyr在BSA中位于ⅡA,ⅢA和IA子域结合位点的结合自由能分别为-7.79,-7.77和-6.26 kJ/mol,表明Pyr分别与HSA和BSA的结合过程均为自发过程.Pyr在HSA和BSA中不同的结合位点分别是IB子域和IA子域,且其结合位点周围氨基酸残基的极性是影响PyrI1/I3值的主要原因之一.Pyr在HSA中IB子域结合位点周围0.4 nm范围内的非极性氨基酸有Phe149,Phe157,Gly189和Leu154,极性氨基酸有Ser193,His146和Tyr161,离子型氨基酸有Arg186和Lys190[图6(A)],结合2.1节实验结果,表明IB子域因其不完全疏水而表现出一定极性.
与上文结果比较可知,结合态Pyr与BSA中色氨酸残基的平均距离与IA子域结合位点处的平均距离相一致,BSA中IA子域结合位点周围0.4 nm范围内的非极性氨基酸有Ala253,Ala257,Ala260,Pro151,Leu282,Leu283和Leu14,极性氨基酸有Ser286,His18和Arg256[图6(B)],表明结合态Pyr在BSA中作用位点周围非极性氨基酸较多,比HSA中结合位点周围微环境的极性更小,该结果与2.1节结合口袋疏水性的实验结果一致.
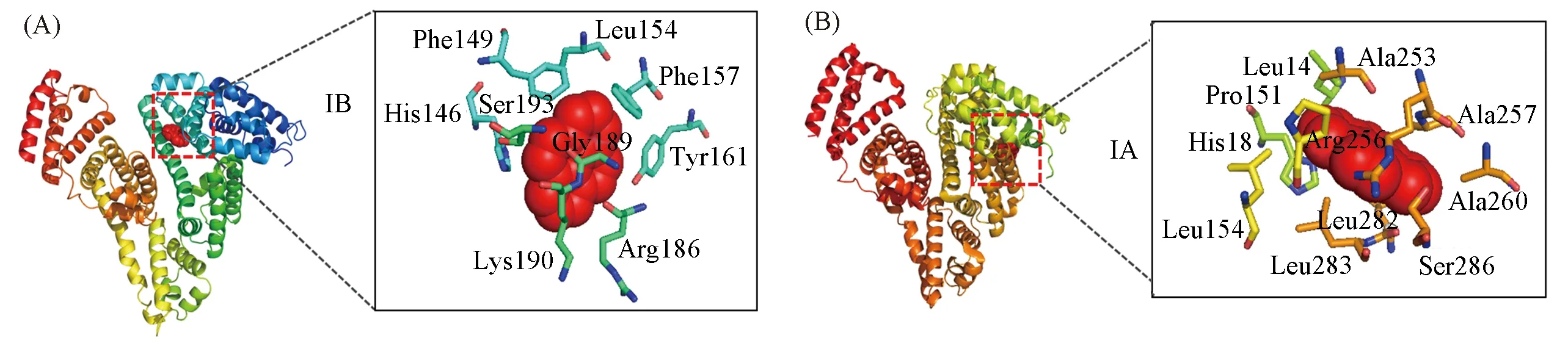
Fig.6 Molecular docking images of HSA(A)and BSA(B)with Pyr at different binding sites
3 结 论
采用稳态荧光光谱、荧光共振能量转移技术结合分子对接法,证实了微极性探针Pyr分别与HSA和BSA相互作用时,结合位点及其微环境极性不同、与色氨酸残基的作用距离不同.因此,采用BSA代替HSA开展有关PAHs污染物与血清白蛋白相互作用机制研究时,应考虑上述因素.同时,今后若能进一步结合时间分辨荧光光谱、圆二色光谱和竞争结合反应等方法深入研究相互作用时HSA和BSA的构象及生理功能变化的异同,有望更好地从分子水平全面了解PAHs分别与HSA和BSA作用机制的差异.

