用于小动物活体的荧光-光热双模成像系统
陈宏达,张 婳,王振新
(1.中国科学院长春应用化学研究所电分析化学国家重点实验室,长春130022;2.中国科学技术大学应用化学与工程学院,合肥230026)
随着小动物成像技术的发展,活体成像技术的种类及应用范围日益扩大,并涌现出多种用于小动物成像的专业设备,为现代生物医学基础研究以及临床诊断研究提供了有力工具[1,2].小动物活体成像技术是指应用影像学方法对活体状态下的生化过程进行研究的技术,主要包括光学成像(Optical imaging)、核磁共振成像(MRI)、电子计算机断层扫描(CT)、正电子发射计算机断层成像(PET)和超声成像(US)等[3~7].其中,光学成像技术因具有非电离、非接触、灵敏度高、高通量和成本低等优点,被广泛应用于疾病诊断、药物设计、辅助治疗及预后监测等领域[8~12].利用灵敏的光学检测系统[如电荷耦合器件(CCD)、光电倍增管(PMT)等],活体光学成像可在活体组织、细胞及分子水平上使体内复杂的生化过程实现可视化,从而对其生物学行为进行定性和定量研究[6].小动物活体光学成像技术主要包括生物发光成像和荧光成像2种技术,其中荧光成像是采用荧光材料/物质(如荧光蛋白、有机荧光染料、荧光上转换纳米粒子及量子点等)标记细胞内或体液中特定的分子后再进行成像[7],因荧光信号远强于生物发光,且具有操作简单、灵敏度高、实时直观、成像快速、成本低和可同时观测多分子事件的优势,逐渐成为一种研究肿瘤组织/细胞中特定分子表达/活性水平变化规律的理想方法,在肿瘤的发生发展及转移监测中展现出重要作用[13~15].目前,国内外已有多家企业和研究机构研制出了荧光成像系统,这些系统均只具备单一的荧光成像功能,功能相对简单,无法监测到活体治疗整个过程.
与传统的有机荧光染料相比,掺杂稀土元素的上转换纳米粒子(UCNP)能吸收低能量的近红外光(NIR)并将其转化为高能量的发射光(上转换发光,UCL),具有大的反斯托克斯位移,可有效降低背景荧光干扰,有利于提高信噪比,同时UCNP具有窄的发射光带宽,适合多路成像,无光漂白,可进行长时间重复成像[16~20].通过合适的物理/化学反应对UCNP进行功能化,可实现UCNP的UCL成像与其它成像模式(MRI,CT,PET等)或治疗手段(光热治疗、光动力治疗等)的结合,进一步应用于肿瘤的靶向多模态成像或治疗[21,22].诊疗一体化是目前临床研究的一个重要目标,但现有的单一荧光成像系统仅能单纯地指导化疗,而化疗作为一种全身性的治疗手段,很难对病灶部位实施精准治疗.光热治疗是目前肿瘤治疗研究的热点,将具有较高光热转换效率的材料富集在肿瘤组织附近,在外部激光照射下将光能转换为热能来杀死癌细胞,进而实现对肿瘤部位的靶向治疗.利用红外热成像仪可实时监测肿瘤治疗过程中的温度变化,具有无创、无损、简便快捷等优点.将荧光成像与热成像结合能够实现诊断和治疗一体化,对疾病的早期诊断和精准治疗具有重要意义[23].
本文报道了一种小动物活体荧光-光热双模成像系统,该系统集成了荧光成像和热成像,其中,荧光成像部分激发光波长范围为435~980 nm,可实现常见有机荧光染料分子的荧光成像和近红外激发的上转换发光成像,通过CMOS检测器采集荧光图像,成像速度快,灵敏度高;热成像部分采用808 nm近红外激光作为激发光源,可实现光热治疗,同时热成像仪通过采集非接触探测红外能量将其转换为电信号,生成热图像和温度值.利用研制的小动物活体荧光-光热双模成像系统,实现了通过尾静脉注射到荷瘤小鼠体内的聚多巴胺包裹的上转换纳米探针(UCNP@PDA)的荧光成像和热成像,同时在纳米探针表面负载上化疗药物阿霉素(DOX)后,实现了光热对药物可控释放过程的实时监测.
1 双模成像系统的构建
图1 为研制的小动物活体荧光-光热双模成像系统的光路图和实物照片.荧光成像部分采用反射式荧光成像方式,由发射源发射激光并通过准直镜经反射滤光片照射到载物台上的小动物躯体上,其体内的荧光探针受到激发并发射出荧光光子.这些荧光光子经生物组织吸收和散射后逸出表面,再经过2个长通滤光片,最终被探测器捕获,并通过采集控制软件处理后成像.热成像部分,当808 nm激发光经反射滤光片照射到小动物躯体上,其体内的光热试剂吸收近红外光的能量并转换为热能,导致局部温度升高,通过热成像仪对照射部位的红外辐射探测,并加以信号处理、光电转换等将温度分布图像转换成可视图像.此外,2种成像既可独立进行也可同时进行,即光热过程中如有荧光信号改变,可同时采集荧光成像和热成像.
所构建的系统中,近红外激发光源(808和980 nm)采用MW-GX-808-980/5W半导体激光器(长春镭仕光电科技有限公司定制),其激光的辐射功率连续可调,且最大输出功率分别可达到4900 mW(808 nm)和5250 mW(980 nm).为了使激光光斑能覆盖实验小鼠的主要器官和组织,在激光出口安装一个扩束镜,扩束后的光斑直径约为20 mm.荧光激发光源采用HPX-2000高能连续氙灯光源,波长范围为435~810 nm,可满足常用有机荧光染料的激发波长.荧光成像检测器选用高灵敏度CMOS探测器,其有效探测波长范围为300~1000 nm,图像分辨率为2590×2048 dpi,成像速度最快可达51 frame/s,信噪比为62.1 dB.探测器前的成像物镜焦距为25 mm,光圈范围为F1.8~F16.滤光片为定制的长通滤光片,光学密度大于5.0,不同滤光片对应的透射带分别为400~700 nm,500~600 nm和600~750 nm.热成像仪选用FLIR C2红外热像仪,成像视野为41°×31°,成像分辨率为80×60(4800测温像素),温度范围为-10~150℃,温度分辨率为0.1℃.载物台采用三维移动平台设计,可在三个维度进行调节,移动范围为70 mm/30 mm/80 mm,以实现对小鼠不同部位的成像.此外,本系统可外接小动物麻醉机,在成像时利用异氟烷气体麻醉剂对小鼠进行麻醉,诱导期短且安全性高.
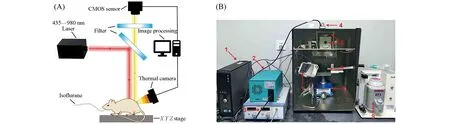
Fig.1 Light path of imaging system(A)and photograph of imaging system(B)
2 结果与讨论
2.1 成像灵敏度
为了测试该系统近红外荧光成像的灵敏度,将参照文献[24]方法合成的NaErF4∶10%Yb UCNP用于测试成像.图2(A)为该UCNP的UCL光谱和TEM照片,可见其分散性良好、尺寸均一,平均粒径约为(32±3.5)nm;在980 nm近红外激光激发下,UCNP发射波长分别位于541和650 nm,且在红光区荧光信号更强.利用搭建的荧光成像系统分别对浓度为5,10,15,25,50和100μg/mL的UCNP进行测试,利用Image J软件对成像的图片进行信号采集,并用“Intensity”代表信号的强度,再通过Image Pro Plus软件把荧光信号进行伪彩处理.如图2(B)和(C)所示,在激发波长为980 nm,激光功率为0.5 W/cm2,相机的曝光时间为100 ms时,随着UCNP浓度的增加,信号逐渐增强,当浓度为5μg/mL时,仍可检测到成像信号,且信噪比大于7.5,表明该系统具有较高的荧光检测灵敏度.

Fig.2 UCL fluorescence spectrum and TEM image(inset)of UCNP(A),UCL images and pseudo-color images of UCNP at different concentrations at the excitation wavelength of 980 nm with laser power density of 0.5 W/cm2(B)and the corresponding signal intensity in(B)(C)
2.2 荧光穿透深度
为了探索该系统对组织的穿透能力,将不同厚度(2,4,6,8,10和12 mm)的鸡胸肉分别放置在装有0.1 mL UCNP(0.1 mg/mL)和0.1 mL DOX(0.1 mg/mL)孔板的顶部.分别采用980 nm(1.5 W/cm2)激光照射UCNP溶液,488 nm(45 mJ/脉冲)激光照射DOX溶液,采集鸡胸肉切片的荧光成像图.定义荧光信号强度为背景信号强度5倍以上时,代表其具有较好的穿透深度.如图3(A)所示,UCNP的上转换发光信号随着鸡肉穿透深度的增加而不断减弱,穿透深度可以达到10 mm,说明近红外成像具有较好的穿透深度;而对于DOX荧光成像,在鸡肉厚度达到4 mm时仍可观察到荧光信号,这一厚度可满足小鼠皮下肿瘤和深层的组织荧光成像.
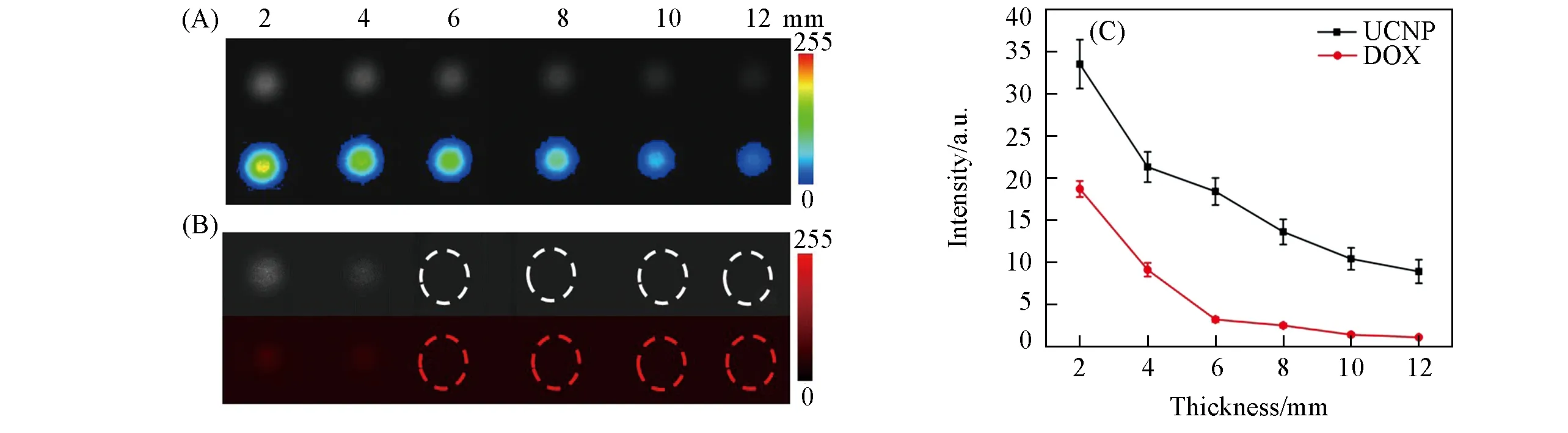
Fig.3 UCL images and pseudo-color images of UCL(A),DOX fluorescence imaging of fluorescence passed through chicken breast slices with different thicknesses(B)and the corresponding fluorescence signal intensities of(A)and(B)(C)
2.3 光热控制药物释放的体外监测
将DOX负载在纳米光热试剂上,考察了光热对药物的控制释放.在UCNP表面包裹厚度为5 nm的PDA,通过共价键和π-π键作用,将DOX负载到PDA表面,得到UCNP@PDA-DOX纳米复合材料,其生物安全性已得到证明[23].取0.3 mL 5 mg/mL UCNP@PDA-DOX置于孔板中,同时采用488和808 nm激发光源照射溶液,通过热成像仪记录溶液温度变化情况,同时通过荧光成像仪采集DOX荧光信号的变化.如图4所示,当没有808 nm激光照射时,溶液温度不变,且监测不到DOX的荧光信号.而当有808 nm激光(1.5 W/cm2)照射时,溶液温度不断上升,7 min后几乎不再变化,最高温度为57.9℃;在4 min开始监测到DOX信号,此时溶液温度为52.7℃,之后随着温度升高DOX荧光信号不断增强,表明DOX在逐渐释放.当通过808 nm近红外激光照射溶液时,引起聚多巴胺光热效应,加速了聚合物的降解,从而促进DOX的释放.以上结果表明,该系统可实时监测光热对纳米药物的可控精准释放.
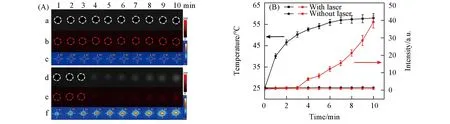
Fig.4 DOX fluorescence imaging(a,d),pseudo-color images(b,e)and thermal imaging(c,f)of UCNP@PDA-DOX without(a—c)or with(d—f)808 nm near infrared laser irradiation(A)and the corresponding fluorescence signal intensities and temperature data(B)
2.4 活体近红外荧光成像
实验中考察了该系统的近红外荧光成像效果.构建了荷瘤裸鼠(MDA-MB-231人乳腺癌细胞接种)模型,将200μL 1 mg/mL的UCNP@PDA-DOX经尾部静脉注射到小鼠体内,在980 nm近红外激光照射下,分别采集小鼠肿瘤和肝脏部位在注射前后不同时间点的荧光图像.荧光图像经伪彩处理后与明场照片叠加获得,其轮廓边缘清晰可见,成像信噪比较高.如图5所示,小鼠肿瘤和肝脏的UCL信号不断增强,在4 h达到最强后又逐渐减弱,表明4 h时UCNP@PDA-DOX在小鼠体内富集最多,24 h时后信号强度明显减弱,纳米探针通过肝脏代谢排出体外,表明该系统可用于活体肿瘤及深层组织的荧光成像,通过荧光信号的强弱可评估纳米探针在肿瘤和肝脏内的富集和代谢过程.
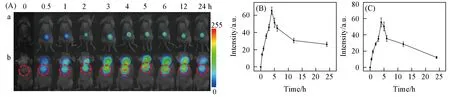
Fig.5 UCL imaging of the tumor sites(a)and liver(circles)sites(b)at different time after injection with UCNP@PDA-DOX(A),the corresponding fluorescence signal intensities of tumor sites(B)and liver sites(C)(0 h means pre-injection)
2.5 活体光热治疗和药物释放监测
使用该系统对荷瘤裸鼠的光热-化疗联合治疗过程进行了监测.在纳米探针UCNP@PDA-DOX注射4 h后,肿瘤部位达到最大富集量时,采用808 nm近红外激光对肿瘤部位照射10 min,通过热成像仪监测肿瘤部位的温度变化,同时采集DOX在488 nm激发下的荧光信号变化.如图6所示,照射5 min后温度达到45℃,能够杀死癌细胞,实现光热治疗.在照射6 min后,当肿瘤部位温度达到49℃时,开始监测到DOX荧光,随后信号不断增强,表明此时DOX已经开始在肿瘤部位大量释放,实现化疗.这表明该系统可实时监测皮下肿瘤部位光热控制药物释放的过程.
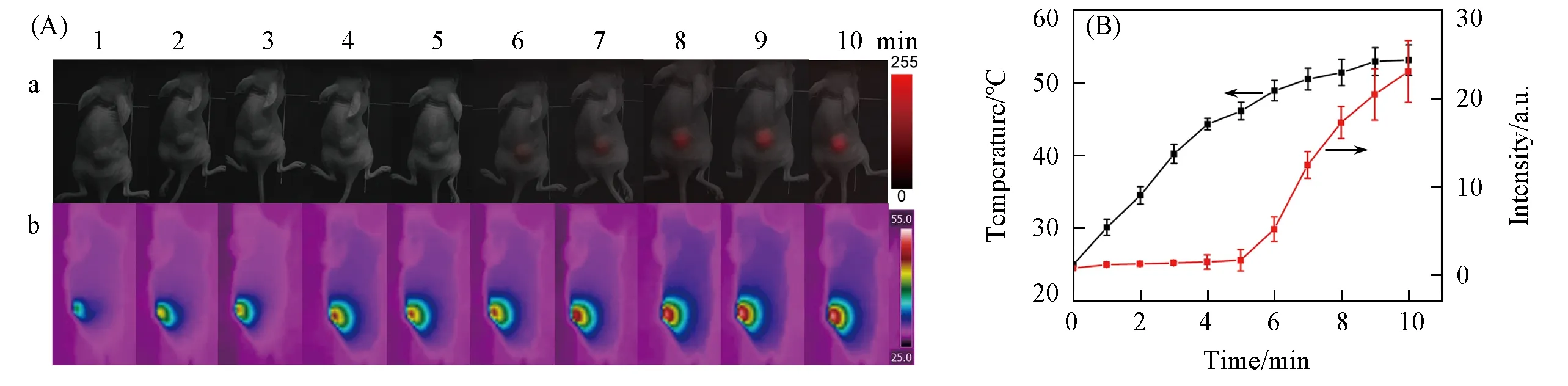
Fig.6 In vivo fluorescence images(a)and thermal images(b)of tumor sites with 808 nm NIR laser irradiation for 10 min after intravenous injection of UCNP@PDA-DOX at 4 h post-injection(A)and the corresponding fluorescence signal intensities and temperature data,respectively(B)
体外荧光穿透实验结果表明该系统能监测到4 mm深度的荧光信号,为了考察系统对深层组织/器官的成像能力,监测了小鼠肝脏部位DOX释放情况.将纳米探针UCNP@PDA-DOX通过尾静脉注射到小鼠体内4 h后,采用808 nm近红外激光照射肝部10 min,刺激DOX释放.如图7所示,在照射7 min后温度达到47℃时,监测到肝部DOX的荧光信号,随后逐渐增强,表明达到一定温度后DOX在肝部开始逐渐释放,且该系统能够监测到释放过程.以上实验表明,该系统对皮下肿瘤和深层组织/器官(比如肝脏)均能实现纳米药物的富集成像和可控释放监测,这对病变部位实施精准治疗具有重要意义.
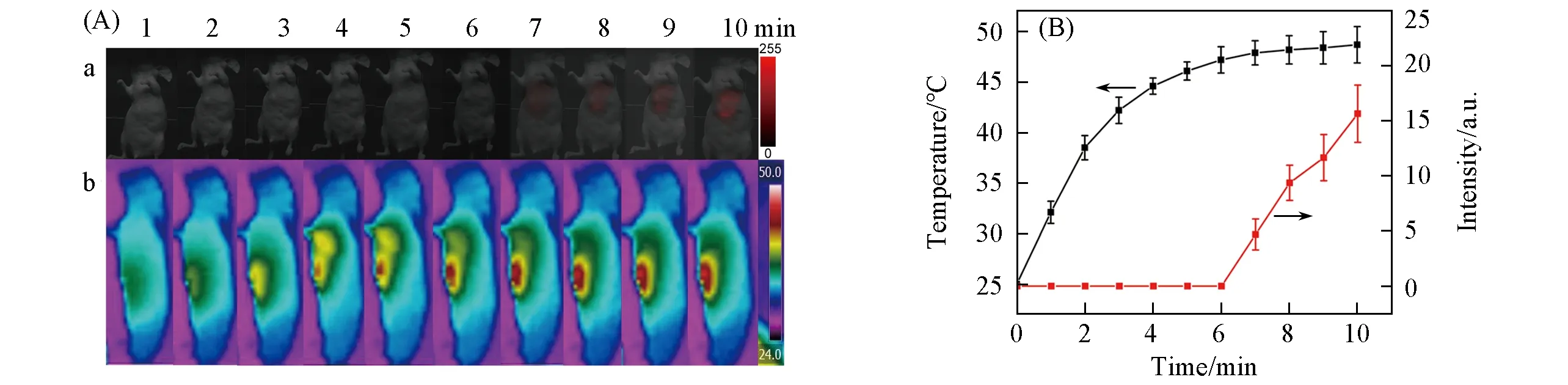
Fig.7 In vivo fluorescence images(a)and thermal image(b)of liver sites with 808 nm NIR laser irradiation for 10 min after intravenous injection of UCNP@PDA-DOX at 4 h post-injection(A)and the corresponding fluorescence signal intensities and temperature data,respectively(B)
3 结 论
将生物纳米技术、分子荧光成像技术和热成像等技术结合应用,研制出小动物活体荧光-光热双模成像系统,其集成了多波长荧光成像和热成像,具有较高的荧光成像灵敏度、较快的采集速度(51 frame/s)和较高的图像分辨率(2590×2048 dpi),在近红外荧光成像时具有较大的穿透深度以及0.1℃的热成像分辨率.将该系统与纳米探针UCNP@PDA-DOX结合使用,可通过上转换发光成像实时监测探针在活体小鼠肿瘤和肝脏内的富集过程,并能够通过808 nm激光照射对小鼠进行光热治疗,同时刺激DOX药物释放,利用热成像仪记录小鼠的温度变化,并通过荧光成像监测药物的释放过程.利用该系统可以对标记有特定荧光探针的生物分子、活细胞、活体小动物的器官和组织等进行成像,进而实时地观察生物分子在活体内的表达,及肿瘤的发生、生长、转移和药物的治疗效果等.因此,该系统有望在疾病的早期诊断和精准治疗、药物筛选及生命机理研究等领域得到广泛应用.

