干扰KIF14基因对子宫内膜癌细胞顺铂耐药的影响
刘 琼 张 欣 冯 燕 朱 琰
上海中医药大学附属曙光医院(200021)
子宫内膜癌易发于围绝经期和绝经后女性[1]。在我国发病率居女性生殖系统恶性肿瘤第2位[2]。化学疗法是目前标准治疗方法。化疗药物顺铂为抗癌药[3]。但患者可能会产生对顺铂耐药性,大大降低治疗效果。驱动蛋白家族成员14(KIF14)是潜在的致癌基因,参与各种癌症转移[4]。目前多数研究认为,KIF14过表达可能导致快速且易出错的有丝分裂,从而在肿瘤发生过程中诱导非整倍性[5];过表达的KIF14促进恶性肿瘤,如视网膜母细胞瘤、前列腺癌和卵巢癌[6-8]。然而,关于KIF14在子宫内膜癌发生中的作用研究较少。因此,本研究通过分析KIF14基因对顺铂子宫内膜癌耐药细胞增殖、凋亡及顺铂敏感性的影响,探讨子宫内膜癌有效治疗方法。
1 材料与方法
1.1 主要试剂与仪器
子宫内膜癌细胞Ishikawa、子宫内膜癌顺铂耐药细胞株Ishikawa/DDP(中国科学院上海细胞库);Trizol试剂盒、Promega反转录试剂盒、SYBR green(美国Thermo公司);siRNA-KIF14、siRNA-NC(美国圣克鲁斯公司);LipofectamineTM 2000 试剂盒(invitrogen公司);RT-qPCR引物(上海捷瑞生物工程有限公司);ki-67兔单克隆抗体(ab9260,美国Merck公司)、KIF14兔多克隆抗体(ab71155)、Bax兔单克隆抗体(ab32503)、MDR1兔单克隆抗体(ab170904)、P-gp兔多克隆抗体(ab262880,英国Abcam公司);β-actin兔单克隆抗体(#4970)、cleaved-Caspase-3兔单克隆抗体(#9661)、山羊抗兔IgG二抗(#7074,德国CST公司)。CFX96 Touch实时荧光定量PCR系统(美国Bio Red公司)、流式细胞仪(美国Thermo 公司)。
1.2 RT-qPCR和western-blot检测KIF14表达
使用Trizol试剂盒提取子宫内膜癌细胞Ishikawa及子宫内膜癌顺铂耐药细胞株Ishikawa/DDP中的总RNA。通过Promega反转录试剂盒合成cDNA,使用SYBR green在 CFX96 Touch实时荧光定量PCR系统上进行定量PCR。条件如下:95℃下热循环10 min,95℃预变性30 s,变性15 s,60℃退火30 s,72℃延伸15 s,循环40次。以GAPDH作为内参基因。重复3次实验。采用2-△△Ct方法进行相对定量分析。引物见表1。收集细胞,在具有蛋白酶抑制剂混合物的放射免疫沉淀测定缓冲液中裂解。用Pierce BCA蛋白质分析试剂盒确定蛋白质样品浓度。用等量蛋白质通过10%SDS-PAGE分离,转移至硝酸纤维素膜。室温下用5%脱脂牛奶封闭1 h,将膜与KIF14兔多克隆抗体(1:5000)4℃孵育过夜。第二天室温复温1 h后用TBST洗涤后,加入山羊抗兔IgG二抗孵育(1:5000)。以β-actin作为内参蛋白。使用化学发光试剂盒检测,使用ImageJ软件定量分析。重复3次实验。
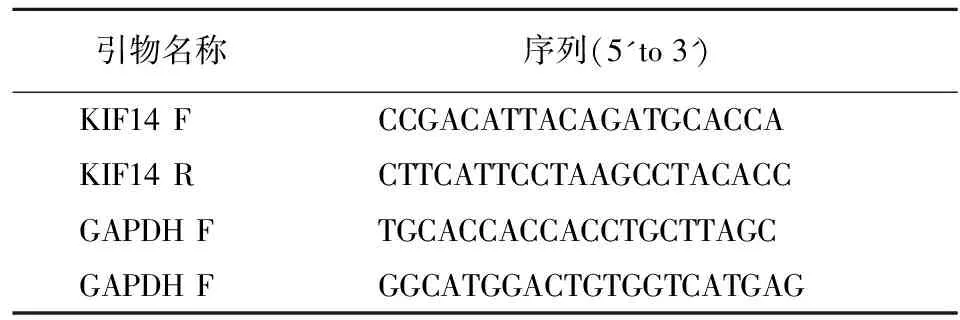
表1 Real-time PCR引物
1.3 细胞培养和转染
子宫内膜癌顺铂耐药细胞株Ishikawa/DDP和子宫内膜癌细胞Ishikawa在10%胎牛血清(FBS)且含有链霉素的RPMI 1640培养液,置37℃、5%CO2培养箱。取对数生长期细胞胰蛋白酶消化,用含10% FBS的RPMI 1640培养基调整细胞密度为5×106/ml,24孔培养板培养过夜,当细胞培养达到80%融合后转染。用LipofectamineTM2000试剂盒转染,将40 nM的siRNA-KIF14及siRNA-NC转染Ishikawa/DDP细胞,作为si-KIF14组和si-NC组,其中耐药组细胞不做处理。
1.4 克隆形成实验检测细胞增殖
取对数生长期各组细胞制备细胞悬液作梯度倍数稀释,分别接种含培养液皿中培养2~3周,当培养皿中出现肉眼可见克隆时终止培养。弃上清液,4%多聚甲醛固定,GIMSA染色液染10~30 min。重复3次实验。计算克隆形成率(%)=(克隆数/接种细胞数)×100%。
1.5 细胞凋亡
收集各组对数生长期细胞(3×106个/ml)离心弃培养液。PBS洗涤1次,加入冰预冷的70%乙醇4℃固定1 h。1000 r/min离心弃固定液,用PBS重悬5 min。400目筛网过滤后离心弃去PBS。加入PI染液染色,4℃避光30 min。用流式细胞仪检测,PI用氩离子激发荧光,激光光波波长488 nm,发射光波波长大于630 nm,产生红色荧光分析PI荧光强度的直方图也可分析前散射光对侧散射光的散点图。重复3次实验。
1.6 ki-67、Bax、cleaved-Caspase-3、MDR1、P-gp表达
用western-blot检测相关蛋白,方法同1.2。其中ki-67、Bax、P-gp(1:2000)、cleaved-Caspase-3(1:1000)、MDR1(1:3000)。重复3次实验。
1.7 顺铂敏感性
将各组细胞以104个/孔的密度接种到96孔板中。24 h后,将细胞用顺铂(0、1、2、4、8、16、32、64 μg靏/ml)处理48 h MTT测定评估细胞活力。加入10 μl靗 MTT,孵育4 h后吸出培养基。每孔加入100 μl DMSO,以溶解结晶。用酶标仪在490 nm处测量吸光度。重复3次实验。
1.8 数据统计
2 结果
2.1 KIF14在顺铂耐药细胞中的表达
与Ishikawa细胞(1.00±0.05、0.91±0.06)比较,子宫内膜癌顺铂耐药细胞株Ishikawa/DDP中KIF14 mRNA(2.37±0.14)和蛋白表达(1.50±0.08)均升高(P<0.001)。见图1(2250页)。
2.2 KIF14转染效果
si-KIF14组细胞KIF14 mRNA表达水平(0.28±0.03)低于耐药组(1.00±0.06)和si-NC组(0.98±0.04)(P<0.001)。
2.3 干扰KIF14抑制顺铂耐药细胞Ishikawa/DDP增殖
干扰KIF14后,与耐药组(419±31、1.01±0.06)和si-NC组(432±35、0.98±0.06)比较,si-KIF14组细胞克隆形成数目(252±32)下降(P<0.01),ki-67蛋白表达(0.15±0.02)下降(P<0.001)。见图2(2250页)。
2.4 干扰KIF14促进顺铂耐药细胞Ishikawa/DDP凋亡
干扰KIF14后,Ishikawa/DDP细胞凋亡率(27.52±1.32)%,Bax及cleaved-Caspase-3蛋白表达(1.01±0.06、1.03±0.06)均高于与耐药组[(4.29±1.07)%、0.50±0.05、0.81±0.06]和si-NC组[(4.81±1.06)%、0.51±0.06、0.79±0.07](P<0.05)。见图3(2250页)。
2.5 干扰KIF14增加细胞对顺铂的敏感性
不同浓度顺铂作用于细胞后,细胞IC50值耐药组为13.71±0.75,si-NC组为13.14±0.24,si-KIF14组为7.32±0.31,si-KIF14组IC50值下降(P<0.001);si-KIF14组多药耐药基因MDR1、P-gp蛋白表达(0.30±0.04、0.22±0.03)低于耐药组(1.01±0.06、1.02±0.06)和si-NC组(1.02±0.06、1.01±0.06)(P<0.001)。见图4(2250页)。
3 讨论
子宫内膜癌是最常见的女性癌症之一[9]。放疗、化学疗法和激素疗法可以单独或联合用于晚期患者[10]。晚期或复发性子宫内膜癌患者预后较差,1年生存率仅10%~20%。化学疗法被认为是晚期或复发性宫颈癌标准治疗方法,顺铂可有效治疗该疾病,但可能会产生耐药性抑制了治疗功效[11]。因此,寻找预防和逆转子宫内膜癌顺铂耐药性的有效途径成为研究热点。
KIF14基因是位于1号染色体长臂上的驱动蛋白家族蛋白的成员,研究发现KIF14与癌症进展有关,且常在各种肿瘤中过表达[12]。Li等[13]发现,KIF14在髓母细胞瘤中过表达,而KIF14的下调抑制了肿瘤的增殖并诱导了细胞凋亡。本研究也发现,与子宫内膜癌细胞Ishikawa相比,KIF14在子宫内膜癌顺铂耐药细胞株Ishikawa/DDP中高表达。转染后,si-KIF14组细胞KIF14 mRNA表达下降,表明转染效果良好。另外KIF14与细胞的增殖、凋亡密切相关,Gerashchenko等[14]发现,KIF14水平在乳腺癌中升高且高表达与肿瘤分级和总生存期有关,敲低KIF14抑制了体外乳腺癌细胞的迁移和侵袭。Qiu等[15]发现,KIF14与上皮性卵巢癌患者预后不良有关。Xu等[16]发现,长链非编码RNA通过募集转录因子ETS1上调KIF14表达,促进神经胶质瘤的细胞侵袭和血管生成。在癌细胞中,KIF14可通过维持适当水平的细胞粘附和细胞膜迁移蛋白来调节转移行为。因此,KIF14可能是肿瘤潜在治疗靶标。本研究发现,与耐药组和NC组比,干扰KIF14后的Ishikawa/DDP细胞克隆形成数目和ki-67蛋白表达水平显著下降,细胞凋亡率以及Bax、cleaved-Caspase-3蛋白表达水平显著升高,IC50值显著下降,多药耐药基因MDR1、P-gp蛋白表达水平下降。提示干扰KIF14表达能够抑制子宫内膜癌顺铂耐药细胞Ishikawa/DDP增殖,促进凋亡,并增加其对顺铂敏感性。
综上所述,干扰KIF14表达能抑制子宫内膜癌顺铂耐药细胞增殖、促进凋亡并增加顺铂敏感性,提示干扰KIF14可能是治疗子宫内膜癌新靶点。然而关于干扰KIF14表达增加对顺铂敏感性作用机制尚需深入研究。

