聚集诱导发光材料在食品安全检测中的应用
吕妍婷, 王 琪 , 朱为宏
(华东理工大学 化学与分子工程学院, 上海功能材料化学重点实验室, 精细化工研究所, 上海 200237)
1 引 言
食品作为人类生存的第一必需品,与人们的健康息息相关。随着现代农业和食品工业的集约化发展,食品种类日益增多,而农药、食品添加剂等的广泛使用以及食品供应链中存在的潜在危害使得食品安全成为影响人类健康的全球性问题。近年来,全球食品安全事件频发,特别是食源性疾病发展成为世界范围内的主要公共卫生问题之一[1]。为了确保食品安全,目前世界各国政府制定了相关标准并要求食品相关行业严格执行[2-4]。因此,开发简便、准确、灵敏和高效的食品检测技术对控制食品质量和保障食品安全至关重要。
目前,食品污染物的检测方法主要包括化学检测法、生物检测法和多种技术联用检测法[5-6]。化学检测法包括色谱[7]、质谱[8]、核磁[9]、光谱法[10-11]、电化学法[12]以及生物传感器[13-14]等。其中,气相色谱法(Gas chromatography,GC)和高效液相色谱法(High performance liquid chromatography,HPLC)技术较为完善,具有较高的分离效率和灵敏度,可检测的污染物类型较多。而生物检测法主要包括免疫技术[15]、基因检测技术[16]和聚合酶链式反应技术(Polymerase chain reaction,PCR)[17]等,均具有良好的检测准确性。然而,这两类检测方法都存在着样品预处理复杂、设备昂贵和对检测人员的专业素养要求高等问题。近年来,荧光分析法凭借其操作简便、灵敏度高、响应速度快和空间分辨率高等优点被广泛应用于食品安全检测中[18-22]。但传统的荧光染料大部分是具有大π共轭体系的疏水性材料,如三苯胺类、稠环类化合物等[23-24],具有明显的光致漂白现象并且在高浓度或聚集状态下易发生聚集荧光猝灭(Aggregation-caused quenching,ACQ)[25],从而导致灵敏度下降,限制了其对微量有害物的检测[26]。
唐本忠课题组在2001年提出聚集诱导发光(Aggregation-induced emission,AIE)的概念[27]。与ACQ现象截然相反,在稀溶液中AIE发光材料(Aggregation-induced emission luminogens, AIEgens)通过分子内运动过程增强非辐射衰减使发光减弱;而相反地,在聚集时通过限制分子内运动(Restriction of intramolecular motions, RIM)使荧光发射增强[28]。具有AIE特性的新型荧光材料具有亮度强、抗光漂白性好和稳定性高等优点。因此,独特的荧光“关-开”性质、可忽略的背景荧光和较大的斯托克斯位移等特点使基于AIEgens的检测技术成为生物检测、治疗和成像的高效方法之一[29-33]。近年来,基于AIEgens开发的生物传感器在食品安全和质量检测领域受到越来越多国内外学者的关注,并被广泛应用于食品中各种污染物的检测[34-36]以及食品品质的评估[37-42]。
本文围绕AIEgens荧光传感器展开,按照食品污染物的类别,重点介绍了其在农药、重金属、病原体、食品添加剂等领域的检测机制和应用进展,最后对AIEgens在保障食品安全和质量检测领域的未来发展进行了展望,希望能对研究本领域的学者提供借鉴。
2 AIEgens在食品安全检测中的应用
2.1 农药残留检测
目前,在农林业种植时常选用农药以防治疾病和虫害。有机磷农药(Organophosphorus pesticides,OPs)由于其高效率和低毒性而被广泛用于农业生产中,但OPs是一类神经毒素,可以在低浓度下降低人体乙酰胆碱酯酶(Acetylcholine esterase,AChE)的活性并引起大量乙酰胆碱积累,从而导致神经系统疾病,例如帕金森和阿尔茨海默症,甚至死亡[43-44]。不恰当地使用农药会导致蔬菜和水果等农副产品中的农药残留超标,并对人体健康产生危害。因此,快速灵敏地检测食品中的农药残留对于生命健康和环境保护具有重要意义。与常规分析方法(如荧光法[45]或高光谱成像[46])相比,基于AIEgens开发的生物探针能够更简单、灵敏和快速地检测OPs。
OPs可以被AChE上丝氨酸的羟基磷酸化形成稳定的共价键,阻碍AChE的氨基与底物胆碱结合,并降低AChE活性,因此可通过荧光检测AChE的酶活性,间接测定OPs残留。例如,基于AChE催化碘代硫代乙酰胆碱(Acetylthiocholine iodide,ATCh)的水解会影响溶液pH这一原理,Yue等[34]合成了对pH敏感响应的带醛基的四苯乙烯(Tetraphenylethylene,TPE)衍生物(TPE-1)(图1(a))。由于OPs不可逆抑制AChE活性,使ATCh无法水解为乙酸,削弱了TPE-1的质子化效应,进而使TPE-1的荧光信号产生变化,并且与OPs浓度呈线性关系。该方法已成功用于高选择性检测OPs。然而,大多数用于传感的AIE纳米颗粒在生物溶液中不稳定,对实际应用有害[47]。为提高稳定性和生物相容性,Chen等[48]将两亲性聚合物分散在磷酸盐缓冲溶液中制备得到AIE纳米粒(PTDNPs)(图1(b))。金纳米颗粒(AuNPs)与PTDNPs结合并通过荧光能量共振转移(Fluorescence resonance energy transfer,FRET)作用猝灭荧光,而ATCh将竞争性结合PTDNPs并阻断FRET点亮荧光,使PTDNPs成功地高灵敏定量检测OPs,并具有较宽的线性范围。此外,Wu等[49]设计了一种基于1,2-双[4-(3-磺酰基丙氧基)苯基]-1,2-二苯乙烯(BSPOTPE)的夹心纳米复合AIE荧光传感器(图1(c))。该探针对对氧磷检测具有良好的线性关系,还可用于制备便捷的荧光检测试纸实现有机磷农药对氧磷的简便直观半定量分析。
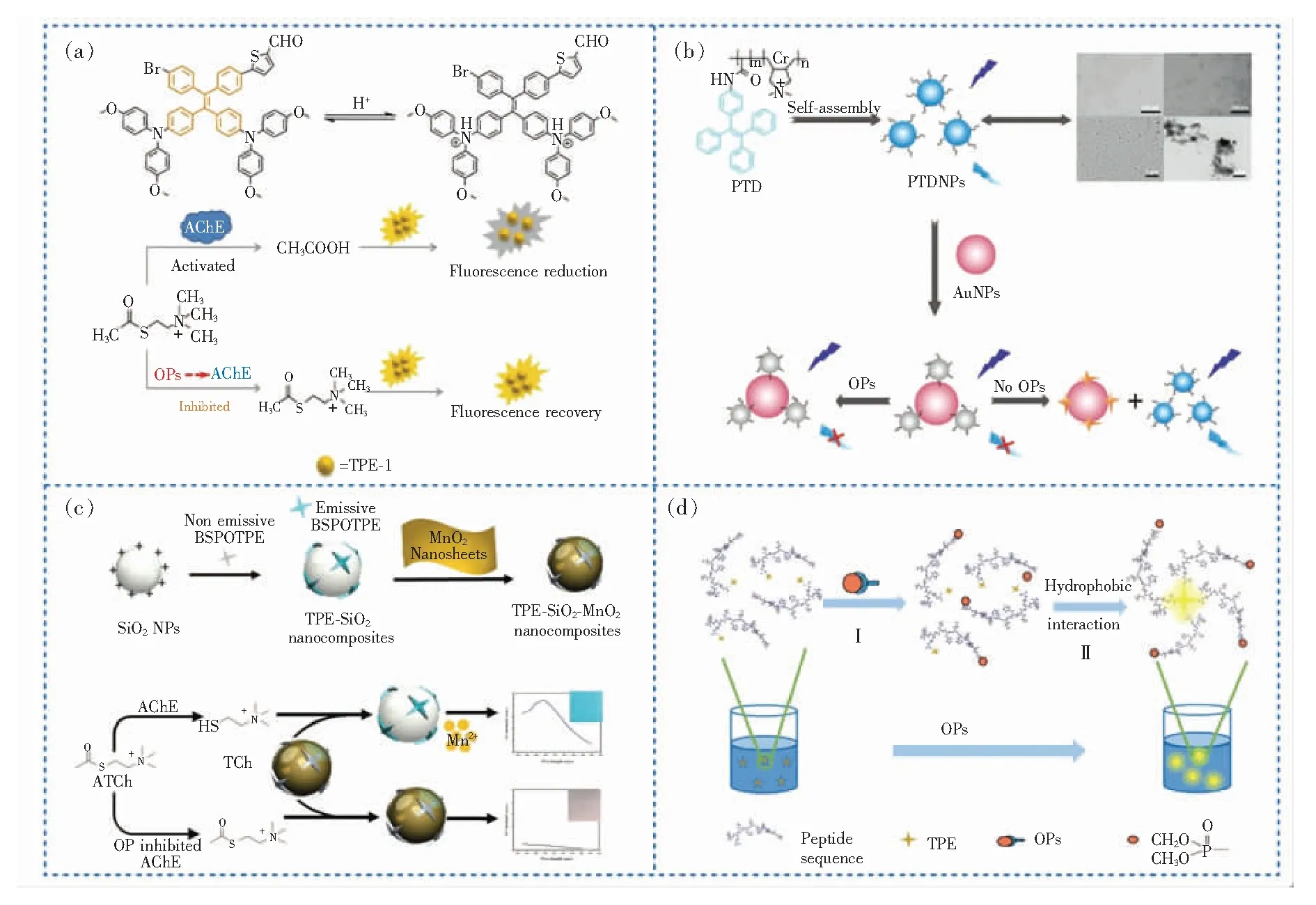
图1 AIE探针的化学结构及对农药残留物的检测。(a)TPE-1的pH传感机制及OPs检测机理[34];(b)高度敏感检测AChE和OP的PTDNPs-AuNPs生物传感器作用示意图[48];(c)BSPOTPE-SiO2-MnO2制备过程和传感器对OPs响应示意图[49];(d)TPE-Peptide与OPs作用示意图[50]。
除了基于酶抑制原理开发的AIE探针,基于肽开发的生物探针对农药残留的检测也具有较好的效果。Wang等[50]将TPE分子与肽序列LHLHLRL连接合成AIE荧光探针TPE-Peptide用于测定OPs(图1(d))。探针中的丝氨酸与OPs通过共价键反应形成的复合物可以增强探针疏水性,使探针更容易聚集到肽原纤维中加速肽聚集从而诱导增强探针荧光发射。该探针显示出高度敏感的荧光响应,可以在15 min内完成农药的快速检测。但目前该方法只能用于检测OPs的总量,不能区分特定类型的农药。
目前,基于AIE方法检测农药残留已有许多研究成果,但由于食品的成分复杂且农药混合使用种类较多,检测多种或多类别农药具有一定的局限性。因此,开发具有强抗干扰能力和高选择性的可视化快速现场检测方法仍是目前研究的重点方向。
2.2 兽药残留检测
在畜牧养殖业中,兽药常被用于防治疾病、抗寄生虫和促进生长,然而由于其不能被畜禽完全代谢,常会在动物体内残留并积累,最终通过食物链威胁人类健康,如人体摄入过量兽药残留的畜禽肉类会发生过敏性反应、中毒反应等[51]。因此,检测和评估动物源性食品(如肉类、牛奶和鸡蛋)中的兽药残留水平至关重要。
抗生素类(包括四环素类、青霉素类、氯霉素(Chloramphenicol,CAP))药物常被用于治疗畜禽的细菌感染类疾病。其中,CAP具有较强的毒副作用,不仅会影响畜禽的造血系统,而且畜禽体内残留的CAP还可能抑制人体骨髓造血机能,从而引起再生障碍性贫血和溶血性贫血等疾病。为此,Zhang等[52]成功开发了一种高灵敏检测CAP的AIE荧光探针,该探针以适配体(C-Apt)作为CAP的识别基团,短烷基链9,10-二氰基蒽衍生物DSAC2N作为AIE荧光基团,低氧化度的氧化石墨烯(Graphene oxide,GO)为荧光猝灭剂(图2(a))。连接有DSAC2N的C-Apt通过π-π堆积作用吸附在GO上并被GO猝灭荧光,当体系中存在CAP时,DSAC2N-C-Apt将优先与CAP结合形成复合物(C-Apt-CAP)并从GO表面脱附,DSAC2N荧光恢复,通过荧光信号变化检测CAP的含量。该方法检出限达0.36 ng·mL-1,已被成功应用于牛奶中CAP含量的检测。
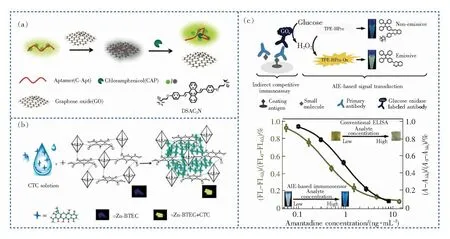
图2 AIE探针的化学结构及对兽药残留物的检测。(a)DSAC2N的化学结构及CAP检测机理图[52];(b)金属-有机骨架Zn-BTEC作为AIE荧光探针检测CTC过程示意图[53];(c)用于间接检测AMD的AIE/ELISA竞争性免疫传感器示意图和浓度响应荧光曲线[55]。
金霉素(chlortetracycline,CTC)是四环素类广谱抗生素中的一种,具有AIE荧光特性。Yu等[53]发现当CTC分子扩散到均苯四酸锌的锌基金属有机框架(Zn-BTEC)中时,刚性金属有机框架的多孔结构促使CTC分子发生组装或聚集,由RIM机理导致CTC的荧光大大增强。该方法成功地实现了鱼类和尿液等样品中CTC的高灵敏度和高选择性检测,并且能有效地与其他四环素类抗生素区分(图2(b))。
金刚烷胺(Amantadine,AMD)是国际医学界公认的对流感病毒具有抑制作用的抗病毒药物[54]。酶联免疫吸附测定(Enzyme-linked immunosorbent assay,ELISA)是一种广泛用于检测AMD的简单快速方法,但灵敏度中等,不适合低浓度检测。为提高检测的灵敏度,Yu等[55]结合AIE和ELISA方法开发了一种新型免疫荧光探针(图2(c))。在该方法中,葡萄糖氧化酶(glucose oxidase,GOx)将触发GOx/葡萄糖介导H2O2产生的生物学过程,进而使TPE-HPro氧化并点亮荧光。与ELISA结合使用,可以实现对鸡肌肉样品中AMD浓度的定量测定,该方法的灵敏度比传统免疫测定法提高了2.5倍。
荧光检测方法相较于传统的仪器分析和免疫分析法具有更高的灵敏度和更强的特异性。然而,目前基于AIE性质开发的兽药荧光检测试剂仍然处于发展阶段,这为科研工作者开发探索新的AIE型兽药残留检测试剂提供了极大的发展空间。
2.3 重金属检测
汞(Mercury,Hg)、砷(Arsenic,As)、镉(Cadmium,Cd)、铅(Lead,Pb)等重金属普遍具有较大的毒性,会导致酶和蛋白质失活,从而损伤人体器官、引起慢性中毒甚至死亡[56]。食品中的重金属污染主要来源于非法食品添加剂的使用、包装品的铅污染以及工厂“三废”污染食品源三种途径[57]。因此,监测水、食品和环境中的重金属含量是一项至关重要的任务。目前,多种荧光探针已被成功应用于检测环境中的重金属含量。
具有硫代或硫酮结构的反应型荧光探针对Hg2+具有高的检测灵敏度和优良的特异性。Ma等[58]合成了一种基于Pyrene-1-CHO和乙二硫醇的反应型AIE荧光探针Pyren-DT(图3(a))。该探针与Hg2+反应生成Pyrene-1-CHO,荧光增强,实现了对Hg2+的半定量检测。Pyren-DT对Hg2+具有极好的选择性和灵敏度,在0~6.5 μmol·L-1之间具有较好的线性关系,检出限达到2.88×10-8mol·L-1。与自来水样品相比,该探针对河水样品中Hg2+的检测具有更好的荧光特性,适用于现场检测。进一步地,为了开发用于检测活细胞和生物体中Hg2+的荧光探针,Gao等[59]基于Hg2+诱导的极性反转反应(Polar inversion,Umpolung)和AIE效应开发了一种水溶性荧光探针MPIPBS(图3(b))。在Hg2+存在时,MPIPBS发生Umpolung反应使硫代乙缩醛转化为醛,并释放MPIB和游离的醛,探针的水溶性和分子内电荷转移(Intramolecular charge transfer,ICT)效率变化从而点亮荧光,检出限达1.45 nmol/L。MPIPBS已被用于开发即时检测Hg2+的便携试纸,并且可用于水样、尿液样品、活细胞和斑马鱼中Hg2+的定量检测。此外,Huang等[60]根据磷假单胞菌生物发光的关闭和AIE活性探针2-AFN-I的荧光开启,开发了一种双重检测生物积累Hg2+的策略(图3(c))。其具体机理为:基于群体感应,高浓度的磷假单胞菌会产生强烈的生物发光,而当Hg2+在细菌内部积累后会破坏群体感应导致生物发光猝灭;此时2-AFN-I可进入受损的细菌并与Hg2+形成聚集体点亮荧光,从而检测生物积累的Hg2+。

图3 AIE探针的化学结构及对重金属离子的检测。(a)Pyren-DT的化学结构及其与Hg2+作用机理图[58];(b)探针MPIPBS的化学结构和设计策略[59];(c)通过破坏群体感应猝灭生物发光和2-AFN-I的AIE效应实现Hg2+的双重检测化学结构及检测caspase-3的荧光变化示意图[60];(d)Fe-GQD的结构及其制备过程[61];(e)TPE-triazole-CD的化学结构及与Cd2+作用机理图[62]。
在其他重金属离子的检测中,Pathon等[61]开发了一种基于Fe3O4氧化石墨烯量子点(Fe-GQD)的荧光传感器。在As3+存在时,Fe-GQD和As3+通过多种分子间相互作用形成聚集态,分子内运动受限从而荧光增强,可用于检测水中的As3+(图3(d))。Fe-GQD对As3+表现出良好的选择性,检出限达5.1×10-9,远低于世界卫生组织饮用水中As3+的容许限度。Zhang等[62]合成了一种基于环糊精(Cyclodextrin,CD)和TPE的AIE荧光响应型传感器TPE-triazole-CD(图3(e))。三唑桥和环糊精与Cd2+配位形成复合物,由于RIM限制了TPE单元的非辐射衰变,从而实现开启荧光,可检测Cd2+。该探针对Cd2+具有较高的选择性,检出限达0.01 μmol/L。这项工作提供了一种基于AIE效应在中性环境中检测Cd2+的简单方法。
目前,检测重金属离子的有机荧光探针多数特异性不高、易受环境干扰,或结构复杂、合成困难、难以广泛使用。而基于AIEgens发展的荧光传感器由于其优异的光学性质,能够满足定量分析的需要,有望应用于食品中重金属离子的快速检测。其中设计合成简单、灵敏度高、水溶性好的新型AIE荧光探针用于重金属离子的快速检测是未来发展的重点。
2.4 病原菌检测
食源性病原体是影响食品安全的主要威胁之一,食品中存在的任何致病菌都是严重的公共健康隐患。食源性病原体通过直接或间接污染食物和水源,最终可能导致人类感染肠道疾病、食物中毒甚至引发传染病的流行。尽管目前食品包装技术较为发达可以有效延长食物的储存时间,但在存储和运输过程中,食品不可避免地会接触到食源性病原体,例如霉菌[63]、大肠杆菌[64-65]和李斯特菌[66]等。此外,病原体会释放毒素并进一步威胁人体健康。因此,病原体的快速识别和检测非常重要。
食源性病原体主要包括真菌、革兰氏阳性菌和革兰氏阴性菌三类。基于荧光法不需要复杂的仪器且更适合应用于各种实际检测情况,是检测病原菌较为直接方便的方法。因此,目前已经开发了许多基于AIEgens的荧光传感器。由于细菌表面带有负电荷,一般设计带有正电荷的AIE荧光探针来实现细菌检测,AIE探针通过静电相互作用吸附在细菌表面,积累后分子运动受限从而实现AIE荧光响应。Dong等[67]通过在本身具有AIE特性的带正电荷的壳寡糖(Chitosan oligosaccharide,COS)上接枝肽聚物来模拟细菌细胞壁的肽聚糖结构,制备了阳离子抗菌聚合物肽多糖探针(COS-AMP)(图4(a))。该探针吸附于细菌表面后,激发依赖性荧光和其自身AIE效应,可应用于细菌的多色成像和定量检测。此外,Meng等[68]报告了一种多功能正电荷探针锌(Ⅱ)-二甲基吡啶胺(AIE-ZnDPA),用于细菌的选择性成像和成像指导的光动力杀灭(图4(b))。该探针通过与细菌之间的静电相互作用,在细菌膜上积累,并通过限制N—N键的分子内旋转和在水杨酸哒嗪部分形成分子内氢键来激活AIE效应和激发态分子内质子转移(Excited state intramolecular proton transfer,ESIPT),从而实现成像和杀灭。在哺乳动物细胞中,AIE-ZnDPA可以选择性地靶向细菌并成像,但该探针无法区分革兰氏阳性菌和革兰氏阴性菌。
事实上,通过非特异性静电作用或疏水相互作用检测病原菌的AIEgens分子只能用于细菌成像,无法实现对目标细菌种类的绝对区分,因而其不适用于准确靶向特定的目标细菌。因此,引入特异性识别配体是有效提高AIE传感器成像选择性的方法之一。万古霉素(Vancomycin,Van)对革兰氏阳性菌细胞壁上的肽聚糖序列N-acyl-D-Ala-D-Ala具有特异性的结合亲和力,可广泛用于杀灭革兰氏阳性菌。由此,Guang等[69]将AIEgens与2个Van单元共轭合成了具有红色荧光的AIE点亮型探针AIE-2Van,该探针成功用于选择性识别、视觉检测和图像引导光动力杀死革兰氏阳性菌,甚至包括耐万古霉素肠球菌(图4(c))。此外,He等[70]提出一种引入噬菌体指导AIEgen实现“雷达”感应选择性识别目标细菌的策略,将AIEgens与噬菌体结合以形成一类新的抗菌生物共轭物(TVP-PAP)(图4(d))。该探针中噬菌体的靶向作用能够使AIEgens特异性识别具有噬菌体自身保留感染活性的宿主细菌,通过进一步的噬菌体感染以及AIE荧光发射对目标细菌进行选择性成像和光动力杀灭。Wei等[71]则基于具有ESIPT和AIE效应的固态荧光团(BTBP)和葡萄糖醛酸(Glucuronide,Gluc),开发了一种简单的OFF-ON荧光底物BTBP-Gluc,用于活大肠杆菌的细胞成像并检测其内源性葡萄糖醛酸糖苷酶(Glucuronidase,GUS)的活性(图4(e))。由于GUS可区分缺乏GUS活性的大肠杆菌O157∶H7与其他大肠杆菌[72-74],因此,基于BTBP-Gluc开发的C-F大肠杆菌琼脂可用于视觉检测及分离牛奶中的O157∶H7和其他大肠杆菌。
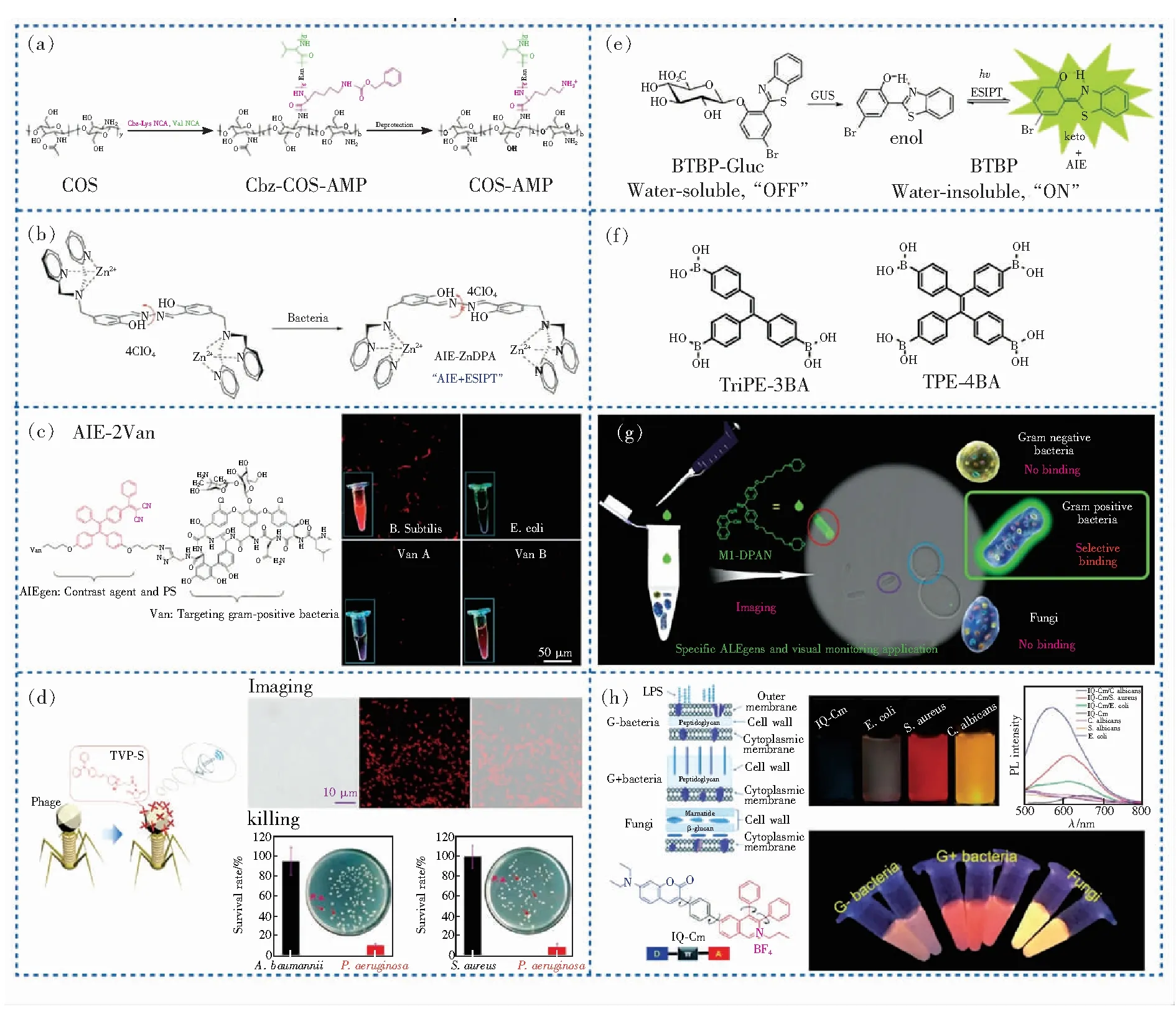
图4 AIE探针的化学结构及对病原体的检测。(a)COS-AMP的化学结构及其合成路线[67];(b)AIE-ZnDPA的化学结构及与细菌作用示意图[68];(c)AIE-2Van的化学结构式[69];(d)TVP-S的化学结构式及其对特定细菌选择性成像、跟踪、杀灭示意图[70];(e)BTBP-Gluc的化学结构式和荧光响应示意图[71];(f)TriPE-3BA和TPE-4BA的化学结构式[75];(g)M1-DPAN的化学结构式和检测革兰氏阳性菌的荧光变化示意图[79];(h)IQ-Cm的结构式及与病原体作用机理示意图[36]。
此外,基于静电吸附的荧光探针不能区分活细菌和死细菌,为了检测活细菌必须开发基于特定识别机制的新方法。Kong等[75]开发了一类通过与细菌结合旋转受限而发出荧光的新型生物传感器,可应用于即时检测区分活细菌和死细菌(图4(f))。该类AIEgens以TPE为核心连接不同个数的硼酸基团,其可通过与细菌表面多糖上的顺式二醇络合而低聚,从而AIE激活。其中,采用TriPE-3BA/TPE-4BA和商用细胞核探针碘化丙啶(Propidium iodide,PI)处理活细菌时均发出蓝色荧光,而死细菌会分别发出蓝色和红色荧光,因此可以通过比较荧光差异来区分活细菌和死细菌。然而,快速准确地鉴定和检测细菌种类仍然充满挑战。从结构和成分来看,革兰氏阳性菌和真菌仅具有被疏松多孔细胞壁覆盖的细胞膜,而革兰氏阴性菌具有附加的外膜,该膜具有屏障功能使探针难以进入细胞[76-77]。与细菌不同,真菌是一类具有多个细胞器的真核生物[78]。因此,病原体表面结构和化学成分的差异使荧光探针可以不同程度地穿透其细胞膜,并定位于不同的微环境中,从而实现区分。Hu等[79]开发了一种含有吗啉单元的荧光探针M1-DPAN,该探针以优异的选择性成功将革兰氏阳性菌与其他细菌和真菌区分开(图4(g))。该区分机制为M1-DPAN中的碱性吗啉部分可以通过强疏水相互作用和酸碱作用紧密地插入革兰氏阳性菌的肽聚糖层,由于AIE效应荧光增强,从而实现对革兰氏阳性菌的选择性成像;相反,DPAN部分难与真菌外层、革兰氏阴性菌的磷脂层稳定结合,因此不发光。据报道,具有扭曲D-π-A结构的AIEgens可以通过AIE特性有效地抑制分子内扭转电荷转移(Twisted intramolecular charge transfer,TICT)状态的非辐射弛豫,并实现对微环境极性差异的灵敏荧光可视化响应[80]。Zhou等[36]则开发了同时具有TICT和AIE特性的荧光探针IQ-Cm,可对病原体的不同微环境敏感响应(图4(h))。IQ-Cm对3种病原体具有不同亲和力,通过选择性相互作用定位于不同位置,从而使其在3种病原体中显示出视觉上可辨别的发光颜色,即大肠杆菌为绿色和橙色,金黄色葡萄球菌为橙色,白色念珠菌为黄色。需指出的是,用IQ-CM标记真菌促进了霉菌的检测应用,其肉眼检测极限约为106CFU·mL-1,可以很容易地从视觉上确定在食物上生长的霉菌数量。
AIEgens在病原体成像检测中具有独特优势。在已有报道中,科研工作者多通过引入不同靶向基团选择性识别特定病原体,从而用于病原体的快速成像和视觉检测。由于革兰氏阴性菌的外膜包裹阻碍了AIEgens的穿膜,因此开发选择性成像革兰氏阴性菌的AIE传感器是病原体成像的研究突破点。
2.5 食品添加剂检测
食品添加剂是少量添加于食品的非营养物质,可用于改善食品的外观、风味、组织结构和贮存性质。但食品添加剂滥用会带来健康风险,近年来滥用食品添加剂引起的食品安全事件也屡屡发生。因此,食品添加剂的使用及其含量引起了人们对食品安全的关注。
三聚氰胺通常用于纺织工业和农药生产,但由于其氮含量高、价格低而被非法添加到牛奶和婴儿配方食品中,造成食品安全事故。摄入超过安全水平的三聚氰胺会导致肾衰竭,甚至死亡[81]。Niu等[35]开发了一种由带正电的AIE有机荧光纳米颗粒和带负电的Au纳米簇组成的双发射比例荧光探针OFNs@Au NCs,可用于目测及定量检测食品中的Hg2+和三聚氰胺(图5(a))。Hg2+与Au NCs具有高亲和力,两者结合后将猝灭探针的红色荧光,从而检测Hg2+浓度;而三聚氰胺存在时,通过与Hg2+更强的配位亲和力阻止Hg2+与Au NCs的结合,从而恢复红色荧光。由于AIE-OFN的绿色荧光强度稳定,可以通过明显的颜色变化视觉检测Hg2+和三聚氰胺。OFNs@Au NCs对Hg2+和三聚氰胺的检出限较低,分别为22.7 nmol·L-1和680 nmol·L-1,远低于碳量子点法检测三聚氰胺的最低限(2.2 mg·L-1)[82]。此外,该探针已成功应用于检测自来水和奶粉中的Hg2+和三聚氰胺。
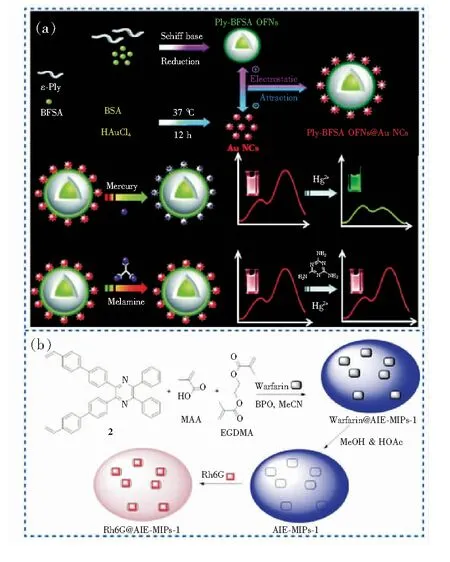
图5 AIE探针的化学结构及对食品添加剂的检测。(a)OFNs@Au NCs的制备过程及其与Hg2+、三聚氰胺的作用荧光变化示意图[35];(b)AIE-MIPs-1的制备过程示意图及其对Rh6G的检测原理[84]。
罗丹明(Rhodamine,Rh)具有潜在的致癌性,可导致人类和动物的生殖发育异常,目前已被禁止在食品行业使用[83]。但由于成本低,其仍被不法商家当作色素添加在食品中。为此,Li等[84]以四苯基吡嗪(TPP)作为AIE响应基团,开发了一种新型的基于分子印迹聚合物(Molecular imprinting polymers,MIPs)的比例型荧光传感器(AIE-MIPs-1),可用于定量检测木瓜干和饮料中的Rh6G(图5(b))。AIEgen本身在420 nm处显示蓝色荧光,吸附Rh6G后,420 nm处的荧光强度降低,而562 nm处的荧光强度增加,颜色从蓝色变为橙色,可用肉眼清楚观察。AIE-MIPs-1对Rh6G在0.0~10.0 μmol·L-1范围内具有良好的线性关系,检出限为0.26 μmol·L-1。同样地,Li等[85]还开发了对RhB具有高灵敏度和选择性的比例荧光传感器(TPE-A-MIPs),RhB的检出限为1.41 μmol·L-1。
2.6 食品品质评估
食品受到外界有害因素的污染后,其原有的色、香、味和营养成分均会发生变化,最终会导致食品质量降低甚至完全不能食用,即食品腐败变质[86-87]。鱼类和肉类等食品的腐败过程主要以蛋白质的分解为主,会产生多种有毒的生物胺,如腐胺、尸胺、酪胺和组胺等。其中,生物胺是常用的评价肉类新鲜度的指标之一[88-89]。Han等[90]通过将羧基连接在AIEgen核的不同位置上合成了一类具有AIE和ICT效应的位置异构体,其中基于(E)-3-((4-(二乙胺基)-2-羟基苯亚甲基)氨基)苯甲酸(m-DB)自组装的传感器对有机胺蒸汽压力具有线性关系,检出限低至2.02 Pa,可用于肉类腐败监测(图6(a))。其分子设计的策略是通过改变羧基的位置以调节偶极子间的方向,从而进一步控制自组装体系结构,使其形态实现从一维纳米线到二维微片甚至三维微立方体的转变。AIE异构体的苯甲酸部分对胺具有很强的亲和力,而胺与AIEgens间的不同相互作用会导致AIEgens荧光发生变化从而实现检测。同样地,Hou等[91]基于该原理开发的基于HMBA-4的胺传感器也可以用于快速检测变质的猪肉样品。此外,Han等[92]使用2,3,5,6-四氟苯硫酚(TFTP)作为还原剂和保护配体开发了一种能够快速、灵敏和高选择性检测组胺的强发光自组装铜纳米团簇(Cu NCs)。当存在组胺时,由于铜原子和组胺间的强相互作用和RIM机制,Cu NCs的荧光会被猝灭。Cu NCs在0.1~10 μmol·L-1的组胺浓度范围内具有良好线性关系,检出限为60 nmol·L-1,远低于美国食品药品安全局规定的最大残留限(450 μmol·L-1)。基于Cu NCs的发光测试条对组胺含量显示出明显的颜色梯度变化,可用于视觉检测鲤鱼、虾、红酒中的组胺含量。
另一方面,食品的粘度变化是反映流质食品变质的关键参数之一[93]。Xu等[38]开发了对粘度敏感的AIE荧光探针TPAEQ,可用于检测饮料中食品增稠剂含量以及饮料的变质情况(图6(b))。随着粘度的增加,TPAEQ中可旋转的三苯胺和甲基醚单元旋转受到抑制,从而导致强烈的荧光发射。并且TPAEQ的荧光强度与食物增稠剂质量浓度间存在线性关系。因此,TPAEQ可通过荧光粘度响应来检测评估液态饮料的变质情况和定量分析食品增稠剂的含量。

图6 AIE探针的化学结构及对食物品质的评估。(a)m-DB的化学结构式及其与有机胺的作用机理图[90];(b)TPAEQ的化学结构式及对粘度的荧光响应示意图[38];(c)QM-TPA的化学结构式[96];(d)CPA-TPA的化学结构式[97]。
食品的加工方法也同样会影响食品的营养成分。例如,油炸食品因其酥脆可口、香气扑鼻,深受人们喜爱,但长期食用油炸食品对身体健康极为不利,容易提高肥胖症、高血脂症和冠心病等的患病率。油炸是一个复杂的化学过程,会发生氧化、水解、聚合等反应,产生多种有害化合物,例如丙烯酰胺、三酰基甘油(Triacylglycerol,TAG)和总极性材料(Total polar materials,TPM)。其中,TPM包含了煎炸过程中产生的不饱和脂肪酸、甘油单酸酯、甘油二酸酯和许多氧化物(醛或酮)。特别地,随炸油循环使用次数增多,其中的有害物质会逐渐增加。因此,煎炸油的质量已成为消费者最重点关注的食品安全问题之一。为此,许多国家已经制定了限制煎炸油滥用的法规,TAG和TPM的含量是评估煎炸油安全性的重要指标[94],其中TPM的含量限制为24%~30%[95]。
由于煎炸油系统的粘度随TAG或TPM的增加而增大,因此对粘度具有超灵敏响应的AIE荧光探针是评估煎炸油品质的理想选择。Wu等[96]报告了一种由喹啉腈(Quinoline-malononitrile,QM)和三苯胺组成的AIE探针QM-TPA,可以通过粘度调节机制直接定量检测煎炸油中的TAG浓度(图6(c))。在煎炸过程中,随着TAG的产生煎炸油的粘度逐渐增大,限制AIEgen分子内运动从而实现荧光响应。在0,20,40,60,80,100次油炸条件下,测得TAG的浓度分别为3.5%、6.01%、7.59%、9.27%、11.75%和13.65%,与QM-TPA荧光强度呈线性相关。Cui等[97]基于对粘度高灵敏度的三苯胺衍生物(CPA-TPA),建立了一种有效地定量测定煎炸油中TPM含量的方法(图6(d))。当煎炸油的粘度增大时,荧光强度与TPM之间存在良好的线性关系,这表明CPA-TPA可以作为一种便携式工具通过粘度传感实现简单、快速监测煎炸油的TPM。与基于色谱的检测方法相比,该类方法解决了仪器体积大、价格昂贵、预处理复杂和过程耗时等问题,实现了食品品质的快速评估、实时感测和便携式操作(表1)。
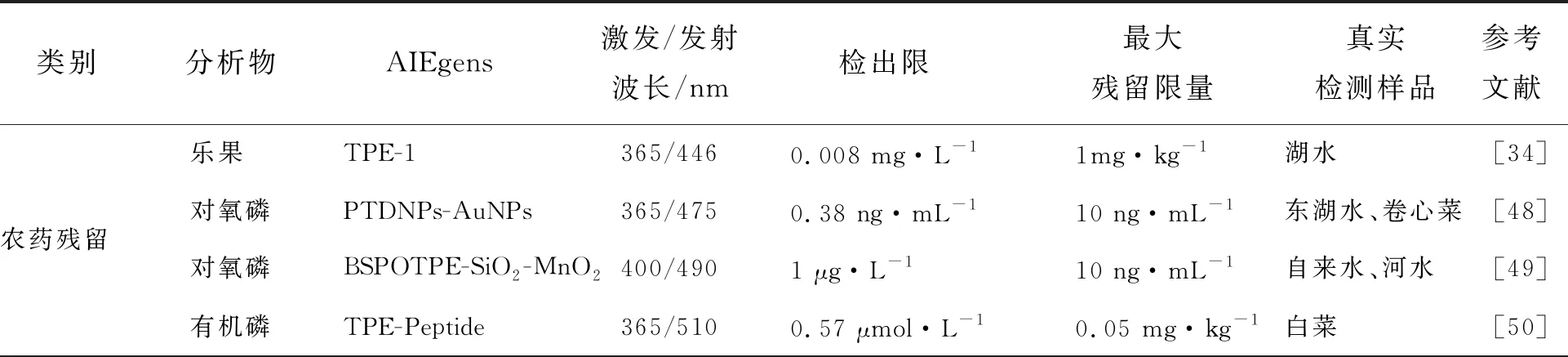
表1 AIE传感器在食品安全检测中的应用

表1(续)
3 总结与展望
AIEgens作为一种新型的荧光材料在食品安全检测领域已经取得了许多创新性成果。基于AIEgens开发的荧光传感器具有响应快速、选择性好、效率高等优势,实现了对农药、兽药、重金属、病原体和食品添加剂等的选择性识别和检测。但是,由于AIEgens单独使用检测时存在生物相容性差、检测种类少、自发荧光干扰等问题,通常将AIEgens进一步修饰以提高生物相容性和荧光量子效率,或与噬菌体、肽、适配体、酶等靶向识别单元结合以提高检测的灵敏度和准确性,甚至与其他检测技术(如PCR技术、传感器阵列等)联用以拓展AIE荧光传感器的应用范围。
尽管如此,设计更高效、更灵敏的AIE荧光传感器仍面临诸多挑战。例如,(1)RIM是聚集诱导发光的主要机制,但许多新型的AIEgens(如平面型AIEgens)[98]不能用RIM进行解释,因此需要对AIE机理进行更深入系统的研究;(2)制备AIE纳米颗粒是提高分子亲水性和生物相容性的有效方法,并且可以有效提高荧光量子效率,但目前尚未有研究分析纳米颗粒的修饰方法、尺寸和形状与荧光传感效率的关系,需要进一步优化;(3)食品组成非常复杂,包含蛋白质、糖、食品添加剂等多种物质,因此提高选择性是准确识别目标分析物的研究重点,需要将AIEgens与肽、适配体、分子印迹等结合以进一步提高靶向性;(4)由于AIEgens的信号采集主要依赖于一些大型仪器,开发便携式、可视化的AIE荧光传感器用于现场“免仪器”检测对拓展应用市场将具有良好的前景。
总而言之,AIEgens已成功应用于食品安全领域,但相关应用研究还处于发展阶段。虽然食品的多样性与复杂性对AIE荧光传感器的选择性和灵敏度要求很高,但是基于AIEgens的优异性能,我们相信其将会成为保障食品安全的一种有效工具。随着对AIEgens的创新设计和深入研究,其将在食品安全检测领域具有更为广泛的应用。

