逍遥散治疗盗汗的网络药理学作用机制探讨*
张 鹏,于靖泽,龙婷婷,李江洪,莫 易,刘 浪,李勇昊
(1 重庆科技学院化学化工学院,重庆 401331;2 工业发酵微生物重庆市重点实验室(重庆科技学院),重庆 401331)
盗汗,因仅表现为熟睡时汗液大量排出,故常常被人忽视。然而近年大量研究报道显示盗汗与各类病症都均有联系,作为常见并发症,部分糖尿病患者,会伴以盗汗,半夜出汗量大,汗液粘稠,醒后伴有强烈的口干舌燥感,四肢乏力,心情烦闷[1]。乙型肝炎部分患者伴有盗汗现象,加重患者身体疲乏感[2]。以上临床案例的举隅均显示关于盗汗治疗的机制研究应被重视,故本实验探究逍遥散治疗盗汗的分子作用机制在当下显得更为必要。
逍遥散在宋朝即有记载,疗效明确,临床应用十分广泛,可治疗的疾病达167种,涵盖妇科、精神科、内分泌科、儿科等学科[3]。盗汗乃阴虚的体现,而“汗乃心液”,若长期盗汗,则使心阴耗损十分严重[4],体质变虚弱,机体免疫力下降,长此以往,将对机体器官造成不可逆的影响。因此,对治疗盗汗作用机制的研究有十分重要的意义。
以往药物学发展中,总是依据“一个药物,一个靶点对应一种疾病”进行药物机制探索[5],而中医特点在于各种化合物和靶点的联合作用,故以往对中药作用机制的探索受限[6]。本研究采用网络药理学挖掘逍遥散活性化合物及作用靶基因从而建立成分-靶点网络,基于盗汗疾病靶点找到核心基因,构建PPI蛋白互作网络,并对核心基因进行GO富集和KEGG代谢通路分析,探究逍遥散治疗盗汗的分子作用机制,为后续研究提供科学依据。
1 材料与方法
1.1 有效成分的筛选
逍遥散共有白术、白芍、当归、甘草、茯苓和柴胡六味中药,在TCMSP[7](https://tcmspw.com/tcmsp.php)分别检索中药含有的活性化合物,并以生物口服利用度(Oral bioavailability,OB)≥30%,类药性(Drug likeness,DL)≥0.18以及细胞单层模型的吸收(Caco-2)≥-0.4为筛选条件,获取逍遥散有效成分。
1.2 有效成分靶点的预测及基因注释
结合TCMSP、Pub Chem(https://pubchem.ncbi.nlm.nih.gov)和Swiss Target Prediction (http://www.swisstargetprediction.ch)数据库得到成分相关靶基因,并对靶点注释为基因名。
1.3 疾病靶点的预测
利用Gene Cards数据库(https://www.genecards.org)检索关键词“Night sweat”收集盗汗相关基因,并以相关性得分(Relavance score)≥10为条件对盗汗相关基因进行筛选。
1.4 获取药物作用疾病核心靶基因
在Venny 2.1(https://bioinfogp.cnb.csic.es/tools/venny/index.html)和Draw Venny (http://bioinformatics.psb.ugent.be/webtools/Venn)中对盗汗相关基因和逍遥散靶点基因相互映射,得到盗汗相关靶点-逍遥散作用靶点韦恩图,从而得到逍遥散治疗盗汗的核心基因。
1.5 有效成分-靶点网络的构建及分析
将有效成分名称和化合物对应靶点汇总后整理,分别建立Network表格和Type表格,导入Cytoscape软件,构建逍遥散有效成分-靶点网络图,根据连线数目绘制柱状图,获取核心基因。
1.6 逍遥散与盗汗相关靶点蛋白相互作用PPI网络的构建
将“1.4”所得,核心靶基因导入STRING(https://string-db.org),选择人类(Homo sapiens) 为研究物种,获取蛋白相互作用网络。利用Cytoscape软件将网络可视化处理,导出核心基因子网络,获取核心基因关键作用靶点蛋白互作网络。
1.7 GO富集和KEGG通路分析
运用R语言中的RSQLite、BiocManager、colorspace、stringi、DOSE、clusterProfiler和pathview安装包对核心靶基因进行GO和KEGG通路分析,以pvalue<0.05为筛选条件,得到靶点蛋白主要涉及的生物学功能和主要作用通路,以圆圈图和柱状图的形式显示最后结果,根据关键基因在通路中的富集情况,以及通路的P值大小,获得逍遥散治疗盗汗的关键作用通路。
2 结 果
2.1 逍遥散有效成分的筛选
以OB≥30%、DL≥0.18和Caco-2≥-0.4为条件进行ADME筛选,共得获得137个有效化合物,其中柴胡16个、白芍9个、白术7个、当归2个、甘草88个以及茯苓15个;除去无人类靶基因的化合物及重复值,共106个逍遥散活性化合物纳入研究,主要有效成分,见表1。

表1 逍遥散有效成分信息
2.2 构建“逍遥散有效成分-靶点”网络并分析
结合TCMSP、Pub Chem以及Swiss Target Prediction数据库,预测逍遥散有效成分靶基因。利用Uniprot数据库进行基因名注释,得到逍遥散有效成分靶点1009个。利用Cytoscape软件,构建逍遥散有效成分-靶点网络,结果如图1A所示。
分析网络拓扑结构性质显示图中共包含节点1121个,边5077条。其中成份106个,靶蛋白4963个;靶点度值越高,与有效成分之间连线数目越多,则该基因是核心靶点的可能性越大对网络图中主要成分和基因进行可视化,结果分别如图1B和1C所示。由图1可知山萘(kaempferol)、谷甾醇(sitosterol)、丁子香萜(Mairin)和香树脂醇(α-Amyrin)有效化合物的Degree值最高,是逍遥散作为药物治疗疾病过程中的主要活性化合物。
2.3 盗汗疾病靶点及遥散治疗盗汗核心靶点的预测
在Gene Carts平台检索关键词“Night sweat”收集盗汗疾病相关靶点,并以相关性得分(Relavance score)>10为筛选条件,最终获得盗汗相关疾病靶基因183个。
利用Venny 2.1和Draw Venny软件将逍遥散有效成分预测靶点与盗汗疾病相关靶点相互映射,绘制出逍遥散作用靶点与盗汗疾病相关靶点韦恩图,如图2所示,交集得到59个逍遥散治疗盗汗的“关键靶点”,分别占逍遥散对应靶基因的5.9%和盗汗靶基因的32.2%。主要靶基因有IL-6、STAT3、PIK3CA、VEGFA、PTPN11等。

图2 逍遥散作用靶点与盗汗相关靶点的交集
2.4 构建蛋白质网络互作网络(PPI)
通过STRING平台分析59个逍遥散治疗盗汗核心靶基因蛋白互作网络,隐藏共表达连线(Co-expression)和单独的节点(Simplifications)得到绘制PPI网络。共包含54个节点,242条线。
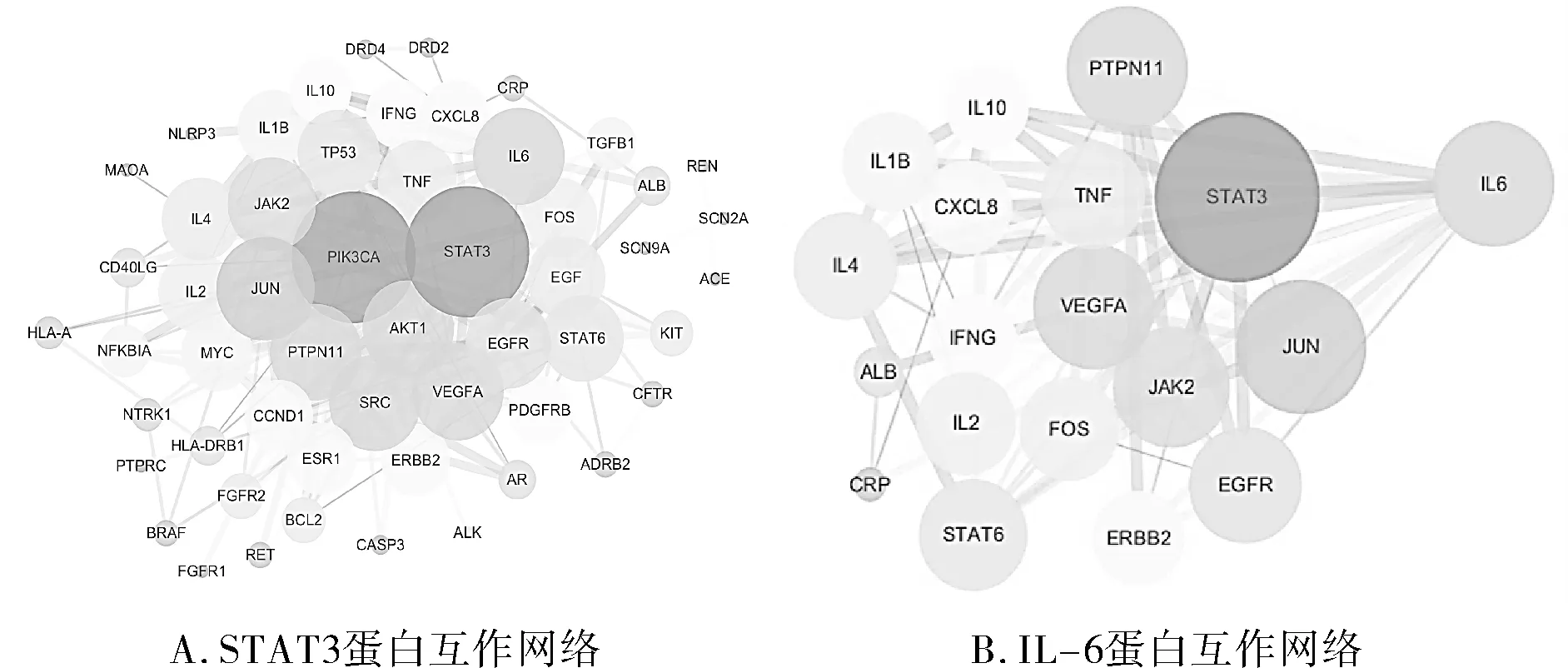
图3 逍遥散对盗汗靶点蛋白的相互作用网络(PPI)
图3A为STAT3蛋白互作网络,有29个节点和168条线且红色越深表示该蛋白重要性越大。STAT3、STAT6、JUN、EGFR、EGF和SRC在细胞中对信号传递、启动基因转录、细胞增殖、凋亡以及迁移有关键作用[8-9],分析可以对盗汗治疗起一定的药理作用。
IL-6蛋白在盗汗疾病相关靶点中相关性得分较高,在PPI网络中度值较大,故构建该蛋白互作网络,结果如图3C所示。IL-6、IL-2、IL-1B、IL-4和IL-10均是炎性细胞因子,可通过抑制该基因,从而抑制炎症反应;同时也是免疫细胞调节因子,有调节免疫的生物学功能[10]。
2.5 GO分析以及KEGG通路分析
利用Rstudio软件中的RSQLite、BiocManager、colorspace、stringi、enrichplot、ggplot2、DOSE、clusterProfiler和pathview安装包,以P<0.05为筛选条件,绘制GO功能富集圆圈图(图4)。逍遥散涉及的基因功能主要集中于5类,分别是激活蛋白激酶活性(activation of protein kinase activity)、肽基酪氨酸的改性(peptidyl-tyrosine modification)、肽基酪氨酸磷酸化(peptidyl-tyrosine phosphorylation)、MAP激酶活性的正调控(positive regulation of MAP kinase activity)以及丝氨酸/苏氨酸激酶活性的正调控(positive regulation of protein serine/threpnine kinase activity)。
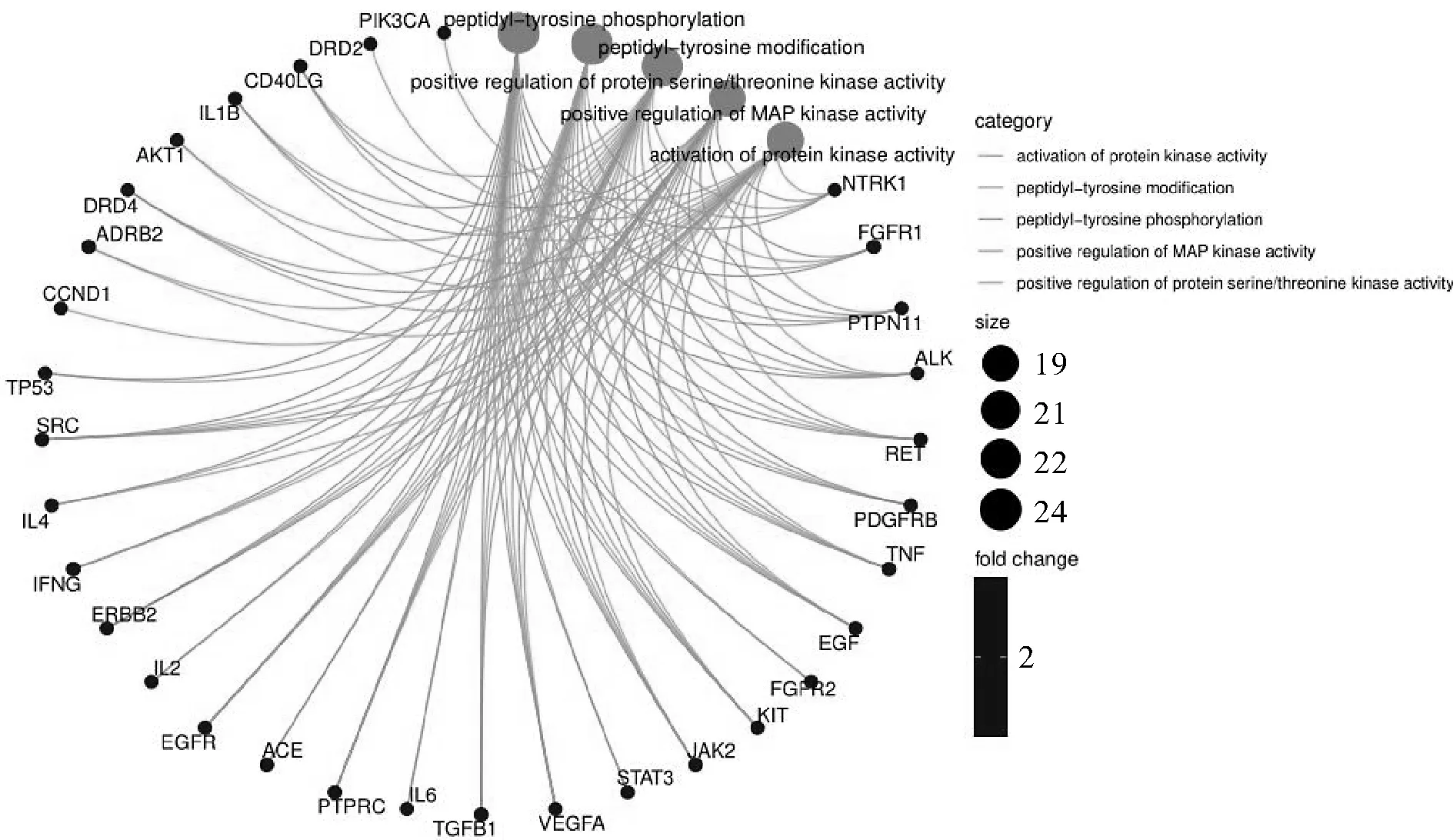
图4 GO功能富集圆圈图
KEGG通路富集分析筛选到20条主要信号通路,如图5所示。图5中矩形颜色越红,P值越小,显著性越大;矩形越长,在该条通路富集的基因数目越多。靶点主要富集在以下通路丝裂原活化蛋白激酶(MAPK signaling pathway)、PI3K-AKT(PI3K-Akt signaling pathway)、JAK-STAT (JAK-STAT signaling pathway)和EGFR酪氨酸激酶抑制剂耐药(EGFR tyrosine kinase inhibitor resistance)。可知逍遥散可以通过以上多条通路作用于盗汗,直观反映出了逍遥散治疗盗汗的多通路特征。
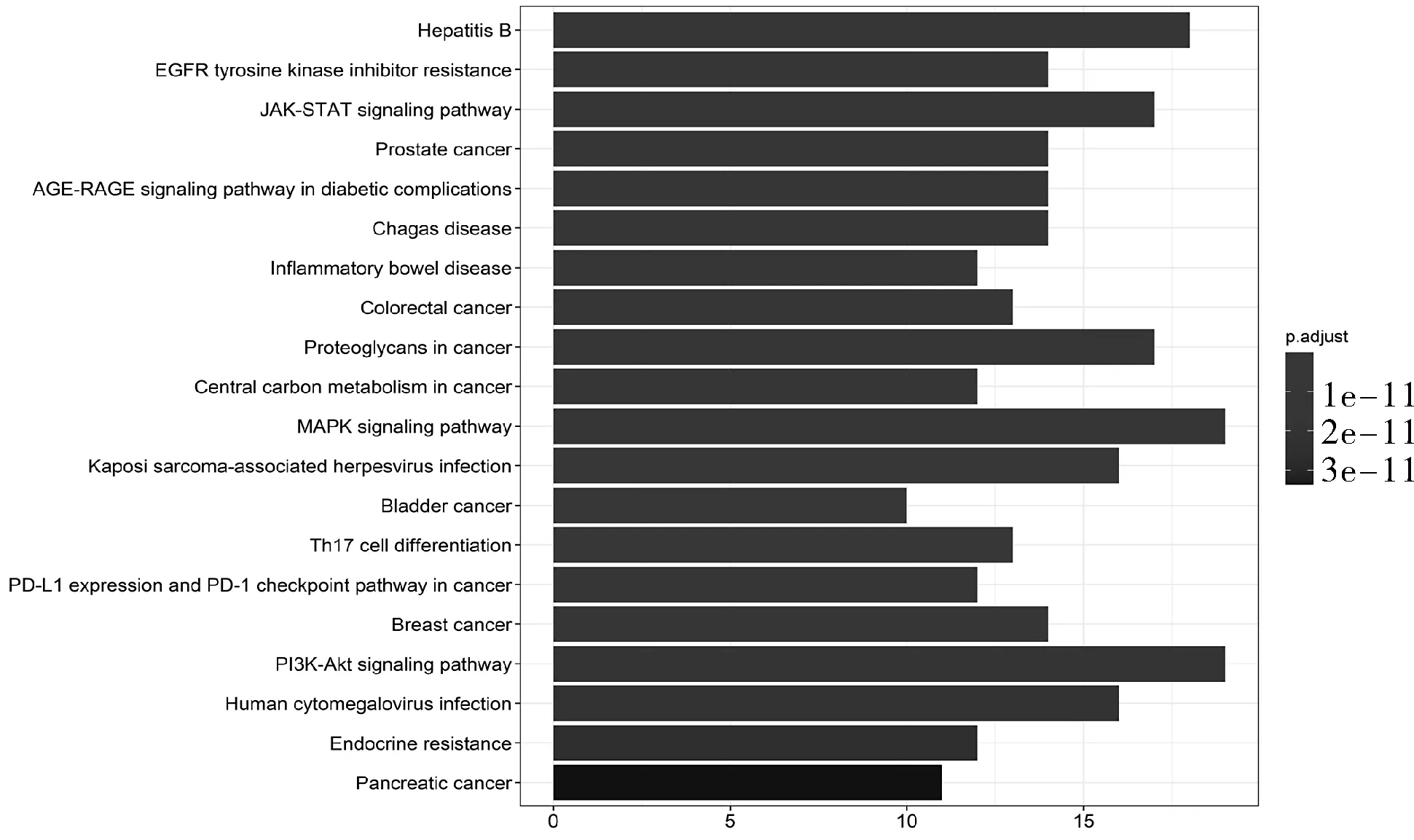
图5 KEGG通路富集分析柱状图
KEGG分析中EGFR信号通路为逍遥散影响的主要通路,如图5所示。逍遥散有效成分作用该通路多达18个基因。分析逍遥散主要通过作用该信号通路起到治疗盗汗的目的作用,同时相关研究显示若ECFR通路持续活化,将对肿瘤细胞连续传递增殖、抗凋亡的信号,在癌症和肿瘤的表达中都具有重要意义[11]。
3 结 论
构建“逍遥散-核心化合物-靶点基因”网络,分析了逍遥散治疗盗汗的主要有效成分。并挖掘逍遥散对应核心靶点STAT3、PIK3CA、JUN、VEGFA、SRC、PTPN11、IL-6和AKT1,不同有效成分可作用于相似靶点,从而发挥共性效应[12]。
根据韦恩图中交集部分基因,找到逍遥散治疗盗汗的关键靶点,筛选出盗汗疾病相关性得分较高的基因。其中STAT3在细胞中对信号传递和启动基因转录有关键作用,近年来大量研究表明,当STAT3信号显示异常时,细胞不断增殖,诱发炎症,破坏机体免疫系统[13];IL-6作为血清炎症因子,免疫细胞调节因子,它可以通过调节细胞的免疫功能从而控制炎症的发展状况和机体的防御功能,如若机体炎症不得以控制,将引起不同程度的组织损伤[14]。据此探究出逍遥散治疗盗汗疾病在于提升机体细胞的免疫功能以及控制机体炎症,若不及时治疗将对人体带来不可逆的伤害。
在KEGG通路分析中表明逍遥散主要通过五条通路对盗汗起治疗作用,因EGFR tyrosine kinase inhibitor resistance通路中富集关键基因数目最多,且P值在前五条通路中显示最低,故筛选出EGFR tyrosine kinase inhibitor resistance作为关键通路。EGFR作为受体型酪氨酸激酶之一,通过刺激细胞分裂,完成组织修复。EGFR过度活化,将加剧炎症反应,对中枢神经系统产生不可逆的损伤。研究表明药物可以通过抑制EGFR以达到提升患者免疫功能,延长存活时间的目的[15]。由此可知EGFR信号通路在细胞免疫以及炎症反应中均有重要作用。可判定STAT3,VEGFA,IL-6,PIK3CA,SRC,AKT1等关键基因,通过 EGFR信号通路,对细胞炎症和机体免疫系统调节等生物学功能做出调控,从而达到治疗盗汗的目的。
本次研究基于网络药理学筛选得到逍遥散治疗盗汗的潜在靶基因,以上靶基因可能通过EGFR信号通路调控细胞免疫以及炎症反应而达到治愈盗汗的效果。本次实验对分子作用机制做出了初步探索,为进一步深入研究其机制提供了一定科学依据。

