AEG-1表达与子宫内膜癌侵袭、转移的相关性研究
庞 岚,曾 倩,武学锋,申 艳,李军澎
(1. 邯郸市妇幼保健院,河北 邯郸 056000;2. 邯郸市中心血站,河北 邯郸 056000;3. 涉县妇幼保健院,河北 涉县 056400)
子宫内膜癌是发达国家恶性妇科肿瘤死亡的主要原因之一。 在中国,子宫内膜癌的发生在年轻人中更为常见,并表现出发病率和病死率逐步增高的趋势[1]。子宫内膜癌的发生、发展和转移是一个极其复杂的过程,在子宫内膜单纯性增生逐渐进展为非典型增生期间以及早期子宫内膜癌向晚期癌进展过程中多种分子均发生了变化[2]。因此,鉴定与子宫内膜癌发生、发展、侵袭和转移密切相关的高度敏感和特异性分子标志物可以对子宫内膜癌患者的正确诊断和治疗提供巨大帮助。转移黏附蛋白(AEG-1)为HIV-1感染后人胎儿星形胶质细胞诱导的新型晚期反应基因。Song等[3]发现AEG-1的过表达与人非小细胞肺癌的肿瘤侵袭性和预后不良密切相关,且AEG-1可促进肿瘤生长、自噬和血管生成,并在很多癌症转移、恢复和化学抗性中发挥重要作用[4-6],但有关其参与子宫内膜癌发病过程的机制研究仍然有限,尤其是其表达量变化与子宫内膜癌侵袭、转移相关性报道少见。因此,本研究观察了AEG-1在子宫内膜癌组织中的表达及其表达量与癌细胞侵袭和转移的关系,旨在为进一步明确子宫内膜癌病理机制提供实验依据。
1 资料和方法
1.1一般资料 收集2016年7月—2018年7月在邯郸市妇幼保健院接受手术的48例子宫内膜癌患者组织标本、28例子宫内膜单纯增生组织标本和30例正常子宫内膜组织标本。子宫内膜癌患者年龄32~63岁;手术后病理确认为子宫内膜腺癌;FIGO病理分期:Ⅰ+Ⅱ期39例,Ⅲ期9例;组织学分级:G1+G2级39例,G3级9例;淋巴转移8例,无转移40例。子宫内膜单纯增生组织标本和正常子宫内膜组织标本均来自门诊刮宫者。本研究经邯郸市妇幼保健院伦理委员会审核批准。
1.2研究方法 测定各组织中AEG-1和基质金属蛋白酶-9(MMP-9)蛋白表达量,分析二者表达量与子宫内膜癌患者病理特征的关系;检测各组织中β-连环蛋白(β-catenin)、CUL4A的mRNA表达量,Pearson分析AEG-1与MMP-9蛋白、β-catenin mRNA、CUL4A mRNA表达的相关性。
1.3检测指标与方法
1.3.1AEG-1和MMP-9蛋白表达Western印迹法检测 样本裂解后,4 ℃下13 000 r/min离心15 min取上清液,应用BCA蛋白质浓度测量试剂盒(联科生物技术有限公司)测量蛋白质浓度,加入5×SDS样品缓冲液,随后加入终浓度为5%的β-巯基乙醇(南京森北佳生物科技有限公司)使蛋白变性。根据蛋白质的分子量,制备12%分离凝胶和5%间隔凝胶(所有试剂购自德国Amresco公司)。使用PVDF膜和切成相同尺寸的6片滤纸进行膜转移。甲醇浸泡PVDF膜后,加入缓冲溶液并将膜置于具有冰块的盆中300 mAmp电泳1 h,将蛋白质转移到膜上。转膜后应用TBS-T配置的10%牛奶进行封闭,随后孵育AEG-1和MMP-9一抗4 ℃过夜。次日洗涤后孵育二抗室温1 h后ECL显影检测。 采用Quantity One软件分析计算AEG-1、MMP-9表达量。
1.3.2β-catenin和CUL4A mRNA RT-PCR检测 按照Trizolextraction 试剂盒说明进行总RNA提取。组织经匀浆、离心、与异丙醇混合、冰乙醇洗涤后,分光光度法检测RNA纯度和浓度,逆转录合成cDNA。将1 μg RNA与水和dT引物混合,在30 ℃下加热10 min,在DNTPs逆转录酶和含有MgCl2(5 mmol/L)缓冲液下42 ℃温育30 min。99 ℃加热5 min终止反应,储存备用。将总共0.5 μL cDNA与水、引物和聚合酶混合进行PCR反应,每次反应的总体积为20 μL。引物序列和扩增条件:β-catenin上游为5’-TGGCAGCAACAGTCTTACC-3’,下游为5’-TCCACATCCTCTTCCTCAG-3’,扩增长度112 bp,退火温度72 ℃;CUL4A上游为5’-CAGCGGCTCTGATTACAGACCTCG-3’,下游为5’-GTCTTCACAGGCCTGACGCAGT-3’,扩增长度121 bp,退火温度65 ℃;GAPDH上游为5’-AGTTATTGTGTGCTGGGGACA-3’,下游为5’-CAGGCTCCAGSSGAAGTTGG-3’,扩增长度309 bp,退火温度62 ℃。

2 结 果
2.1AEG-1和MMP-9蛋白表达情况 AEG-1蛋白在78 kD处出现,MMP-9蛋白在92 kD处存在,β-actin在43 kD处存在。子宫内膜癌组织中AEG-1和MMP-9蛋白表达量均较子宫内膜单纯增生组织和正常子宫内膜组织中高(P均<0.05),子宫内膜单纯增生组织中较正常内膜组织中高(P均<0.05)。见图1。
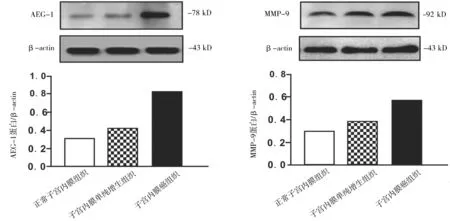
图1 各子宫内膜组织中AEG-1和MMP-9蛋白表达情况
2.2AEG-1和MMP-9蛋白表达与子宫内膜癌患者临床病理特征的关系 AEG-1和MMP-9蛋白表达与肌层浸润、病理分期和淋巴转移相关,在高病理分期、肌层浸润深度≥1/2和淋巴转移组织中表达量更高(P均<0.05),但与组织学分级和年龄无关(P均>0.05)。见表1。
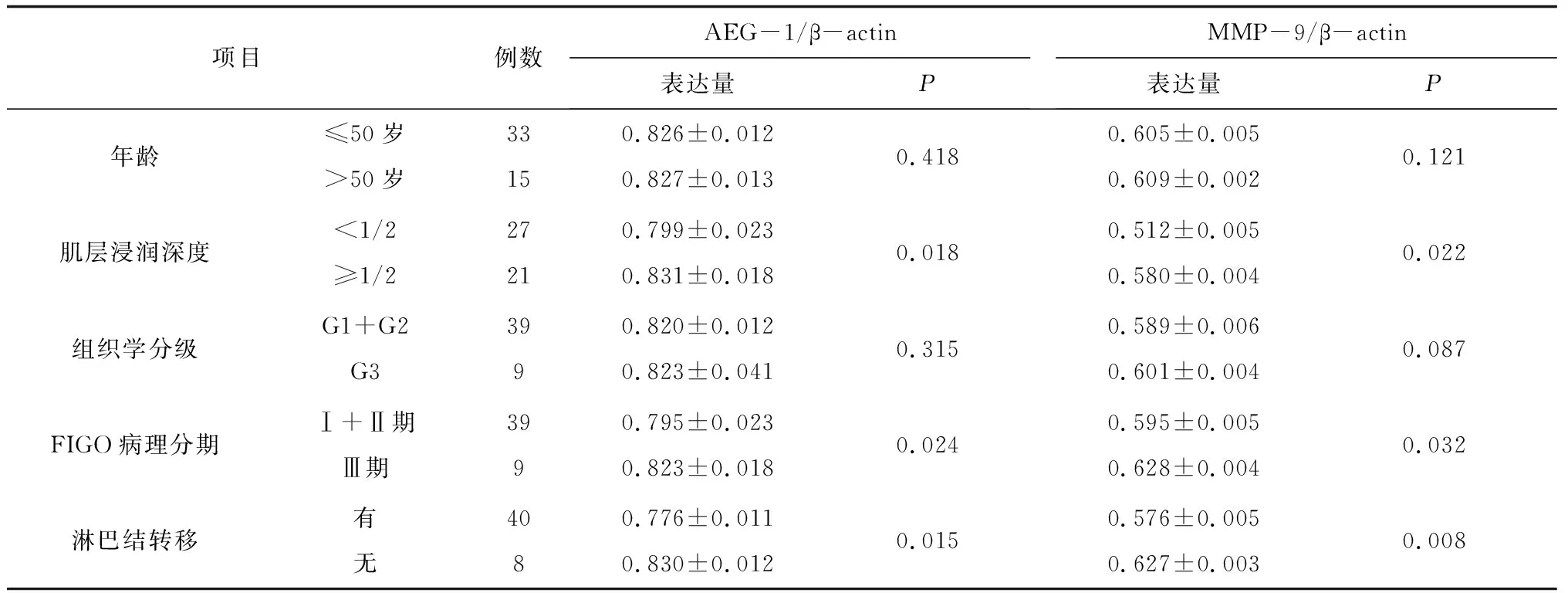
表1 AEG-1及MMP-9 蛋白表达量与子宫内膜癌患者临床病理特征的关系
2.3β-catenin和CUL4A mRNA水平表达情况 子宫内膜癌组织中β-catenin和CUL4A mRNA表达量均较子宫内膜单纯增生组织和正常子宫内膜组织中高(P均<0.05),子宫内膜单纯增生组织中β-catenin mRNA表达量较正常内膜组织中高(P<0.05)。见图2。
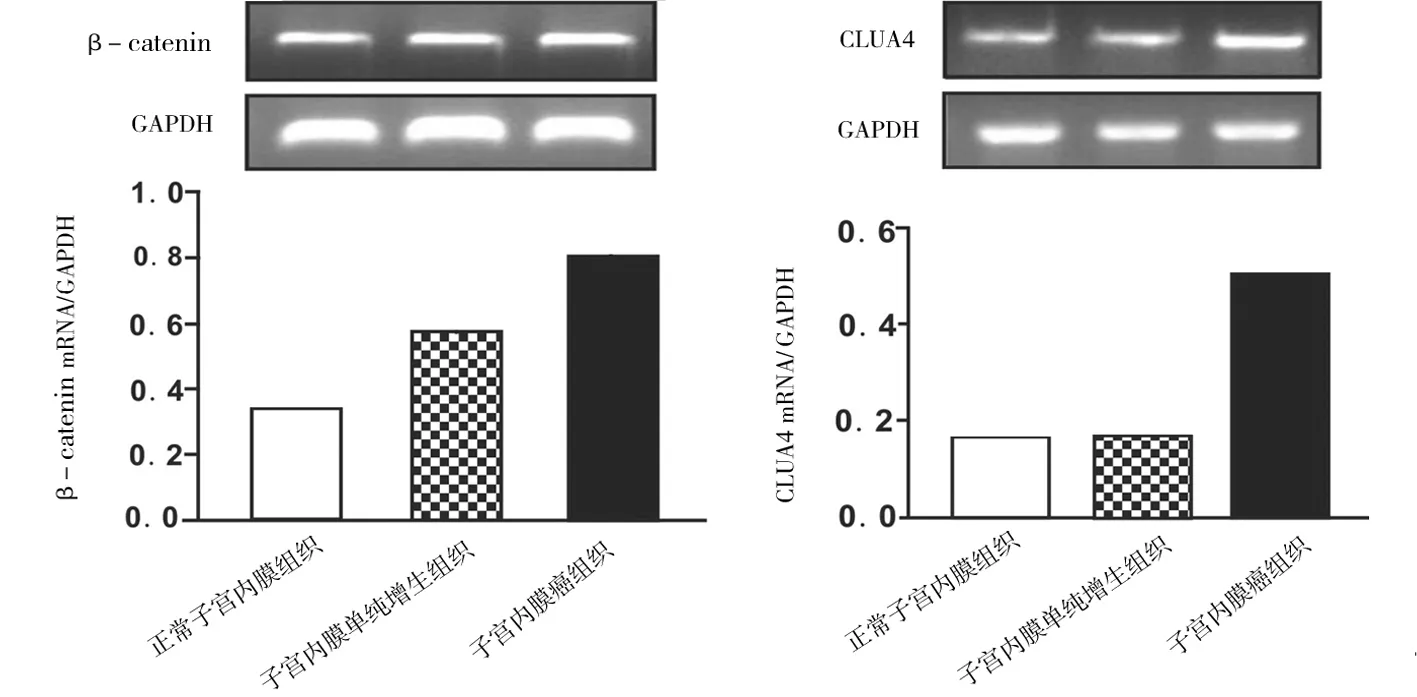
图2 各子宫内膜组织中 β-catenin和CUL4A mRNA表达情况
2.4AEG-1与MMP-9 蛋白及β-catenin mRNA和CUL4A mRNA表达的相关 Pearson相关分析显示,子宫内膜癌组织中AEG-1表达量和MMP-9蛋白表达量(r=0.970,P<0.001)、β-catenin mRNA表达量(r=0.611,P=0.032)、CUL4A mRNA表达量(r=0.603,P=0.020)均呈显著正相关。
3 讨 论
AEG-1作为近年来发现的新型基因,已发现其在各种癌症中过度表达,并参与肿瘤转移[7]。在肺癌细胞中,AEG-1的mRNA表达量显著高于正常细胞系,其高表达与临床分期和淋巴结转移相关[8]。Zhou等[9]发现AEG-1在高转移性癌细胞系中高表达,而AEG-1的表达与人肝癌细胞系的定向趋化性和黏附性呈正相关。 Wei等[10]发现AEG-1可以作为致癌基因,抑制AEG-1的表达可以促进细胞凋亡,降低细胞活力并削弱前列腺癌细胞的侵袭能力。在胃癌的研究中发现,AEG-1可通过上调eIF4E/cyclin D1信号通路促进胃癌的生长[11]。在非小细胞肺癌的肿瘤发生和恶化中,AEG-1也被显著激活,且可能通过AMPK信号通路发挥重要作用[12]。与上述研究相似,本研究发现AEG-1在子宫内膜癌组织中呈高表达,并与淋巴转移和病理严重性显著相关。表明AEG-1在子宫内膜癌发生发展中具有重要作用,但其具体机制仍需在细胞水平进一步研究。
MMPs属于蛋白水解酶,主要为细胞外基质分子的释放,其可影响细胞外基质(ECM)组分受体细胞活性的某些方面功能,例如ECM降解、细胞增殖、黏附和迁移[13]。已有研究证实,MMP可调节和控制肿瘤血管生成,是肿瘤浸润和转移的重要因素[14]。MMP-9为MMPs家族重要一员,其可使基底膜中的胶原蛋白Ⅳ退化,以促进癌细胞侵袭和转移[15],且在一些肿瘤如膀胱癌和宫颈癌中具有预测预后价值[6-7]。因此,MMP-9可作为评估癌细胞浸润、转移情况的代表因子。本研究结果发现,子宫内膜癌组织中MMP-9蛋白表达量明显增高,子宫内膜癌组织中AEG-1和MMP-9蛋白高表达与病理严重程度、淋巴转移和浸润均显著相关,且AEG-1与MMP-9二者表达也呈现正相关性。Liu等[16]在乳头状甲状腺癌研究中发现,敲低AEG-1会通过下调癌细胞中MMP-2/9表达而降低细胞的迁移和侵袭能力。综上提示,AEG-1高表达可促进子宫内膜癌转移和侵袭,AEG-1可能通过影响MMP-9表达调节子宫内膜癌转移、侵袭过程。
β-catenin作为Wnt信号通路下游转导分子,在很多研究中已被证实其活化可引起肿瘤的侵袭、转移、增殖以及血管发生[17]。CUL4A 是新发现的CRLs泛素连接酶,位于癌基因高表达区域,参与癌细胞的迁移、侵袭过程[18]。因此,本研究同时检测了子宫内膜癌组织中代表性侵袭基因表达情况,结果显示,子宫内膜癌组织中β-catenin及CUL4A mRNA表达量均显著增高,Pearson相关性分析发现AEG-1表达与β-catenin和CUL4A mRNA表达均呈显著正相关,表明AEG-1的异常表达可直接影响子宫内膜癌细胞侵袭和转移能力。
综上所述,子宫内膜癌组织中存在AEG-1异常高表达,其可影响相关侵袭、转移基因的表达及过程,从而影响子宫内膜癌的进展,但其具体作用机制仍需进一步研究证实。
利益冲突:所有作者均声明不存在利益冲突。

