东方百合‘Siberia’无病毒原原种直接再生体系建立
李雪艳,胡新颖,王伟东,白一光,周俐宏,杨迎东,赵 展
(辽宁省农业科学院花卉研究所,辽宁 沈阳 110161)
百合是世界上栽培最广泛的切花和盆栽花卉之一,栽培历史悠久,花色品种繁多,市场上有100多个形色各异的百合品种[1]。‘Siberia’百合花朵硕大、花朵纯白、花香浓郁是东方百合杂种系中一个经典品种,也是市面上最常见最受消费者欢迎的百合切花品种[2]。
百合种球繁育过程中很容易受到病毒感染,造成发育不良和品质退化。侵染百合的病毒种类有十余种,其中危害较为严重和常见的有百合无症病毒(Lily symptomless virus,LSV),百合斑驳病毒(Lily mottle virus,LMoV),黄瓜花叶病毒(Cucumber mosaic virus,CMV)。获得无病毒百合种源并通过组织培养技术大量扩繁是百合无病毒种球生产的重要途径[3]。
现代百合栽培品种多为种间高度杂合后代,其优良性状只能通过无性繁殖保持,组织培养是百合种球繁殖的主要方式,通过组织培养快速得到大量百合种苗、增加产出是世界百合产业的趋势。百合离体再生有多种途径,但如何提高繁殖系数、缩短繁育周期一直是研究的热点和难点。通过直接再生途径一次成苗,可以简化培养程序,降低成本,保持较低的变异率,有利于品种优良性状的保持,具有良好的产业化应用前景。本研究以无CMV、LSV、LMoV病毒的‘Siberia’种球为试材,探讨小鳞茎直接再生的最适植物生长调节剂种类和浓度,建立无病毒‘Siberia’试管小鳞茎直接再生体系,为繁育优质百合无病毒种球提供依据,进而为百合产业健康发展提供技术支撑。
1 材料与方法
1.1 材料
种球:东方百合‘Siberia’种球为荷兰进口,周径14~16 cm,RT-PCR检测CMV、LSV、LMoV病毒阴性。
培养基:基本培养基采用MS固体培养基(含MS基本培养基,蔗糖30 g/L,琼脂6.5 g/L,pH为5.8),于121 ℃条件下灭菌20 min。根据不同试验添加不同激素或试剂。
试剂(激素):苄基腺嘌呤(N6-benzyladenine,6-BA)、萘乙酸(Naphthylacetic acid,NAA)、2,4-二氯苯氧乙酸(2,4-Dichlorophenosyacetic acid, 2,4-D)、激动素(Kinetin,KT)、NaClO、蔗糖、琼脂均为分析纯,购自北京康贝斯生物科技有限公司。
试验设计:根据小鳞茎诱导、膨大、生根等不同阶段分别设计单因素试验,不同激素配方为试验考察因素。
1.2 方法
1.2.1 外植体接种
由外向内取第2~5层鳞片,流水冲洗30 min后用0.2%~0.5%的洗衣粉水浸泡10 min,在自来水下冲洗干净。然后用75%酒精灭菌30 s,再用10%的NaClO溶液浸泡10 min,期间不断进行摇动,最后用无菌水冲洗5~6次。沿鳞片边缘切去1 mm,然后自基部横向切成0.2~0.3 cm的小块,接入培养基中培养。
组培苗培养温度为25±1 ℃。
1.2.2 小鳞茎诱导配方比较试验
1.2.2.1 不同浓度6-BA、NAA对无菌苗鳞片直接再生小鳞茎的影响试验 从无菌苗中选取直径大于1 cm的小鳞茎,剥取鳞片,将鳞片四周切去,然后切成0.2~0.3 cm的小块,接种至添加不同浓度6-BA(0.5、1.0 mg/L)和NAA(0.1、0.3、0.5 mg/L)培养基中(表1),45 d后调查统计诱导率及诱导系数。
1.2.2.2 不同浓度2,4-D对无菌苗鳞片直接再生小鳞茎的影响试验 将无菌苗鳞片(鳞片状态与处理方式同1.2.2.1)置于添加不同浓度2,4-D(0.1、0.5、1.0、1.5、2.0、2.5 mg/L)MS培养基中(表2),45 d后调查统计诱导率及诱导系数。
1.2.2.3 不同浓度NAA、KT对无菌苗鳞片直接再生小鳞茎的影响试验 将无菌苗鳞片(鳞片状态与处理方式同1.2.2.1)置 于 添 加 不 同 浓 度NAA(0.05、0.1、0.2 mg/L)与KT(0.05、0.1 mg/L)培养基中(表3),45 d后调查统计诱导率及诱导系数。
1.2.2.4 不同浓度2,4-D、KT对无菌苗鳞片直接再生小鳞茎的影响试验 将无菌苗鳞片(鳞片状态与处理方式同1.2.2.1)置于添加不同浓度2,4-D(1.0、2.0 mg/L)、KT(0.05、0.1 mg/L)培养基中(表4),45 d后调查统计诱导率及诱导系数。
1.2.3 小鳞茎膨大激素配方筛选试验
将直径0.5 cm左右的小鳞茎转入添加30、60、90、120 g/L蔗糖的培养基中,观察并记录小鳞茎的生长情况。
1.2.4 生根培养激素配方筛选试验
将直径大于1 cm小鳞茎接种于添加不同浓度NAA(0.1、0.2、0.5 mg/L)、IBA(0.01、0.1 mg/L)的MS培养基中(表5),45 d调查根长、生根率及根数。
1.2.5 练苗移栽
将生根后的组培苗移至4 ℃冷库处理90 d,于20 ℃下练苗7 d,而后将小鳞茎从瓶中取出洗去根部粘着的琼脂,用化学杀菌剂百菌清500倍消毒30 min,栽植到草炭和蛭石混合基质(体积比为1∶1)中,观察并统计小苗移栽成活率。
1.3 数据统计及分析方法
试验设3次生物学重复,45 d观测并调查数据。各处理之间差异显著性用软件DPS 7.05软件分析,统计方法采用邓肯新复极差法和One-Way ANOVA。
2 结果与分析
2.1 不同浓度6-BA、NAA对无菌苗鳞片直接再生小鳞茎的影响
试验结果表明,‘Siberia’的无菌苗鳞片在添加6-BA与NAA的培养基中主要以不定芽诱导为主,少量以愈伤组织形态发生。从表1看出,各处理的不定芽诱导率没有显著差异,但不定芽诱导系数差异显著,且诱导系数随着6-BA与NAA浓度的增加而增大,处理5即MS+6-BA 1.0 mg/L+NAA 0.3 mg/L诱导系数最高,可达3.92。但是,6-BA与NAA浓度越高,不定芽丛莲座化现象越严重,小鳞茎形态畸形越明显(图版1),且莲座化的小鳞茎在后续增殖与膨大培养中仍会表现为畸形,不适于百合种球的工厂化繁育。综上,高浓度的6-BA与NAA可以促进不定芽萌发,同时也会加重小鳞茎的莲座化现象。
2.2 不同浓度2,4-D对无菌苗鳞片直接再生小鳞茎的影响
接种14 d左右,在鳞片内侧直接再生小鳞茎,随着培养时间的增加,小鳞茎直径不断增加(图版2)。不同浓度2,4-D对‘Siberia’鳞片再生小鳞茎诱导率差异较大,其中处理2、处理4与处理6有10%~20%左右的愈伤诱导率(数据未列出)。当2,4-D浓度为0.5 mg/L时,小鳞茎诱导系数最高;当2,4-D浓度为1.0 mg/L时,小鳞茎诱导率最高且小鳞茎诱导系数较高(表2),综合考虑处理3即MS培养基中添加1.0 mg/L 2,4-D最适宜‘Siberia’鳞片诱导小鳞茎。
2.3 不同浓度NAA、KT对无菌苗鳞片直接再生小鳞茎的影响
无菌苗鳞片在添加不同浓度NAA、KT的培养基中同样可直接再生小鳞茎。不同浓度NAA、KT对‘Siberia’鳞片再生小鳞茎诱导率影响差异不大(表3)。与6-BA不同,NAA与KT配比诱导的小鳞茎球形周正,无莲座化现象,且诱导系数较高(图版3)。处理2与处理3的小鳞茎诱导系数均可达到3.7,综合比较小鳞茎诱导率,处理2即MS培养基中添加0.05 mg/L NAA与0.1 mg/L KT最适宜‘Siberia’鳞片诱导小鳞茎。
2.4 不同浓度2,4-D、KT对无菌苗鳞片直接再生小鳞茎的影响
试验表明,培养基中同时添加2,4-D与KT既有利于试管内小鳞茎直接再生,同时也伴有少量愈伤组织的发生。如表4所示,同时添加2,4-D与KT的小鳞茎诱导系数要低于单独添加2,4-D。当2,4-D为2.0 mg/L,KT为0.05 mg/L时,小鳞茎的诱导系数最低,这是因为部分鳞片诱导形成愈伤组织。而处理2即MS+2,4-D 1.0 mg/L+KT 0.1 mg/L培养基更适于小鳞茎的诱导,诱导系数达到2.73,诱导率为100%(图版4)。
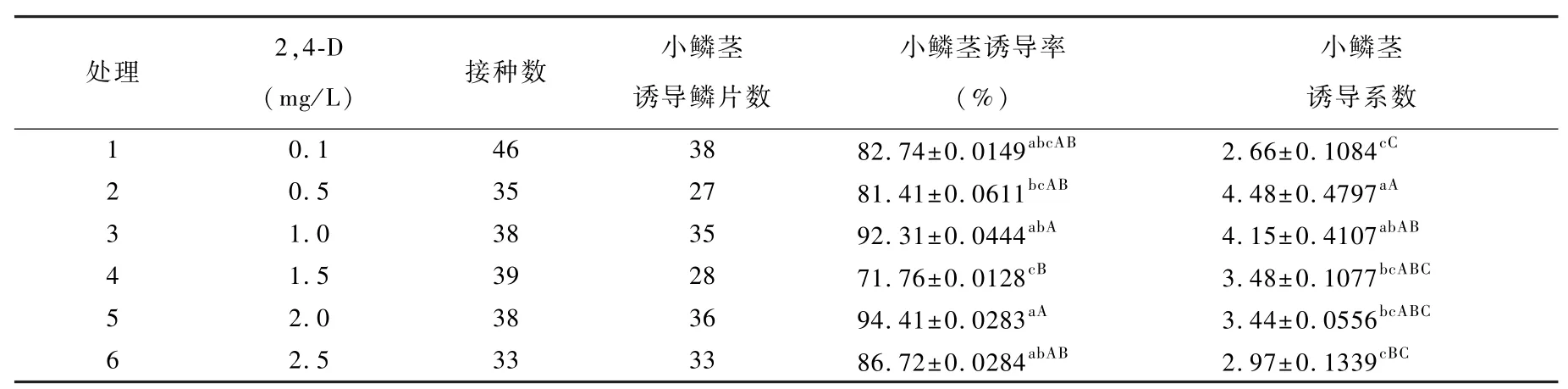
表2 不同浓度2,4-D对鳞片直接再生小鳞茎的影响Table 2 Effects of combinations of 2,4-D on adventitious bud induction of scales explants

表3 不同浓度NAA、KT对鳞片直接再生小鳞茎的影响Table 3 Effects of combinations of BA with NAA on adventitious bud induction of scales explants
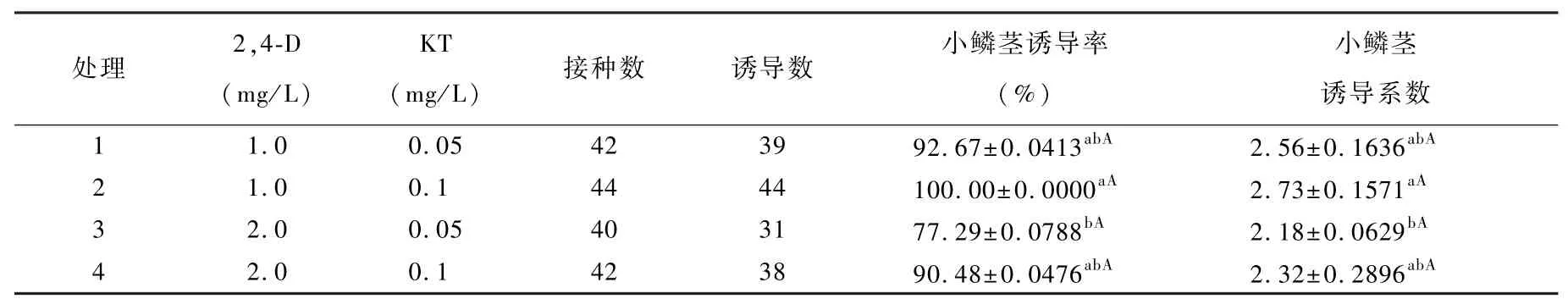
表4 不同浓度2,4-D、KT对鳞片直接再生小鳞茎的影响Table 4 Effects of combinations of 2,4-D with KT on adventitious bud induction of scales explants
2.5 不同浓度蔗糖对小鳞茎膨大的影响
在MS培养基中添加蔗糖可以使小鳞茎体积增大,但增大的幅度随着培养基中蔗糖浓度的升高有显著不同(图1)。培养基中添加90 g/L蔗糖可使小鳞茎达到最大周径3.34 cm,同时小鳞茎生根效果也较好,最适宜‘Siberia’小鳞茎膨大。
2.6 不同浓度IBA、NAA对小鳞茎生根的影响
在MS培养基中添加不同浓度NAA与IBA,均能使‘Siberia’鳞茎生根,且生根率都能达到100%,但是在根长和根数方面有差异(表5)。
就生根数而言,单独添加NAA的培养基生根效果要优于单独添加IBA,其中处理2即添加0.2 mg/LNAA生根数最多。而处理7即同时添加0.2 mg/LNAA与0.1 mg/IBA生根数最多,可达12条根。对于根长来说,添加IBA的效果要优于仅含NAA的培养基,其中处理8 MS+IBA 0.01 mg/L与处理7 MS+ NAA 0.2 mg/L+IBA 0.1 mg/L效果最好。结合根长与生根数,最终培养基MS+ NAA 0.2 mg/L+IBA 0.1 mg/L更适合‘Siberia’小鳞茎诱导生根,且生根情况适合移栽(图版5)。
2.7 炼苗移栽
经炼苗后的组培苗鳞茎移栽至消毒完全的基质中,各处理得到百合种球成活率均达到100%,且生长发育正常(图版6)。
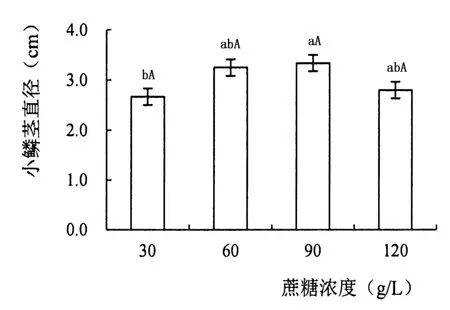
图1 不同蔗糖浓度对小鳞茎膨大的影响Figure 1 Influence of different concentrations of sucrose on bulb expansion

表5 不同浓度NAA、IBA对‘Siberia’生根的影响Table 5 Influence of different concentrations of NAA and IBA on rooting of ‘Siberia’

图版 1.6-BA、NAA诱导莲座状不定芽; 2.2,4-D诱导小鳞茎; 3.NAA、KT诱导产生小鳞茎; 4.2,4-D、KT诱导产生小鳞茎; 5.移栽后生长情况
3 结论与讨论
综上所述,本研究通过探讨添加不同种类和浓度的植物生长调节剂与不同浓度碳源的效果,最终确定东方百合‘Siberia’试管内小鳞茎直接再生的最适培养基为MS+2,4-D 1.0 mg/L,小鳞茎膨大最适培养基为MS+蔗糖90 g/L,生根最适培养基为MS+ NAA 0.2 mg/L+IBA 0.1 mg/L,从而建立完整的‘Siberia’无病毒原原种直接再生体系。
使用不同外植体建立百合试管内再生体系,国内外已经开展了许多研究[4],以‘Siberia’百合鳞片[5,6]、叶片[7,8]、无菌苗叶片[9]、花器官[10~12]、茎尖为外植体成功建立了组培快繁体系[13]。但是从产业需求出发,针对如何降低百合种球带毒率,如何提高增殖系数,如何缩短繁育周期的研究相对较少。本试验以无病毒百合无菌苗鳞片为外植体建立试管内直接再生体系,既可以获得无病毒百合原始繁殖材料,又可以提高繁殖效率,缩短繁育周期,降低生产成本,实用性强。
鳞片的分化主要以两种方式进行:一是先形成愈伤组织,然后从愈伤组织上产生不定芽;另一种是通过直接出芽的方式形成不定芽。崔均涛等研究发现1.0~1.5 mg/L 2,4-D最适于‘Siberia’鳞片诱导形成愈伤组织[15],高义霞报道0.2 mg/L NAA+2 mg/L 6-BA+100 mg/L LH有利于愈伤组织的形成[16],兰倩研究表明在添加0.2 mg/L NAA+0.7 mg/L 6-BA的培养基中鳞片诱导形成不定芽[17],赵庆芳等认为低浓度的KT有利于一次性成苗[14],本试验则发现NAA 0.05 mg/L+KT 0.1 mg/L最适于小鳞茎直接形成,这可能与添加的外源激素的种类和浓度配比、以及取材时间与接种方式有关。

